文章信息
- 王志英, 张福丽, 王占斌
- Wang Zhiying, Zhang Fuli, Wang Zhanbin
- 小黑杨转几丁质酶基因及酶活性
- Transformation of Chitinase Gene into Populus simonii×P. nigra and Chitinase Activity of Transgenic Plants
- 林业科学, 2010, 46(2): 147-151.
- Scientia Silvae Sinicae, 2010, 46(2): 147-151.
-
文章历史
- 收稿日期:2008-11-14
-
作者相关文章
2. 周口师范学院 周口 466000
2. Zhoukou Normal University, Henan Province Zhoukou 466000
小黑杨(Populus simonii ×P. nigra)是以小叶杨为母本、欧洲黑杨为父本,经人工杂交后选种而得(赵天锡等, 1994), 具有速生、适应性强、抗逆性强及材质好等优点(周以良等, 1986), 是林业生产上推广应用的优良品种之一。但是随着杨树的广泛栽培,真菌病害的发生越来越严重,已经严重威胁到了杨树生长。几丁质酶是植物在受到病原菌侵染时所表达出的一组蛋白质,可水解真菌细胞壁的主要成分——几丁质,从而抑制真菌的生长。当植物在受到病原体入侵后,自身的几丁质酶等防卫蛋白在细胞内积累,但这些蛋白往往表达量不足或是表达期太晚,以致不能有效地使植物体免受病原菌危害。将外源几丁质酶注入植物细胞中,可有效破坏病菌的结构,阻止其侵入。而通过基因工程手段人为降低植物体内几丁质酶的活性后,植物变得更易感病,这些充分说明几丁质酶在植物抗病中的作用(Boller, 1987; 吴志刚等, 2002)。Brogue等(1991)将菜豆(Phaseolus vulgaris)几丁质酶基因转入烟草(Nicotiana tobacum)和油菜(Brassica napus),组成型表达菜豆几丁质酶基因的转基因植株病情发展缓慢,死苗率大大降低,这是首次报道的转几丁质酶基因的植物具抗真菌病特性。另外大量的试验也表明,植物中导入外源的几丁质酶基因后,其抗病性得到明显提高(Zhu et al., 1994; Tabei et al., 1998; Bliffeld et al., 1999; Yamamoto et al., 2000; Kishimoto et al., 2002; Itoh et al., 2003; Mondal et al., 2003; Sridevi et al., 2003; Takahashi et al., 2005; Nandakumar et al., 2007; Shin et al., 2008)。
目前,杨树基因转化主要集中在抗除草剂与抗虫的研究上,对于抗真菌病的研究还很少。本研究通过农杆菌介导把外源的几丁质酶基因导入小黑杨体内,以期获得抗真菌病的小黑杨植株,并为其遗传转化及抗性育种提供理论依据。
1 材料与方法 1.1 材料小黑杨组培苗由东北林业大学森林病虫害生物学实验室保存。携带菜豆几丁质酶基因的中间表达载体PBch、含植物表达载体的根癌农杆菌(Agrobacterium tumefaciens)LBA4404均由哈尔滨师范大学遗传学科惠赠。外源基因chitinase在植物表达载体上的结构如图 1。
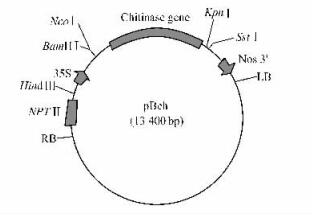
|
图 1 质粒pBch结构 Figure 1 Schematic representation of plasmid pBch |
分化培养基为:MS+0.5 mg·L-1 6-BA+0.1 mg·L-1 NAA;生根和继代培养基为:WPM+0.4 mg·L-1 IBA,约20天继代1次。
1.2 方法1) 卡那霉素和头孢唑林钠对叶片分化的影响 选取培养20天左右生长一致的健壮叶片,横过主脉剪成(0.5~1) cm×(0.5~1) cm的叶块,放入分别附加有选择性和抑菌性抗生素的分化培养基上,每盘放9个叶块,每一浓度设3个重复,每周更换1次培养基,3周时观察叶片变化。卡那霉素的浓度分别设为0, 5, 10, 15, 20, 30, 40, 50, 60, 70, 80 mg·L-1。头孢唑林钠浓度分别设为0, 150, 200, 250, 300, 350, 400, 450, 500, 600, 700, 800, 900, 1 000, 1 100 mg·L-1。确定头孢唑林钠对农杆菌的抑制效果时,参考常玉广等(2004)和笔者试验经验,使用临界浓度为700 mg·L-1。
2) 农杆菌介导的几丁质酶基因转化 选择完全展开、深绿色的小黑杨叶片,横过主脉剪成(0.5~1) cm×(0.5~1) cm的叶块,放到MS分化培养基上预培养0, 2, 3, 4, 5天或7天,然后浸入到农杆菌菌液中进行侵染,侵染时间分别为3, 6, 10, 15, 18, 20 min。取出侵染后的叶片用无菌滤纸汲干菌液后,转入到MS固体培养基上,25 ℃左右暗培养2, 3, 4, 5天或7天。
3) 转基因植株的分子检测 在PCR检测基础上,对阳性植株进行PCR-Southern检测和RT-PCR分析,以确定外源基因在转基因植株中的表达情况。CTAB法提取RNA后用RNase-Free DNase消化污染的DNA。RT-PCR反应条件为50 ℃预变性30 min,94 ℃变性2 min,94 ℃变性30 s,55 ℃扩增30 s,72 ℃延伸1 min,4 ℃终止反应。引物:5’-GCA GTG TGG AAG GCA AGC AG-3’和5’-CTG AGA GGT GAC AAG GTC AG-3’由上海生工合成。
4) 转基因植株几丁质酶活性测定 采用氨基葡萄糖法测定转基因植株叶片几丁质酶活性。首先从转基因植株叶片中提取几丁质酶液,用紫外分光光度计测530 nm处的吸收值以确定外切酶活性及总酶活性。根据标准曲线方程,将OD值换算成氨基葡萄糖产量,以每小时分解胶体壳聚糖产生1 μg氨基葡萄糖为1个酶活性单位。标准曲线方程为:Y=329.82X-3.324 9 [X:OD值;Y:氨基葡萄糖量(μg);直线相关系数r=0.992 3],最后计算出内切酶活性(内切酶活性=总酶活性-外切酶活性)。
2 结果与分析 2.1 卡那霉素和头孢霉素对叶片的影响卡那霉素对小黑杨叶片的分化和生长具有明显的抑制作用。培养基中卡那霉素的含量小于20 mg·L-1时叶片变形,并在一定时间内呈现绿色,同时还不断伸长变大, 但再生能力受到抑制,产生的不定芽逐渐变白;当卡那霉素浓度达到30 mg·L-1时,叶片的分化和生长都明显受到抑制,仅在叶片主脉的伤口处形成极少量的芽;当达到40 mg·L-1时,叶片黄化,无再生芽形成,叶片不膨大、无愈伤;浓度再增加时,叶片就会逐渐变褐、死亡(图 2)。从试验中可知,40 mg·L-1的卡那霉素完全可以抑制小黑杨叶片芽的分化,故确定40 mg·L-1的卡那霉素为叶片转化筛选的临界浓度。

|
图 2 卡那霉素对小黑杨叶片分化的影响 Figure 2 Effect of kanamycin on leaf differentiation of Populus simonii×P. nigra |
接种在MS培养基(附加有不同浓度头孢霉素)上的小黑杨叶片经过20天的生长,除接种在含头孢唑林钠1 000, 1 100 mg·L-1培养基上的叶片稍微发黄外,其余浓度培养基上的叶片均正常生长,与对照基本保持一致,说明小黑杨叶片对头孢唑林钠具有一定抗性,筛选培养时加入700 mg·L-1的头孢霉素不会对小黑杨叶片分化产生显著影响。
2.2 预培养时间对叶片分化和转化的影响虽然随着预培养时间的延长小黑杨叶片分化率逐渐提高, 但转化率却未随分化率的增加而增加。预培养时间2天以下分化率和抗性芽率均较低,预培养时间为3~4天二者的变动比较一致,其中4天时抗性芽率达到2.08 %,分化率为12.5%。预培养大于4天分化率显著增加,但抗性芽率却有减少的趋势,其中5天时分化率和抗性芽率分别为13.7%和1.18%。这可能由于,随着预培养时间的延长,叶片边缘细胞已经出现芽的分化。但同时,伤口修复时间过长时,不利于农杆菌从伤口侵入,从而降低转化率。不经过预培养直接用于侵染时,也能得到转化植株。通过比较确定小黑杨遗传转化时预培养的时间以3~4天为最好。
2.3 侵染时间对叶片分化和转化的影响侵染3 min以下时,200 mg·L-1的头孢霉素完全抑制了农杆菌的生长,叶片不能分化;侵染3~4 min时,虽有少量的叶片分化,但卡那霉素抗性芽率为0;侵染时间6~15 min时,叶片的分化和卡那霉素抗性芽明显增多;达到15 min时,不仅叶片分化增多(13.53%),抗性芽率也达到4.17%;侵染时间再增加,分化率和抗性芽率都迅速下降,其中侵染时间为18 min时,分化率和抗性芽率分别为2.21%和0.06%;达到20 min时,由于菌液毒害作用使叶片很快褐化或死亡,无叶片分化和抗性芽形成。同时,侵染时间过长头孢无法抑制农杆菌的生长,从而导致叶片坏死。结果表明,侵染时间控制在6~15 min时对小黑杨叶片的遗传转化比较适合。
2.4 共培养时间对叶片分化和转化的影响共培养2,3,4天小黑杨叶片的分化率分别为8.5%, 15.3%和13.8%,而抗性芽率分别为1.08%, 3.09%, 2.93%。共培养5天和7天分化率分别为14.76%和16.6%,但抗性芽率为0。这是因为共培养时间过长,大量的黄化芽经不起随后卡那霉素的筛选作用而逐渐白化,最终死亡。因此,对于小黑杨叶片的遗传转化,共培养时间在2~4天时比较合适,以3天最好。
2.5 PCR-Southern杂交检测及RT-PCR分析对PCR检测呈阳性的植株进行了PCR-Southern杂交检测。结果表明, 被检测样品与阳性对照均显示出较强的杂交信号(图 3), 而非转基因植株无杂交信号。说明外源几丁质酶基因已经成功导入并整合进小黑杨的基因组中。
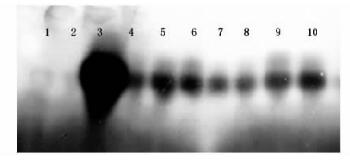
|
图 3 转基因植株的PCR-Southern杂交检测 Figure 3 PCR-Southern hybridization assay of transgenic plants 1:DNA marker; 2:非转基因植株Non-transformed plant; 3:质粒阳性对照Plasmid DNA as positive control;4-10:转基因植株Transgenic plants. |
在进行RT-PCR扩增之前,要用无RNase的DNaseⅠ处理提取的RNA样品,目的是去除总RNA中的DNA污染。在确定所提取的RNA样品中不存在DNA污染后,用于RT-PCR扩增。RT-PCR扩增结果见图 4,泳道c为阴性对照,3, 4, 7, 9和13无预期条带出现,可能是外源基因在转录水平上发生了沉默现象。1, 2, 5, 6, 8, 10, 11, 12都扩增出了预期的条带(1 kb)。RT-PCR扩增结果表明,8株转基因植株中几丁质酶基因已在转录水平上稳定表达,进一步证实了外源几丁质酶基因已整合进小黑杨的基因组中。
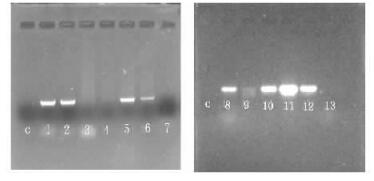
|
图 4 转基因植株RT-PCR分析 Figure 4 RT-PCR analysis of transgenic plants c:对照Control;1-13:抗性植株Resistant plants. |
检测的13株转基因苗木中有9株叶片几丁质酶活性明显高于对照植株(CK, 非转基因植株)(图 5),其中11号植株与对照的酶活性比值高达3.093。部分转基因植株(3号、4号、7号和13号)几丁质酶活性低于对照。这可能是因为外源基因在受体中没有表达,发生了基因沉默(失活)现象,沉默(失活)的原因可能是外源基因插入到了甲基化程度高、转录活性低的异染色质上,或是被植物的限制修饰系统识别,通过甲基化使之失活,此现象有待于进一步的试验分析。
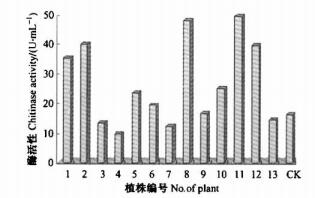
|
图 5 转基因植株几丁质酶活性 Figure 5 Chitinase activity of transgenic plants 1-13:转基因植株transgenic plants; CK:非转基因植株Non-transgenic plant. |
农杆菌介导法是目前应用最为普遍的方法,被认为是双子叶植物最理想的转化方法,李华平等(1996)认为农杆菌介导法明显比基因枪法转化效果好。目前利用农杆菌介导法已获得多种杨树转基因植株(樊军锋等,2002;张冰玉等,2005;邹维华等,2006)。本研究利用农杆菌介导的叶盘法成功地将外源抗真菌病的几丁质酶基因导入了小黑杨的基因组中,为小黑杨遗传转化提供了试验依据。
预培养能使受伤外植体的生命力得到恢复同时促进细胞分裂,提高外源基因的瞬时表达和转化率(Sharma,2000)。预培养、侵染时间和共培养直接影响小黑杨叶片的分化和转化效率,通过试验确定了小黑杨有效的转化路线:外植体预培养3~4天后放入农杆菌悬液中侵染6~15 min,在黑暗条件下共培养3天。
对经PCR及PCR-Southern分子检测为阳性的13个植株进行了RT-PCR检测,13株阳性植株中有5株未得到扩增产物,说明外源基因在转基因植株中未能正常表达,推测可能是发生了转基因的沉默(或失活)现象;转基因植株几丁质酶活性的测定表明,9株转基因苗木叶片几丁质酶活性明显高于对照植株。对转抗病基因植物而言,一般认为其抗性与表达的几丁质酶量呈正相关。但有研究表明,烟草表达哈茨木霉(Trichoderma harzianum)几丁质酶的量与抗性并未呈现相关性(Garcia et al., 1997)。由于转基因小黑杨几丁质酶活性测定是以组培试管苗为试材,土壤栽培后环境因素是否影响外源基因表达、酶活性和抗病性, 有待进行系统的研究。
常玉广, 刘桂丰, 姜静, 等. 2004. 小黑杨抗虫基因的遗传转化[J]. 东北林业大学学报, 32(6): 30-31. |
樊军锋, 韩一凡, 李玲. 2002. mtlD/gutD双价基因转化美洲黑杨×青杨的研究[J]. 林业科学, 38(6): 30-35. DOI:10.11707/j.1001-7488.20020606 |
李华平, 胡晋生, KellyBarry, 等. 1996. 黄瓜花叶病毒香蕉株系衣壳蛋白转基因烟草的研究[J]. 病毒学报, 12(2): 162-169. |
吴志刚, 朱旭芬. 2002. 几丁质酶的分子生物学特性及其在转基因植物中的应用[J]. 生命科学, 14(2): 117-121. |
张冰玉, 苏晓华, 黄秦军, 等. 2005. 转果聚糖蔗糖转移酶基因银腺杨的获得[J]. 林业科学, 41(3): 48-52. DOI:10.11707/j.1001-7488.20050308 |
赵天锡, 陈章水. 1994. 中国杨树集约栽培. 北京: 中国科学技术出版社, 7-9, 269, 410-411.
|
周以良, 董世林, 聂绍荃. 1986. 黑龙江树木志[M]. 哈尔滨: 黑龙江科学技术出版社: 118.
|
邹维华, 赵强, 崔德才, 等. 2006. 反义磷脂酶Dγ基因与几丁质酶基因转化美洲黑杨G2[J]. 林业科学, 42(1): 37-42. |
Bliffeld M, Mundy J, Potrykus I, et al. 1999. Genetic engineering of wheat for increased resistance to powdery mildew disease[J]. Theoretical Appl Genetics, 98(6/7): 1079-1086. |
Boller T. 1987. Hydrolytic enzymes in plant disease resistance[J]. Plant-Microbe Interactions Molecular and Genetic Perspectives. New York, USA: Macmillan Publishing Company: 385-414. |
Brogue K, Chet I, Holliday M, et al. 1991. Transgenic plant with enhanced resistance to the fungal pathogen Rhizoctonia solani[J]. Science, 254(5035): 1194-1197. DOI:10.1126/science.254.5035.1194 |
Garcia I, Cubero B, Lorito M, et al. 1997. Transgenic tobacco expressing a Trichoderma harzianum endochitinase encoding gene[J]. Phytopathology, 87(Suppl): 32-35. |
Itoh Y, Takahashi K, Takizawa H, et al. 2003. Family 19 chitinase of Streptomyces griseus HUT6037 increases plant resistance to the fungal disease[J]. Bioscience Biotechnology and Biochemistry, 67(4): 847-855. DOI:10.1271/bbb.67.847 |
Kishimoto K, Nishizawa Y, Tabei Y, et al. 2002. Detailed analysis of rice chitinase gene expression in transgenic cucumber plants showing different levels of disease resistance to gray mold (Botrytis cinerea)[J]. Plant Science, 162(5): 655-662. DOI:10.1016/S0168-9452(01)00602-1 |
Mondal K K, Chatterjee S C, Viswakarma N, et al. 2003. Chitinase-mediated inhibitory activity of brassica transgenic on growth of Alternaria brassicae[J]. Current Microbiology, 47(3): 171-173. DOI:10.1007/s00284-002-3980-6 |
Nandakumar R, Babu S, Kalpana K, et al. 2007. Agrobacterium-mediated transformation of indica rice with chitinase gene for enhanced sheath blight resistance[J]. Biologia Plantarum, 51(1): 142-148. DOI:10.1007/s10535-007-0027-7 |
Sharma K K, Anjaiah V. 2000. An efficient method for the production of transgenic plants of peanut (Arachis hypogaea L.)through Agrobacterium tumefaciens-mediated genetic transformation[J]. Plant Science, 159(1): 7-19. DOI:10.1016/S0168-9452(00)00294-6 |
Shin S Y, Mackintosh C A, Lewis J, et al. 2008. Transgenic wheat expressing a barley class Ⅱ chitinase gene has enhanced resistance against Fusarium graminearum[J]. Journal of Experimental Botany, 59(9): 2371-2378. DOI:10.1093/jxb/ern103 |
Sridevi G, Sabapathi N, Meena P, et al. 2003. Transgenic indica rice variety Pusa Basmati 1 constitutively expressing a rice chitinase gene exhibits enhanced resistance to Rhizoctonia solani[J]. Journal of Plant Biochemistry and Biotechnology, 12(2): 93-101. DOI:10.1007/BF03263168 |
Tabei Y, Kitade S, Nishizawa Y, et al. 1998. Transgenic cucumber plants harboring a rice chitinase gene exhibit enhanced resistance to gray mold (Botrytis cinerea)[J]. Plant Cell Reports, 17(3): 159-164. DOI:10.1007/s002990050371 |
Takahashi W, Fujimori M, Miura Y, et al. 2005. Increased resistance to crown rust disease in transgenic Italian ryegrass (Lolium multiflorum Lam.) expressing the rice chitinase gene[J]. Plant Cell Reports, 23(12): 811-818. DOI:10.1007/s00299-004-0900-1 |
Yamamoto T, Iketani H, Ieki H, et al. 2000. Transgenic grapevine plants expressing a rice chitinase with enhanced resistance to fungal pathogens[J]. Plant Cell Reports, 19(7): 639-646. DOI:10.1007/s002999900174 |
Zhu Q, Maher F A, Masoud S, et al. 1994. Enhanced protection against fungal attack by constitutive co-expression of chitinase and glucanase genes in transgenic tobacco[J]. Bio-Technology, 12(8): 807-812. |
 2010, Vol. 46
2010, Vol. 46

