文章信息
- 李秧秧, 石辉, 邵明安
- Li Yangyang, Shi Hui, Shao Ming'an
- 黄土丘陵区乔灌木叶水分利用效率及与水力学特性关系
- Leaf Water Use Efficiency and Its Relationship with Hydraulic Characteristics in Eight Dominant Trees and Shrubs in Loess Hilly Area during Vegetation Succession
- 林业科学, 2010, 46(2): 67-73.
- Scientia Silvae Sinicae, 2010, 46(2): 67-73.
-
文章历史
- 收稿日期:2009-03-02
-
作者相关文章
2. 西安建筑科技大学环境与市政工程学院 西安 710055
2. School of Environmental and Municipal Engineering, Xi'an University of Architecture and Technology Xi'an 710055
水分是影响植被演替过程的重要环境因子,决定着植被演替的方向与动力。植物水分利用效率(WUE)的变化是了解植被演替过程中植物生理生态适应机制的1个重要方面。目前对植被演替过程中WUE的研究主要集中在叶水平WUE(包括瞬时WUE,即净光合速率与蒸腾速率之比,和利用稳定性碳同位素技术推算的长期WUE)上,如Nogueira等(2004)用光合仪测定了处于不同演替阶段的巴西20个热带树种的光合特性,发现演替早期种瞬时WUE高于演替后期种,Guehl等(1998)的研究也指出一些演替后期的优势树种其叶稳定性碳同位素组成值(δ13C)低于演替早期树种,暗示其长期WUE低于演替早期树种,Bonal等(2000)也发现一些演替后期树种具有极低的叶δ13C,但Huc等(1994)通过稳定性碳同位素技术研究法属几内亚热带雨林中不同演替阶段树种的长期WUE,发现演替后期树种的长期WUE高于演替早期树种。从这些研究可以看出:对不同演替阶段木本植物WUE的变化规律并无一致的结论,原因可能与WUE同时受物种和环境条件的复杂影响有关。在我国,这方面研究相对开展较少。由于植物叶片瞬时WUE主要取决于净光合速率与蒸腾速率,而这两者又与植物的水力学性质密切相关(Hubbard et al., 2001;Maherali et al., 2006),因此植物水力学特性的差异可能是影响叶WUE变化的重要机制。研究表明:演替早期树种具有高的导水率,且对栓塞的抵抗能力弱(Becker et al., 1999;Tyree et al., 1988;1991a; 1991b;1998),不同演替阶段植物水力学特性存在差异。本文探讨了黄土丘陵区植被演替过程中几种主要乔灌木水分利用效率及其水力学特性的变化,以期揭示植被恢复过程中不同物种水分利用效率的变化及其生理机制,为黄土高原退化生态系统恢复和重建提供理论参考。
1 材料与方法 1.1 研究区概况试验在陕西省宜川县铁龙湾林场附近的松峪口流域进行。该区地处黄龙山东缘,地理位置为35o58′21.3″ N, 110o05′22.0″ E, 海拔800~1 200 m,年平均气温9.8 ℃,多年平均降水量574.4 mm,土壤为灰褐色森林土,地带性植被属落叶阔叶林。试验选取该地植被演替过程中主要优势种, 包括3种乔木:山杨(Populus davidiana)、油松(Pinus tabulaeformis)、辽东栎(Quercus laotungensis), 4种灌木:山桃(Amygdalus davidiana)、荆条(Vitex negundo var. heterophylla)、黄刺玫(Rosa xanthina)、狼牙刺(Sophora viciifolia), 以及外来人工种刺槐(Robinia pseudoacacia)作为研究对象,其中山杨为当地植被演替的早期种,油松为演替的亚顶级种,而辽东栎则为演替的顶级种(邹厚远等,2002)。外来人工种刺槐已在当地及黄土高原其他地区广泛种植,表现出强的抗旱性,其作为参照可反映自然生长的乔灌木的抗旱性。所选4种乔木中,3种落叶乔木山杨、辽东栎及刺槐的树龄均为7~8年,平均树高分别为7.3,6.4,4.5 m,平均胸径分别为6.4,5.3,4.2 cm,而常绿树种油松的树龄为9~10年,其树高平均为6.5 m,胸径平均为5.2 cm。4种灌木主要分布在干旱的生境中,是在撂荒地经十余年演替形成的,年龄为7~9年。其中荆条主要分布在坡下部,平均冠幅为0.9 m,平均高度为1.5 m;而黄刺玫和狼牙刺则分布在坡中部、上部和坡顶,山桃主要分布在坡缘及坡顶,黄刺玫、狼牙刺和山桃的平均冠幅为1.1 m,平均高度为1.8 m左右。
1.2 测定项目及方法2008年在上述8种植物生长旺盛期6和7月采样。在晴天上午11:00左右剪取冠层上部健康生长的、光照条件好的枝条,立即放入盛水的桶中,带回到实验室。在水中剪取27.5 cm长的3年生枝干,然后剪掉所有依靠该枝干供水的叶和残余的分枝,叶用扫描仪进行扫描,然后测定叶面积,完后混合并在75 ℃烘干24 h,粉碎过100目筛后用于叶片δ13C的分析。枝干两端在水中用刀片修整,用于水力学性质的测定。
1.2.1 叶水分利用效率用质谱仪测定的叶片δ13C可间接反映C3植物水分利用效率的大小(Farquhar et al., 1982;1989)。与瞬时WUE(只代表某一特定时间内植物部分叶片的行为,且随时间、生长季节和外界环境条件的变化而改变)相比,长期WUE反映了植物组织在一段时间内的平均WUE,因而比瞬时WUE可更准确估计植物的水分利用特性(陈世苹等,2002)。取处理好的大约3 mg样品封入真空的石英管,并加入氧化铜和银箔,在800~850 ℃下燃烧至少4 h, 燃烧产生的CO2经结晶纯化后,用MAT-251型质谱仪测定叶片的13C/12C比,并以PDB(Pee Dee Belemnite)为标准计算叶片δ13C,分析精度为±0.2‰(Liu et al., 2005)。每个物种叶片δ13C分析重复3次。
依照Farquhar等(1982)的计算长期WUE的公式:
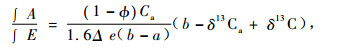
|
其中:A为净光合速率,E为蒸腾速率,ϕ为叶和其他植物组织呼吸造成的固定的碳的损失比例,Δe为细胞间隙与外界大气的水蒸气压差,Ca为大气的CO2浓度,a为CO2通过气孔扩散时引起的碳同位素组分降低,b为羧化作用引起的碳同位素组分的降低,a和b值约为4.4‰和27‰。δ13Ca和δ13C分别为大气和植物叶片的碳同位素组分值。已知ϕ,Δe,Ca,δ13Ca,δ13C,可计算出叶长期WUE。当ϕ、Δe、Ca、δ13Ca一定时,长期WUE和叶片δ13C成正相关关系。由于未知试验地点的Ca,δ13Ca及不同植物的ϕ,Δe,故本文并未直接计算出长期WUE,间接以植物叶片δ13C表示长期WUE大小。
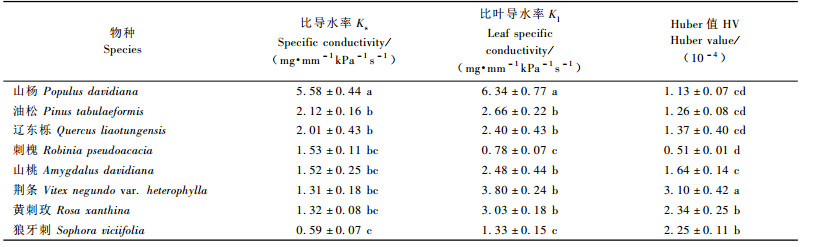
1.2.2 田间小枝比导水率(Ks),比叶导水率(Kl)及Huber值(HV)用重力水头法测定小枝茎干单位压力梯度下的水流通量(Kh, mg mm· s-1kPa-1),所用溶液为除去气泡的20 mmol·L-1 KCl溶液,水头高40~60 cm,环孔材辽东栎和刺槐的水头则降为30 cm左右,以减少正压可能造成的栓塞溶解。按照公式:Kh=F/(dP/dx)计算导水率(kPa·m-1)。其中F为水流通量(mg·s-1), dP/dx为单位枝干长的压力梯度(kPa·mm-1)。比导水率(Ks),比叶导水率(Kl)及Huber值(HV)计算公式如下:
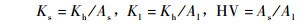
|
As, Al分别为枝干的横截面积及该枝干上承载的所有叶面积(mm2), 枝干茎的横截面积直接用游标卡尺测量直径,然后按圆面积计算。所有Ks,Kl及HV测定均重复5次。
1.2.3 木质部脆弱性曲线木质部脆弱性曲线用离心机法测定(Alder et al., 1997)。先用除去气泡的20 mmol·L-1 KCl溶液在100 kPa下冲洗30 min,以消除在自然状态下形成的栓塞,然后用重力水头法测定最大导水率Kmax。完后放入高速离心机(Sorvall RC-5C, Thermo Fisher Scientific, Waltham, MA, USA)中,在对应-0.5 MPa (或-0.1 MPa)的转速下旋转10 min后取出,用重力水头法测定导水率Ki,依次类推,直到导水率已损失85%以上为止。导水率损失的百分数[PLC=(1-Ki/Kmax)×100]和离心机诱导的木质部负压(P)之间的关系即为木质部脆弱性曲线。
脆弱性曲线的测定重复4次,并用Weibull分布函数:PLC/100 =1-exp[-(-P/b)^c]模拟(Neufeld et al., 1992),其中b为导水率损失63.4%时所对应的木质部水势,c反映了木质部负压等于b时曲线的陡度。通过模拟可求得P50(导水率损失50%时对应的木质部水势),用P50表示木质部抵抗空穴化的能力。
1.2.4 木材密度(Wood density, WD)测定完导水率样品,取两端约3 cm长进行木材密度的测定(Preston et al., 2006)。体积用排水法测定,然后80 ℃下烘干48 h,用万分之一天平称重。木材密度为单位体积的木材干质量(g·cm-3)。重复5次。
1.3 数据处理利用SPSS统计分析软件包(SPSS 11.5 for windows, Chicago, USA)对数据进行统计分析。不同植物叶片δ13C和水力学性质参数Ks, Kl, HV, P50及WD的种间差异用one-way ANOVA进行方差分析,方差分析达到显著后,用LSD法进行多重比较。用独立样品的t检验进行灌木和乔木之间叶片δ13C和水力学性质参数Ks,Kl,HV,P50及WD的比较,Pearson相关分析进行叶片δ13C和水力学性质之间的相关关系分析。
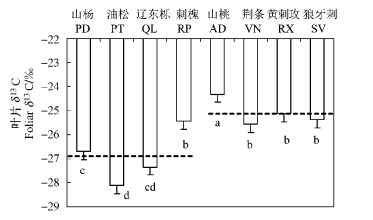
2 结果与分析 2.1 8种乔灌木的叶片δ13C大量研究已证实:叶片δ13C和WUE呈正相关,因而可用δ13C来间接指示WUE的高低(Farquhar et al., 1982;1989)。8种植物叶片δ13C的种间差异达极显著水平(表 1),其中,山桃的叶片δ13C值最大,而油松的δ13C最低, 二者相差3.8‰(图 1)。除山桃外,其他3种灌木δ13C差异不大。4种乔木中,刺槐的δ13C最高,其次为山杨和辽东栎,常绿树种油松的δ13C值最低。4种灌木的叶片δ13C平均值(-25.1‰)显著高于4种乔木(-26.9‰)(P < 0.05),且相互之间差异程度(1.25‰)远小于4种乔木(2.69‰)。
|
|
|
图 1 8种乔灌木的叶δ13C Figure 1 Foliar δ13C of eight trees and shrubs 横坐标上的大写字母为每个树种拉丁文首个字母的缩写,虚线代表 4种灌木和乔木叶片δ13C的平均值, 小写字母表示差异显著(P < 0.05),下同。 Two capital letters corresponding to Latin name of each species and dotted lines indicating the average value of four shrubs and four trees respectively and lowercase letters meaning significance at 0.05 level. The same below. |
Ks, Kl及HV是植物重要的水力学参数。其中,Ks反映了植物茎或枝段的输水效率,Kl则反映了茎或枝段末端叶的供水情况,HV反映了承载单位叶面积水分供给的茎或枝组织的量(Tyree et al., 1991; 李吉跃等,2000)。8种植物的Ks, Kl及HV的种间差异均达到极显著水平(表 1)。从表 2看出:8种乔灌木枝干的Ks以山杨最大(5.58 mg·mm-1kPa-1s-1), 狼牙刺为最小(0.59 mg·mm-1kPa-1s-1),前者为后者的9.46倍,而其他6种植物的比导水率间并无显著差异。4种乔木的平均Ks(2.81 mg·mm-1kPa-1s-1)显著高于4种灌木的平均Ks(1.19 mg·mm-1kPa-1s-1)(P < 0.05),且相互之间差异程度(4.05 mg·mm-1kPa-1s-1)明显高于灌木(0.93 mg·mm-1kPa-1s-1)。
|
|
对Kl而言,8种乔灌木中仍以山杨的为最大(6.34 mg· mm-1kPa-1s-1),而狼牙刺和刺槐的为最小(1.33和0.78 mg·mm-1kPa-1s-1),其他物种的差异不大(表 2)。4种乔木与4种灌木的平均Kl分别为3.05和2.66 mg·mm-1kPa-1s-1,灌木与乔木叶水平的导水率差异不大(P>0.05)。4种乔木的Kl相差5.56 mg·mm-1kPa-1s-1,而4种灌木的Kl相差2.47 mg·mm-1kPa-1s-1,乔木叶比导水率的变异程度也高于灌木。
8种乔灌木HV的种间差异也达到极显著水平(表 1),其中,荆条、黄刺玫和狼牙刺的HV显著高于其他物种, 而以刺槐的为最小(表 2)。4种乔木的平均HV为1.07×10-4,而4种灌木的HV则平均为2.33×10-4,灌木的HV明显高于乔木(P < 0.05),且相互之间差异程度也高于乔木。
线性回归分析表明:Kl与Ks之间呈显著正相关(r=0.830*,P=0.011,n=8),而与HV相关性不显著,表明在本研究中,Kl主要决定于Ks,它可以解释69%的叶比导水率变异。
2.3 8种典型乔灌木木质部对栓塞的脆弱性图 2为8种乔灌木小枝枝干木质部的脆弱性曲线。其中环孔材树种辽东栎与刺槐的导水率在初始压力下下降很快,其后逐渐变慢,而其他6种乔灌木的脆弱性曲线接近S形。利用Weibull分布函数模拟(Neufeld et al., 1992),求出8种乔灌木的P50,可知不同物种对栓塞的脆弱性相差很大,其种间差异达到极显著水平(表 1)。环孔材树种刺槐与辽东栎对栓塞的抵抗能力最弱,其P50分别为-0.90和-1.13 MPa,其次为山杨(-1.96 MPa)、荆条(-2.16 MPa)及山桃(-2.57 MPa),而黄刺玫、狼牙刺和油松抵抗空穴化的能力最强,其P50分别达-3.57, -3.80和-4.14 MPa。
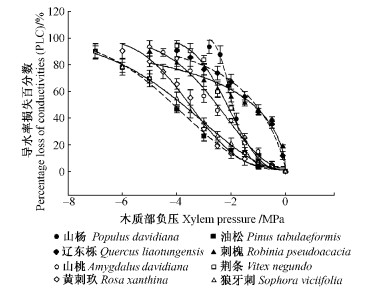
|
图 2 8种典型乔灌木的脆弱性曲线 Figure 2 The vulnerability curves of eight dominant trees and shrubs 图中曲线为用Weibull分布函数模拟的结果。 The lines are Weibull function curve fits. |
木本植物抵抗空穴化的能力与木材密度有密切关系(Hacke et al., 2001; Jacobsen et al., 2005)。测定8种植物小枝枝干的木材密度(图 3),发现其种间差异也达到极显著水平(表 1)。8种植物的木材密度介于0.3~0.7 g·cm-3之间,其中以狼牙刺的木材密度最大,为0.70 g·cm-3, 山杨和油松木材密度最小,分别为0.43和0.44 g·cm-3,演替顶级种辽东栎的木材密度明显高于其他乔木树种。4种灌木的平均木材密度(0.65 g·cm-3)显著高于4种乔木的平均木材密度(0.49 g·cm-3)(P < 0.05)。

|
图 3 8种乔灌木小枝枝干的木材密度 Figure 3 Twig wood density of eight trees and shrubs |
P50和木材密度之间的回归分析表明:二者无显著线性相关关系。但若剔除针叶树种油松进行回归后,P50与木材密度之间的负相关关系接近显著(r=-0.704, P=0.083, n=7),表明在所研究的7种被子植物上,木材密度越大,P50越小,抵抗空穴化的能力愈强。
2.4 叶片δ13C和水力学特性之间的关系8种乔灌木的叶片δ13C和木材密度呈一定程度正相关关系(P=0.087),但若去除针叶树种油松后,二者之间并无相关关系的存在(表 3)。叶片δ13C和Ks,Kl, HV值和P50之间均无显著相关关系(表 3)。
|
|
采用稳定性碳同位素技术间接估算C3植物的水分利用效率具有明确的理论基础(Farquhar et al., 1982;1989),因而在植物生理生态学领域得到普遍应用。本研究的8种乔灌木叶片δ13C界于-24.3‰~-28.1‰,平均值为-26‰,与Zheng等(2007)在整个黄土高原测定的乔木平均值(-26.74‰)和灌木平均值(-26.68‰)接近。本研究结果表明:演替的4种灌木群落优势种WUE明显高于4种乔木群落优势种,且其相互之间差异程度小于4种乔木,表现出一定的趋同性(Convergence)。在乔木群落演替过程中,演替早期种山杨的WUE明显高于演替后期种油松和演替顶级种辽东栎,表明演替早期种具有更高的WUE。这与Nogueira等(2004)、Guehl等(1998)、Bonal等(2000)的研究结果一致,但与Huc等(1994)的研究结果则相反。高WUE值是1种重要的抗旱性机制,有助于早期种在恶劣的环境中保持一定的竞争优势。不同地区植被演替过程中WUE变化的趋势不一致可能与植物种类及其环境条件有关。在黄土高原,导致不同植物WUE差异的原因可能主要与其不同的水分利用方式有关,乔木主要利用深层土壤水及/或地下水,而灌木则利用浅层土壤水和深层土壤水及/或地下水的混合水,当夏季降雨量小时,乔木具有比灌木更可靠的水源。此外,不同演替阶段树种光合速率及气孔对干旱的敏感性可能也是造成其WUE差异的原因,演替早期种光合速率一般高于演替后期种,且气孔对干旱的敏感性也高(Huc et al., 1994),从而造成演替早期种具有高的WUE。本研究还表明:刺槐的WUE与几种灌木接近,而显著高于其他3种乔木。刺槐高的WUE可能是其具有高的抗旱性,从而在黄土高原普遍种植的原因之一。
3.2 黄土丘陵区植被演替过程中水力学特性的变化4种灌木的比导水率Ks低于4种乔木的比导水率,但叶面积基础上的比叶导水率Kl则差异不大。灌木通过高的HV来补偿其水分传输能力的不足。在4种乔木中,演替早期种山杨比演替后期种辽东栎具有高的导水率。高的导水率与高的碳同化能力、高的生长速率相对应(Tyree et al., 1998),山杨高的生长速率需要高的水分传输能力来支持。相比之下,人工树种刺槐的比叶导水率远低于其他物种,表明其属于低耗水和保守性水分利用树种。
演替早期种相比于演替后期种,更容易发生栓塞(Tyree et al., 1988;1991)。在本研究中的4种乔木中,外来树种刺槐及演替后期种辽东栎抵抗空穴化的能力最弱,其次为演替早期种山杨, 演替的亚顶级树种油松抵抗空穴化的能力最强。不同乔木树种抵抗空穴化的能力主要与其木质部结构有关,刺槐与辽东栎属环孔材,因而对栓塞最敏感;山杨为散孔材,其抵抗空穴化的能力相对强于环孔材,而针叶树种油松抵抗空穴化的能力最强。因此,乔木抵抗空穴化能力与其演替阶段并无必然联系。4种灌木抵抗空穴化的能力明显强于除油松外的3种乔木,与其相对强的抗旱性一致。尽管4种灌木均属环孔材,但其木质部结构特征已发生明显的变化,表现出导管密度增大,或/及导管直径明显减小的特点,因而其脆弱性曲线发生明显变化。
在被子植物中,木材密度反映了木质部、木纤维的基质及包围它们的细胞的性质。一般研究认为:木本植物抵抗空穴化的能力与其木材密度呈正相关关系(Hacke et al., 2001; Jacobsen et al., 2005)。本研究在7种被子植物上也证实了这点。但Cochard等(2008)在研究樱桃不同种的栓塞脆弱性时发现,P50和木材密度之间并无相关关系,认为其原因与不同种之间的木材密度差异极小有关,此研究结果是否也适于其他属的不同种有待于进一步研究。此外,本研究还发现:木材密度与比导水率之间呈负指数关系, 而与HV值之间呈正相关关系(图 4)。Bucci等(2004)在热带稀树草原上不同树木上的研究也得到了相似的结论。Preston等(2006)研究了美国加州51个树种木材密度与木质部结构特征之间的关系,发现不同树种的木材密度和平均导管腔面积呈显著负相关关系,按照Hagen-Poisseuille公式,导水率与导管腔半径的4次方成正比,因此木材密度和导水率呈负相关关系。高木材密度使碳更多分配到茎中,从而制约了叶片的碳分配,造成更高的HV。比导水率Ks和HV与木材密度间的数量关系在一定程度上反映了木材密度对叶片生理功能的调节与制约。
3.3 黄土丘陵区植被演替过程中叶WUE和水力学特性的关系本研究表明:叶片δ13C和枝干的水力学特征Ks、Kl、HV值和P50在8种乔灌木上并无显著相关性,在7种被子植物上与木材密度也无显著相关关系,表明植物叶片WUE和水力学特性之间并无必然的联系。Maherali等(2006)的研究也得到了相同的结论。但Sobrado(2003)却发现:热带山区生境中生长的先锋种和演替后期种,通过叶δ13C计算的长期WUE和通过光合气体交换参数测定的瞬时WUE与水分传输能力之间存在明显的负相关性。叶片δ13C反映的是从叶生长直至采样时的长期水分利用状况,而Ks与Kl则反映导管在某个特定时刻的水分传输特征,P50, WD和HV则反映了树木枝干整个生长阶段的生理状况及累积环境因子的影响,这些不同时间尺度的生理指标间的联系可能是极微弱的。此外,落叶树种还可能通过其他机制,如干旱期落叶、根系深入土壤含水层、较高的树干储水能力、灵敏的气孔开闭调节等适应环境,从而影响叶WUE。不同演替阶段植物,如何通过其他生理过程的变化来影响叶片WUE,仍有待于进一步研究。
陈世苹, 白永飞, 韩兴国. 2002. 稳定性碳同位素技术在生态学研究中的应用[J]. 植物生态学报, 26(5): 549-560. |
李吉跃, 翟洪波. 2000. 木本植物的水力结构与抗旱性[J]. 应用生态学报, 11(2): 301-305. |
邹厚远, 刘国彬, 王晗生. 2002. 子午岭林区北部近50年植被的变化发展[J]. 西北植物学报, 22(1): 1-8. |
Alder N N, Pockman W T, Sperry J S, et al. 1997. Use of centrifugal force in the study of xylem cavitation[J]. Journal of Experimental Botany, 48(308): 665-674. |
Becker P, Tyree M T, Tsuda M. 1999. Hydraulic conductance of angiosperms versus conifers: similar transport sufficiency at the whole-plant level[J]. Tree Physiology, 19: 445-452. DOI:10.1093/treephys/19.7.445 |
Bonal D, Barigah T S, Granier A, et al. 2000. Late-stage canopy tree species with extremely low δ13C and high stomatal sensitivity to seasonal soil drought in the tropical rainforest of French Guiana[J]. Plant, Cell and Environment, 23: 445-459. DOI:10.1046/j.1365-3040.2000.00556.x |
Bucci S J, Goldstein G, Meinzer F C, et al. 2004. Functional convergence in hydraulic architecture and water relations of tropical savanna trees: from leaf to whole plant[J]. Tree Physiology, 24: 891-899. DOI:10.1093/treephys/24.8.891 |
Cochard H, Barigah S T, Kleinhentz M, et al. 2008. Is xylem cavitation resistance a relevant criterion for screening drought resistance among Prunus species?[J]. Journal of Plant Physiology, 165(9): 976-982. DOI:10.1016/j.jplph.2007.07.020 |
Farquhar G D, Ehleringer J R, Hubick K T. 1989. Carbon isotope discrimination and photosynthesis[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 40: 503-537. DOI:10.1146/annurev.pp.40.060189.002443 |
Farquhar G D, Leary M H, Berry J A. 1982. On the relationship between carbon isotope discrimination and intercellular carbon dioxide concentration in leaves[J]. Australian Journal of Plant Physiology, 9: 121-137. DOI:10.1071/PP9820121 |
Guehl J M, Domenach A M, Bereau M, et al. 1998. Functional diversity in an Amazonian rainforest of French Guyana. A dual isotope approach (δ15N and δ13C)[J]. Oecologia, 116: 316-330. DOI:10.1007/s004420050593 |
Hacke U W, Sperry J S, Pockman W T, et al. 2001. Trends in wood density and structure are linked to prevention of xylem implosion by negative pressure[J]. Oecologia, 126: 457-461. DOI:10.1007/s004420100628 |
Huc R, Ferhi A, Guehl J M. 1994. Pioneer and late stage tropical rainforest tree species (French Guiana) growing under common conditions differ in leaf gas exchange regulation, carbon isotope discrimination and leaf water potential[J]. Oecologia, 99: 297-305. DOI:10.1007/BF00627742 |
Hubbard R M, Stiller V, Ryan M G, et al. 2001. Stomatal conductance and photosynthesis vary linearly with plant hydraulic conductance in ponderosa pine[J]. Plant Cell and Environment, 24: 113-121. DOI:10.1046/j.1365-3040.2001.00660.x |
Jacobsen A L, Ewers F W, Pratt R B, et al. 2005. Do xylem fibers affect vessel cavitation resistance?[J]. Plant Physiology, 149: 546-556. |
Liu W G, Feng X H, Nine Y F, et al. 2005. δ13C variation of C3 and C4 plants across an Asian monsoon rainfall gradient in arid northwestern China[J]. Global Change Biology, 11: 1094-1100. DOI:10.1111/gcb.2005.11.issue-7 |
Maherali H, Moura C F, Caldeira M C, et al. 2006. Functional coordination between leaf gas exchange and vulnerability to xylem cavitation in temperate forest trees[J]. Plant, Cell and Environment, 29: 571-583. DOI:10.1111/pce.2006.29.issue-4 |
Neufeld H S, Grantz D A, Meinzer F C, et al. 1992. Genotypic variability in vulnerability of leaf xylem to cavitation in water-stressed and well-irrigated sugarcane[J]. Plant Physiology, 100: 1020-1028. DOI:10.1104/pp.100.2.1020 |
Nogueira A, Martinez C A, Ferreira L L, et al. 2004. Photosynthesis and water use efficiency in twenty tropical tree species of differing succession status in a Brazilian reforestation[J]. Photosynthetica, 42(3): 351-356. DOI:10.1023/B:PHOT.0000046152.05364.77 |
Preston K A, Cornwell W K, DeNoyer J L. 2006. Wood density and vessel traits as distinct correlates of ecological strategy in 51 California coast range angiosperms[J]. New Phytologist, 170: 807-818. DOI:10.1111/nph.2006.170.issue-4 |
Sobrado M A. 2003. Hydraulic characteristics and leaf water use efficiency in trees from tropical montane habitats[J]. Trees, 17: 400-406. DOI:10.1007/s00468-003-0251-5 |
Tyree M T, Ewers F W. 1991. The hydraulic architecture of trees and other woody plants[J]. New Phytologist, 119: 345-360. DOI:10.1111/nph.1991.119.issue-3 |
Tyree M T, Snyderman D A, Wilmot T R, et al. 1991. Water relations and hydraulic architecture of a tropical tree (Schefflera morototoni): data, models and a comparison to two temperate species (Acer saccharum and Thuja occidentalis)[J]. Plant Physiology, 96: 1105-1113. DOI:10.1104/pp.96.4.1105 |
Tyree M T, Sperry J S. 1988. Do woody plants operate near the point of catastrophic xylem dysfunction caused by dynamic water stress: answers from a model[J]. Plant Physiology, 88: 574-580. DOI:10.1104/pp.88.3.574 |
Tyree M T, Velez V, Dalling J L. 1998. Growth dynamics of root and shoot hydraulic conductance in seedlings of five neotropical tree species: scaling to show possible adaptation to differing light regimes[J]. Oecologia, 114: 293-298. DOI:10.1007/s004420050450 |
Zheng S X, Shangguan Z P. 2007. Spatial patterns of foliar stable carbon isotope compositions of C3 plant species in the Loess Plateau of China[J]. Ecological Research, 22: 342-353. DOI:10.1007/s11284-006-0024-x |
 2010, Vol. 46
2010, Vol. 46