文章信息
- 池玉杰, 闫洪波
- Chi Yujie, Yan Hongbo
- 红平菇木质素降解酶系统漆酶、锰过氧化物酶及木质素过氧化物酶的检测
- Detection on Laccase, Manganese Peroxidase and Lignin Peroxidase in Ligninolytic Enzymes of Pleurotus djamor
- 林业科学, 2009, 45(12): 154-158.
- Scientia Silvae Sinicae, 2009, 45(12): 154-158.
-
文章历史
- 收稿日期:2009-05-29
-
作者相关文章
木材白腐菌在分解木质素的过程中会产生非特异性的分解木质素结构的酶系统,这些酶系统主要包括细胞外过氧化物酶[锰过氧化物酶(manganese peroxidase, MnP)、木质素过氧化物酶(lignin peroxidase, LiP)]和细胞外酚氧化酶[漆酶(laccase)]。因此,在生物修复方面,白腐菌能够有效地降解废水和土壤中难被降解的多氯联苯、多环芳烃、DDT、染料、炸药和其他氯化物、叠氮化合物等。一些白腐菌产生所有上述这3种分解木质素的酶,而大多数白腐菌仅产生2种甚至1种分解木质素的酶,表明这3种酶在分解木质素的过程中并不是全都必需的。大多数白腐菌产生MnP和laccase,目前已知只有少数几种白腐菌能够产生LiP。因此,MnP和laccase是降解木质素的主要酶系(Hofrichter, 2002;Hatakka, 1994)。MnP(EC1.11.1.13)是一种依赖H2O2的亚铁血红素糖蛋白酶,仅广泛存在于木材白腐菌和各种栖息土壤的枯落层降解担子菌中,细菌、酵母菌、霉菌和菌根菌都不产生MnP。laccase(EC1.10.3.2)是一种含铜的糖蛋白氧化还原酶,在植物、真菌、昆虫和细菌中都检测到了该酶的存在,其中在白腐真菌和植物中最为普遍。LiP(EC1.11.1.14)与MnP一样也是一种含亚铁血红素的过氧化物酶。
国外对于白腐菌降解木质素酶系统的研究主要集中金孢展齿革菌(Phanerochaete chrysosporium)、虫拟蜡菌(Ceriporiopsis subvermispora)、糙皮侧耳(Pleurotus ostreatus)、云芝栓菌(Trametes versicolor)等菌种,包括产酶条件的优化、基因的克隆及表达、酶的纯化与蛋白结构分析等(Alic et al., 1997;Giardina et al., 2000;Irie et al., 2000;Tello et al., 2000;Johansson et al., 2002;Yaver et al., 2003);我国也进行了几种白腐菌MnP和laccase的活性测定及产酶条件优化研究(周金燕等,1993;浦跃武等,1998;桑希斌等,2002;张连慧等,2005),对不同白腐真菌的MnP和laccase进行了纯化及酶学性质研究(谢慧芳等,2003;苏东海等,2008;王岁楼等,2008)。白腐真菌laccase基因的克隆、表达研究较为深入,目前已有粗糙脉孢菌(Neurospora crassa)、金针菇(Flammulina velutipes)等几种白腐菌的漆酶基因得到了克隆(张银波等,2004;谌斌等,2006),而多种其他白腐菌的MnP酶学和分子生物学研究则相对较少。在真菌酶活性的检测中,不同的真菌种和同种真菌不同菌株之间存在着酶活性的差异;对于同一真菌菌株,培养基的成分、不同的培养条件也会影响到酶的产生和活性的大小。红平菇(Pleurotus djamor)既是一种白腐菌,又是一种色、香、味俱佳的食用菌,对其酶学和分子生物学研究鲜见报道。本文对红平菇菌株H1在以低氮天冬酰胺-琥珀酸培养基(LNAS,low nitrogen asparagine succinic acid)为基础培养基并分别添加4种不同的酶作用底物条件下,对MnP,laccase和LiP的活性进行了检测,目的是搞清红平菇木质素降解酶系统的主要酶系及其与培养基成分和酶作用底物等条件的关系,为进一步利用该菌株产木质素降解酶,深入研究红平菇分解木质素的酶系统的作用机制与木质素降解机制的关系,以及基因表达调控等分子生物学机制提供基础的酶学研究。
1 材料与方法 1.1 菌种来源红平菇菌株H1由东北林业大学林学院森林保护学科森林病虫病理实验室提供,试验前在马铃薯葡萄糖琼脂培养基(PDA,potato dextrose agar)斜面上的菌种冷藏于4 ℃冰箱。
1.2 培养基综合培养基:PDA培养基。产酶基础培养基:低氮天冬酰胺-琥珀酸培养基(Kirk et al., 1978;Hatakka et al., 1983)。
1.3 培养方式在250 mL三角瓶中加入70 mL LNAS培养基,分别添加4种不同底物进行菌种培养:A.LNAS培养基不含Mn2+,即矿物元素溶液中不添加MnSO4·H2O;B.LNAS培养基含Mn2+(2.67 μmol·L-1),即矿物元素溶液中添加MnSO4·H2O;C.LNAS培养基含Mn2+(2.67 μmol·L-1),并加入2 g青杨(Populus ussuriensis)木屑为产酶底物;D. LNAS培养基含Mn2+(2.67 μmol·L-1),并加入10 mmol·L-1 2, 6-二甲氧基苯酚(2, 6-DMP) 0.1 mL为产酶底物。
所有的培养液高压灭菌15 min,接菌前向每个灭菌的三角瓶中加入5 mL除菌的15%葡萄糖溶液。保藏菌种先接种至PDA平板培养基(9 cm)上,28 ℃培养10天,8 mm打孔器于培养皿菌丝边缘打孔,将菌饼转接至灭菌后的三角瓶中,每个三角瓶加入5块菌饼,28 ℃静止培养,每项试验设3个重复。培养至3,5,7,9,11,13,15,17和21天提取培养液即胞外酶液,每个三角瓶中每次提取酶液1.3 mL,将提取的粗酶液离心(13 200 r·min-1,室温)5 min,进行酶活测定后冷藏于-20 ℃冰箱。
1.4 酶活测定方法MnP的活性通过紫外可见分光光度计(Ultrospec 4300pro,Amersham)在470 nm处检测2, 6-DMP的氧化进行测定(Wariishi et al., 1992)。测定体系1 mL,其中丙二酸钠缓冲液(50 mmol·L-1)840 μL,MnSO4(10 mmol·L-1)50 μL,2, 6DMP(10 mmol·L-1)50 μL,酶液样品50 μL,H2O2 (10 mmol·L-1)10 μL,以1 mL去离子水作为对照,测定470 nm处吸光度在1 min内的变化值,反应起始于10 mmol·L-1 H2O2的加入。laccase的活性通过紫外分光光度计在420 nm处检测2,2′-连氮-双(3-乙基苯并噻唑-6-磺酸)(ABTS)的氧化进行测定(Eggert et al., 1996)。测定体系1 mL,其中丙二酸钠缓冲液(50 mmol·L-1)850 μL,酶液样品100 μL,ABTS(20 mmol·L-1)50 μL,以1 mL去离子水作为对照,测定420 nm处吸光度在3 min内的变化值。Lip采用以藜芦醇(VA)为底物的测定方法(Tien et al., 1988)。测定体系1 mL,其中丙二酸钠缓冲液(100 mmol·L-1,pH3.0) 340 μL,藜芦醇(20 mmol·L-1)100 μL,酶液样品550 μL,H2O2(54 mmol·L-1)10 μL,以1 mL去离子水作为对照,测定310 nm处吸光度在3 min内的变化值。酶活单位(U):上述条件下,每分钟催化1 μmol 2, 6-DMP, ABTS或VA所需的酶量。计算中的ε470=49 600(mol·L-1cm)-1,ε420=36 000 (mol·L-1cm)-1,ε310=9 300 000 (mol·L-1cm)-1。
2 结果与分析 2.1 红平菇4种培养液中LiP的酶活测定在4种不同的培养液中分别对LiP的酶活进行检测,但在310 nm处均未检测到吸光值的变化,表明红平菇不产生LiP。
2.2 红平菇培养液A酶活测定结果红平菇在不含Mn2+的LNAS培养基中不加底物条件下培养21天过程中,提取的酶液未检测到MnP的活性,但是可以检测到laccase的活性,laccase 9天达到最大分泌量,酶活力为38 U·L-1(图 1)。
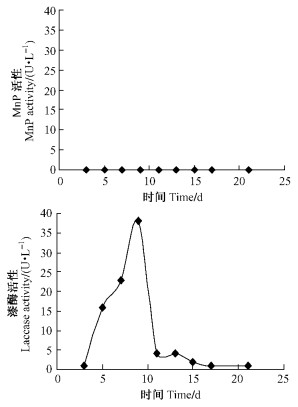
|
图 1 培养液A MnP和laccase酶活随时间变化 Figure 1 MnP and laccase activity of culture method A |
红平菇在含Mn2+的LNAS培养基中不加底物条件下培养21天过程中,提取的酶液检测到MnP的活性变化,但活性很低,15天达到分泌高峰,最大酶活力仅为5 U·L-1;laccase在9天时达最大分泌量,酶活力达36 U·L-1(图 2)。A,B 2种培养液的检测结果表明:Mn2+是红平菇产生MnP的必要因子,在诱导红平菇产生MnP的过程中起着关键作用,而漆酶的产生则不受该条件的制约。对比A,B 2种培养液漆酶的活性基本相同。
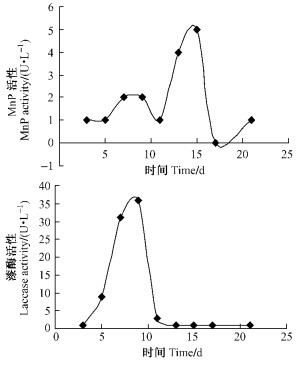
|
图 2 培养液B MnP和laccase酶活随时间的变化 Figure 2 MnP and laccase activity of culture method B |
红平菇在含Mn2+的LNAS培养基中加入木屑为底物条件下培养21天过程中,提取的酶液检测到MnP的活性变化,MnP在13天达到最大分泌量,酶活力为69 U·L-1;laccase9天达到最大分泌量,酶活力为205 U·L-1(图 3)。表明红平菇液体培养过程中添加木屑为底物可以显著提高MnP和laccase的产生量,同时还可缩短MnP达到最大分泌量的时间,说明底物对于白腐菌木质素降解酶系统产生的诱导作用。
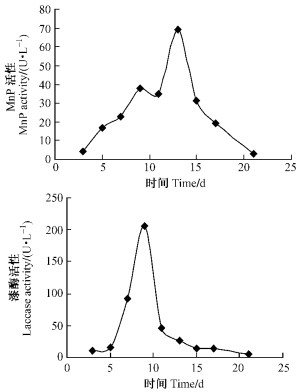
|
图 3 培养液C MnP和laccase酶活随时间的变化 Figure 3 MnP and laccase activity of culture method C |
红平菇在含Mn2+的LNAS培养基中加入2, 6-DMP为底物条件下培养21天过程中,提取的酶液检测到MnP的活性变化,MnP在11天达到最大分泌量,酶活力为46 U·L-1;laccase在9天达最大分泌量,酶活力为199 U·L-1(图 4)。表明红平菇液体培养过程中添加2, 6-DMP为底物也可以显著提高MnP和laccase的产生量,同时缩短了MnP达到最大分泌量的时间。对比C,D 2种培养液过程中酶的产生结果发现,以木屑为底物MnP和laccase的产量要稍高于以2, 6-DMP为底物MnP和laccase的产量。
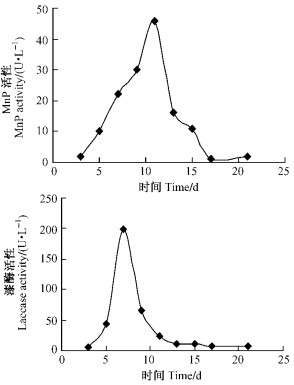
|
图 4 培养液D MnP和laccase酶活随时间的变化 Figure 4 MnP and laccase activity of culture method D |
在4种不同的培养液中,红平菇的MnP和laccase活性变化是有规律的。laccase的变化曲线更一致,都是在3天之后产生,以后较迅速地升高,在第9天达到最高,以后又迅速下降,11天之后就变得很低,13~15天后接近为零;MnP也是在3天之后产生,只是活性很低,以后逐渐升高,在第11~13~15天后达到最高,以后又逐渐下降,17或21天时接近为零,这与作者以前的研究结果相似(Chi et al., 2007)。红平菇MnP的产生需要有Mn2+的参与,laccase在有无Mn2+的条件下均可产生,最大分泌量也不受该因素的影响。培养过程中添加酶的底物木屑和2,6-DMP可较大程度地提高MnP和laccase的产量,laccase产量提高4倍,MnP的产酶量则提高了10倍多;底物不同对于培养过程中酶的产生影响也不同,添加木屑为底物要比添加2, 6-DMP为底物的MnP和laccase的产量要高,并且二者间的差别在MnP的分泌量上表现得更为显著(图 5)。
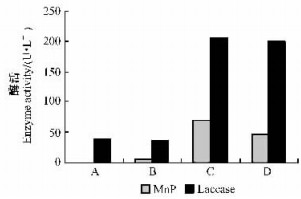
|
图 5 4种培养液中MnP和laccase酶活比较 Figure 5 Comparision of MnP and laccase activity among four culture method |
本文采用LNAS培养基在4种不同培养液中对白腐菌红平菇木质素降解酶系统的主要酶系MnP,laccase和LiP的活性进行检测。结果表明,红平菇可同时产生MnP和laccase,但不产生LiP,2种酶的活性变化是有规律的,laccase总是在第9天时达到最高。
通过2种酶活性的检测,也获得了酶与培养基的成分和酶作用底物等条件的关系。对比4种培养液的酶活力测定结果,发现Mn2+是产生MnP的必要因子,Mn2+在诱导菌株产生MnP的过程中起着关键作用,而漆酶的产生则不受该条件制约,这与前人对其他白腐菌的研究结果相同。而二价锰离子Mn2+在木材和土壤的环境中是一直存在的,MnP以Mn2+作为首选还原底物,即电子供体,使其变成高度活性的三价锰离子Mn3+,螯合的Mn3+作为低分子质量的物质,成为氧化还原中介体,是可渗透和扩散到木材细胞内木质素结构中的氧化剂,可在远离酶的一定位置上发挥作用,经由氢原子和一个电子的提取,非特异性地氧化木质素大分子中的酚结构(池玉杰等,2007)。
在培养液内添加酶作用的底物木屑和2,6-DMP后,可以较大程度地提高MnP和laccase的分泌量,表明底物对于白腐菌木质素降解酶系统产生的诱导作用。底物不同对于培养过程中酶的产生影响也不同,添加木屑为底物要比添加2, 6-DMP为底物的MnP和laccase的产量稍高。在添加2, 6-DMP的培养过程中可以观察到培养基的颜色变为浅褐色,且菌丝的生长速度及生长量均比底物为木屑培养方式稍差,原因可能是2, 6-DMP本身对白腐菌的生长具有一定的抑制作用,从而阻碍了酶的分泌。
本文对MnP和laccase酶活检测,选择了限制营养型基础培养基低氮天冬酰胺-琥珀酸培养基,以便可以更加灵敏地检测分泌量较少的MnP,因此酶活相对于选择富营养型培养基较低,同时最大产酶时间稍有延后。本项试验尚未进行培养条件的优化,推测是导致酶活相对较低的一个原因,因此如需要提高酶活力、缩短产酶时间,还需进一步选择富营养型培养基并对产酶条件进行优化。
谌斌, 唐雪明, 沈微. 2006. 粗糙脉孢菌漆酶基因的克隆及在毕赤酵母中的初步表达[J]. 食品与生物技术学报, 25(4): 43-54. DOI:10.3321/j.issn:1673-1689.2006.04.009 |
池玉杰, 伊洪伟. 2007. 木材白腐菌分解木质素的酶系统-锰过氧化物酶、漆酶和木质素过氧化物酶催化分解木质素的机制[J]. 菌物学报, 26(1): 153-160. |
浦跃武, 甄浩铭, 冯书庭, 等. 1998. 白腐菌产锰过氧化物酶条件的研究[J]. 菌物系统, 17(3): 251-255. |
桑希斌, 王宜磊. 2002. 采绒革盖菌锰过氧化物酶的诱导及部分特性研究[J]. 山东师范大学学报:自然科学版, 17(2): 76-78. |
苏东海, 苏东民, 杨国伟, 等. 2008. 白腐菌TP21漆酶分离纯化及其部分酶学特性的研究[J]. 河南工业大学学报:自然科学版, 29(5): 54-57. |
王岁楼, 王琼波. 2008. 灵芝突变株G1502漆酶的分离纯化及酶学性质研究[J]. 食品科学, 29(5): 287-291. DOI:10.3321/j.issn:1002-6630.2008.05.059 |
谢慧芳, 近藤隆一郎, 李忠正. 2003. 白腐菌Phanerochaete sordida YK-624产锰过氧化物酶的生产及初步纯化[J]. 林产化学与工业, 23(4): 22-26. DOI:10.3321/j.issn:0253-2417.2003.04.005 |
张连慧, 刘卫晓, 葛克山, 等. 2005. 变色栓菌产锰过氧化物酶的条件优化[J]. 微生物学通报, 32(5): 98-102. DOI:10.3969/j.issn.0253-2654.2005.05.020 |
张银波, 姜琼, 江木兰, 等. 2004. 金针菇漆酶基因的克隆及其在毕赤酵母中的表达研究[J]. 微生物学报, 44(6): 775-779. DOI:10.3321/j.issn:0001-6209.2004.06.016 |
周金燕, 张发群, 桑原正章. 1993. 真菌产生的锰过氧化物酶和漆酶的研究Ⅰ.富氮培养基筛选产酶的真菌[J]. 微生物学报, 33(5): 387-391. |
Alic M, Akileswaran L, Gold M H. 1997. Characterization of the gene encoding manganese peroxidase isozyme 3 from Phanerochaete chrysosporium[J]. Biochimica et Biophysica Acta, 1338: 1-7. DOI:10.1016/S0167-4838(96)00235-X |
Chi Y J, Hatakka A, Maijala P. 2007. Can co-culturing of two white-rot fungi increase lignin degradation and the production of lignin-degrading enzymes[J]. International Biodeterioration and Biodegradation, 59(1): 32-39. DOI:10.1016/j.ibiod.2006.06.025 |
Eggert C, Temp U, Eriksson K E. 1996. The ligninolytic system of the white-rot fungus Pycnoporus cinnabarinus: purification and characterization of the laccase[J]. Applied and Environmental Microbiology, 62: 1151-1158. |
Giardina P, Palmieri G, Fontanella B, et al. 2000. Manganese peroxidase isoenzymes produced by Pleurotus ostreatus grown on wood sawdust[J]. Archives of Biochemistry and Biophysics, 376(1): 171-179. DOI:10.1006/abbi.1999.1691 |
Hatakka A. 1994. Lignin-modifying enzymes from selected white-rot fungi: production and role in lignin degradation[J]. FEMS Microbiology Reviews, 13: 125-135. DOI:10.1111/fmr.1994.13.issue-2-3 |
Hatakka A, Uusi-Rauva A K. 1983. Degradation of 14C-labelled poplar wood lignin by selected white-rot fungi[J]. European Journal of Applied Microbiololy and Biotechnology, 17: 235-242. DOI:10.1007/BF00510422 |
Hofrichter M. 2002. Review: lignin conversion by manganese peroxidase (MnP)[J]. Enzyme and Microbial Technology, 30: 454-466. DOI:10.1016/S0141-0229(01)00528-2 |
Irie T, Honda Y, Ha H C, et al. 2000. Isolation of cDNA and genomic fragment s encoding the major manganese peroxidase isozyme from the white rot basidiomycete Pleurotus ostreatus[J]. J Wood Sci, 46: 230-233. DOI:10.1007/BF00776454 |
Johansson T, Nyman P O, Cullen D. 2002. Differential regulation of Mnp2, a new manganese peroxidase-encoding gene from the ligninolytic fungus Trametes versicolor PRL 572[J]. Applied and Environmental Microbiology, 68(4): 2077-2080. DOI:10.1128/AEM.68.4.2077-2080.2002 |
Kirk T K, Schultz E, Connors W J, et al. 1978. Influence of culture parameters on lignin melabolism by Phanerochaete chrysosporium[J]. Arch Microbial, 117: 277-285. DOI:10.1007/BF00738547 |
Tello M, Corsini G, Larrondo L F, et al. 2000. Characterization of three new manganese peroxidase genes from the ligninolytic basidiomycete Ceriporiopsis subvermispora[J]. Biochimica et Biophysica Acta, 1490: 137-144. DOI:10.1016/S0167-4781(99)00227-4 |
Tien M, Kirk T K. 1988. Lignin peroxidase of Phanerochaete chrysosporium[J]. Methods in Enzymology, 161: 238-249. DOI:10.1016/0076-6879(88)61025-1 |
Wariishi H, Valli K, Gold M H. 1992. Manganese Ⅱ oxidation by manganese peroxidase from the basidiomycete Phanerochaete chrysosporium-kinetic mechanism and role of chelators[J]. Journal of Biological Chemistry, 267(33): 23688-23695. |
Yaver D S, Weber B, Murrell J. 2003. Global expression profiling of the lignin degrading fungus ceriporiopsis subvermispora for the discovery of novel enzymes//Arora D K, Khachatourians G G. Applied Mycology and Biotechnology (Vol.3) Fungal Genomics. Elsevier Science B V, Amsterdam, 3: 261-269.
|
 2009, Vol. 45
2009, Vol. 45
