文章信息
- 高相彬, 胡艳丽, 赵凤霞, 毛志泉, 沈向, 杨树泉, 苏立涛
- Gao Xiangbin, Hu Yanli, Zhao Fengxia, Mao Zhiquan, Shen Xiang, Yang Shuquan, Su Litao
- 外源苯甲酸对平邑甜茶幼苗根系膜脂过氧化的影响
- Effects of Benzoic Acid Application on Membrance Lipid Peroxidation in Roots of Malus hupehensis Seedlings
- 林业科学, 2009, 45(12): 129-134.
- Scientia Silvae Sinicae, 2009, 45(12): 129-134.
-
文章历史
- 收稿日期:2009-02-25
-
作者相关文章
大多数果树都存在连作障碍(重茬、再植病、忌地现象)现象,其中苹果(Malus)、李(Prunus salicina)、桃(Prunus)等连作障碍更为严重。杨兴洪等(1991)调查苹果重茬地成活率只有40%~60%,美国华盛顿州10年间苹果产区因重茬每公顷损失4万美元,山东省烟台大量苹果园已经表现并将面临更大面积的苹果连作问题。连作障碍原因较为复杂,是植物有机体与土壤内含物诸多因素综合作用的外观表现,其中,连作过程中由上茬植物体分泌和上茬植物残体腐解产生的酚酸类物质积累是引起连作障碍的原因之一(孔垂华等,2002),而苯甲酸是酚酸类物质的主要类型,探讨苯甲酸对苹果根系的作用具有实践意义。
根系分泌物作为植物在生长发育过程中通过根部向栽培介质释放的1组种类繁多的物质,多数能够影响土壤微生物组成(Akiyama et al., 2005;Blum et al., 1988;)和作物的生理过程(Santos et al., 2004;Baziramakenga et al., 1995)。张淑香等(2000)研究认为酚酸类物质是根系分泌物中的主要毒性物质,并且是造成连作障碍的重要因素(吴凤芝等,2003),如酚酸物质对植物生长具有抑制作用(郁继华等,2006;Tang et al., 1982),其中对羟基苯甲酸、香草酸可明显抑制春小麦(Triticum)胚根和胚芽伸长(Perez et al., 1997),苯甲酸、香豆酸影响黄瓜(Cucumis)和大豆(Glycine)幼苗的生长(Yu et al., 2003)。尽管研究人员在酚酸类物质对植物影响方面做了大量工作,但有关酚酸类物质对木本植物根系作用机理的研究鲜有报道。本试验以生产上常用苹果砧木(Malus pumila)—平邑甜茶(Malus hupehensis)为材料,探讨不同浓度苯甲酸对平邑甜茶根系膜脂过氧化等的影响,可进一步加深酚酸对果树根系作用机理的认识,为生产上采取减轻连作障碍措施提供依据。
1 材料与方法 1.1 试材与处理平邑甜茶种子采自山东蒙山。将平邑甜茶种子于4 ℃条件下层积30天,待种子露白后,2007年3月24日播种于10 cm×10 cm的营养钵中,营养钵内装有经风干、过筛并于160℃高温处理2 h的0.3 kg棕壤,每钵1株,常规管理。苯甲酸由美国Sigma公司生产,用2 mL无水乙醇溶解后定容配制各处理溶液75,375,1 875 mg·L-1。
选取长势基本一致的平邑甜茶幼苗,2007年7月15日分别施入上述3种浓度苯甲酸溶液20 mL于营养钵中,使土壤苯甲酸浓度分别达到5,25和125 mg·kg-1,依次记作T1,T2和T3,以施入20 mL蒸馏水(含等量无水乙醇)为对照(CK)。本浓度参照Cecchi等(2004)和张江红(2007)及本试验前期所测定16年生苹果树根围5 cm范围内酚酸类物质含量所设定,25 mg·kg-1土接近土壤中苯甲酸含量而125 mg·kg-1则与土壤中10种主要酚酸物质含量总和相对应。处理后第0,1,3,5,8,11天取样测定,每3株(单株根量较少,约3 g)为取样单位,重复3次。
1.2 测定方法取根时,用剪刀在距营养钵土表面2 cm处剪断株茎,将营养钵倒扣于塑料盆中,用流水冲去根土将根系取出,迅速用自来水冲洗干净,选取直径1 mm左右的根系,再用蒸馏水冲洗、吸水纸擦干,部分根系液氮速冻、低温保存备用,另一部分根系于105℃杀青30 min,80 ℃烘至恒重,备用。
O2·测定:按照王爱国和罗广华(1990)的方法测定,以μmol·(gFW·h)-1表示O2·的产生速率。
MDA含量的测定:按照Heath等(1986)的方法。测定450,532和600 nm波长下的OD值,以ΔEmm [6.45·(OD532-OD600)·0.56×OD450]计算,用μmol·g-1FW表示MDA含量。
巯基含量的测定:参考王连方等(1999)和Ellman(1959)等的方法。根系粉碎过40目筛,称取0.5 g加入10 mL蒸馏水浸泡过夜,次日90 ℃加热30 min, 摇匀3 000 r·min-1离心20 min, 取上清液于520 nm波长下测定,以μg·g-1表示含量。
超氧化物歧化酶(SOD)活性根据Giannopolitis等(1997)的方法以抑制氮蓝四唑(NBT)光化还原50%为1个酶活力单位(U)。过氧化物酶(POD)活性测定采用Omran(1980)的方法,以吸光度值在A470每分钟变化0.01为1个酶活单位(U)。过氧化氢酶(CAT)活性采用Dhindsa等(1982)的方法,以每分钟A240减少0.1的酶量为1个酶活单位(U)。
矿质元素测定:将烘干的根系研磨过60目筛,称取0.2 g常规消煮后,氮元素含量采用凯氏定氮法测定,磷元素含量采用钼蓝比色法测定,钾元素含量采用火焰光度计法测定,铁元素、锰元素和锌元素含量采用原子吸收分光光度计法测定。
叶绿素含量测定:采用张志良(1990)的方法。
1.3 数据处理数据处理和作图采用Microsoft Excel软件和DPS 3.01完成。
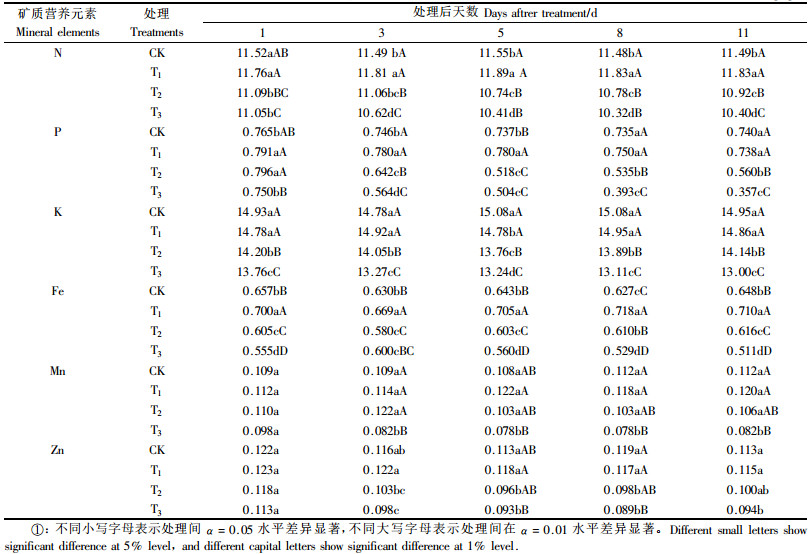
2 结果与分析 2.1 苯甲酸对根系O2·产生速率、MDA和巯基含量的影响不同处理根系中O2·产生速率变化如图 1所示,T1 O2·产生速率低于对照但未达到显著性差异,T2,T3产生速率变化趋势基本一致,即先上升后下降,两者O2·产生速率均在第5天达到最高值,分别为0.978,1.208 μmol·(gFW·h)-1,比对照高出11%和37%,之后O2·产生速率下降,T3 O2·产生速率下降幅度大于T2,T2,T3在第11天O2·产生速率仍高于对照,T2与对照相比达显著性差异,T3与对照达极显著性差异。
|
图 1 苯甲酸对平邑甜茶根系超氧阴离子自由基产生速率影响 Figure 1 Effect of benzoic acid on O2· productivity of roots of M. hupensis seedlings —◆—CK —□—T1 —△—T2 —○—T3下同The same below |
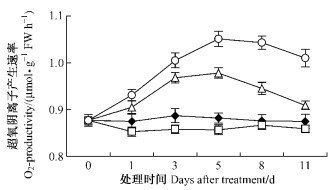
平邑甜茶幼苗根系MDA含量变化趋势(图 2)与根系中O2·产生速率变化趋势类似,即T1 MDA含量略低于对照未达到显著性差异,T2,T3 MDA含量变化呈先升后降趋势并表现出T3 MDA含量高于T2高于对照,T3比T2上升持续时间较长,到第5天达最大值,T2第3天即达最大值。
|
图 2 苯甲酸对平邑甜茶根系丙二醛含量的影响 Figure 2 Effect of benzoic acid on MDA content of roots of M. hupensis seedlings |
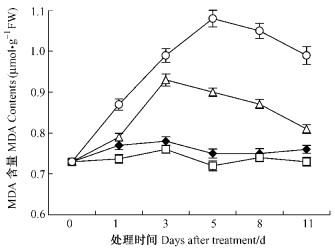
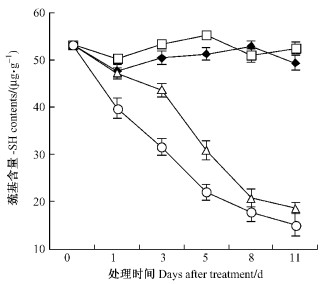
由图 3可以看出:T1巯基含量总体趋势略高于对照但未达显著性差异,T2,T3巯基含量变化呈下降趋势,且T3下降幅度大于T2,至第11天时T2,T3巯基含量分别为18.6,15.1 μg·g-1,是对照的37.7%和30.6%。
|
图 3 苯甲酸对平邑甜茶幼苗根系巯基含量的影响 Figure 3 Effect of benzoic acid on -SH content of roots of M. hupehensis seedlings |
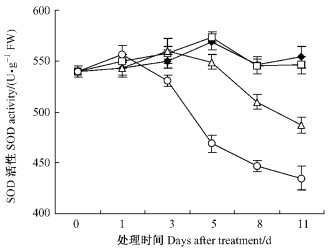
由图 4可知:不同浓度处理,根系SOD活性随处理时间延长均呈先升后降趋势。T1 SOD活性总体高于对照但未达到显著性差异,T2,T3该酶活性分别在第5天和第3天开始低于对照并达到显著性差异,之后两者持续下降,至第11天时该酶活性分别为487,435 U·g-1FW,是同期对照的87.9%和78.5%。
|
图 4 苯甲酸对平邑甜茶根系超氧化物歧化酶活性的影响 Figure 4 Effect of benzoic acid on SOD activity of roots of M. hupehensis seedlings |
加入苯甲酸改变了平邑甜茶根系POD活性(图 5),其中T1 POD活性亦高于对照,但未达到显著性差异。T2,T3 POD活性表现为先上升后下降,分别于第3天和第1天达到最大值,之后迅速下降,至第11天时两者该酶活性分别比对照下降了7%和15%,达显著性差异水平。

|
图 5 苯甲酸对平邑甜茶根系过氧化物酶活性的影响 Figure 5 Effect of benzoic acid on POD activity of roots of M. hupehensis seedlings |
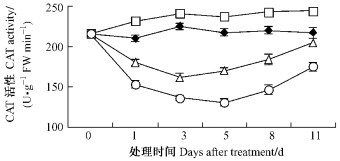
不同浓度的苯甲酸处理对根系CAT活性影响存在差异(图 6),T1 CAT活性高于对照并呈缓慢上升趋势。T2,T3该酶活性呈先降后升趋势,其数值皆低于同期对照,分别在第3天和第5天达到最小值且与对照达极显著性差异,随后上升,至第11天时上升为205,175 U·g-1FWmin-1,分别是对照的93%和81%。
|
图 6 苯甲酸对平邑甜茶根系过氧化氢酶活性的影响 Figure 6 Effect of benzoic acid onCAT activity of roots of M. hupehensis seedlings |
外源苯甲酸影响根系中矿质营养元素的含量,不同处理不同元素变化如表 1。T1根系中的N,P,Fe,Mn,Zn含量与同期对照相比呈增加趋势,其中Fe含量与对照达到显著性差异,而K含量略低于同期对照。T2,T3根系中除Mn,Zn以外的4种元素含量均低于对照并达到显著性差异,T3 6种矿质元素含量下降幅度大于T2。尽管Mn含量在T2中也低于对照但未达到显著性差异,同时Zn含量在T2、T3中虽低于对照但与对照亦无显著性差异。
|
|
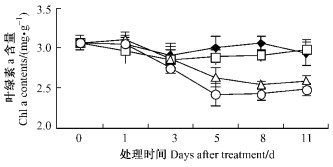
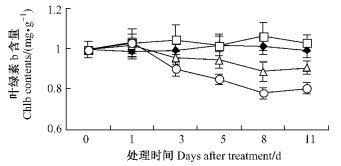
叶绿素含量对于苯甲酸处理的响应曲线如图 7,8所示。叶绿素a和叶绿素b具有相似的变化趋势,T1与对照之间差异不显著;T2,T3前期下降平缓,后期下降迅速,在第11天时略有回升但低于对照并达到差异显著性水平;叶绿素a,b含量均表现T2大于T3,说明随着浓度上升苯甲酸对平邑甜茶叶片的伤害作用增强。
|
图 7 苯甲酸对平邑甜茶叶绿素a含量的影响 Figure 7 Effect of benzoic acid on chla contents of M. hupehensis seedlings |
|
图 8 苯甲酸对平邑甜茶叶绿素b含量的影响 Figure 8 Effect of benzoic acid on chlb contents of M. hupehensis seedlings |
超氧阴离子自由基是生物体内一类重要的活性氧,是氧进行单电子还原首先生成的产物,由它可以转化成多种形式的活性氧。体内活性氧的产生与清除保持着动态平衡(吴强盛等,2007),在逆境条件下这种平衡被打破,自由基含量增高,造成膜脂过氧化。本试验中,T1超氧阴离子产生速率与对照之间无显著性差异,随着苯甲酸浓度的升高,T2、T3其产生速率快速上升且与对照达到差异显著性水平,在测定末期虽有所下降但仍高于对照。丙二醛是膜脂过氧化的产物,其含量是衡量膜脂过氧化程度的重要依据,测定过程中其含量变化趋势与超氧阴离子产生速率变化趋势相类似,低浓度与对照无显著性差异,随浓度升高丙二醛含量上升与对照达到差异显著性水平,在后期含量下降。王璞等(2001)的研究也认为,酚酸物质使植物体内自由基含量提高,MDA含量上升。朱慧等(2007)利用植物水浸液对牧草的研究也发现,抗氧化酶活性降低而MDA含量上升。
酚酸类物质能够与蛋白质上的活性巯基结合引起关键酶的烷基化作用进而影响基本代谢过程并抑制生长(Spring et al, 1982)。高浓度苯甲酸使平邑甜茶根系中巯基含量快速下降,可能与上述原因有关,巯基含量的下降势必使细胞膜结构受到伤害(Glass,1974)。
植物在逆境下受到的伤害或对逆境的不同抵抗能力往往与体内抗氧化酶活性有关。Baziramakenga等(1995)研究发现苯甲酸、肉桂酸处理后大豆根系中POD和CAT活性降低。何华勤(2006)的研究也发现酚酸可以抑制幼苗根系中SOD和CAT活性。
初期T2,T3对平邑甜茶根系SOD和POD活性无显著影响,但是其已经对根系造成伤害表现为O2·产生速率和MDA含量呈现上升趋势。在测定期内低浓度的苯甲酸处理与对照之间各指标数据表现为无显著差异,说明T1还没有达到对平邑甜茶幼苗根系的伤害作用浓度。SOD,POD,CAT是植物体内抗氧化保护体系的重要组成部分,随着苯甲酸浓度由低变高,造成其变化趋势的差异的原因可能有2个:首先SOD是1种诱导酶,T1诱导其活性升高,催化O2·与H+反应生成H2O2,进而在POD和CAT作用下将H2O2转化为H2O和O2活性(李合生,2002),正是由于3种酶的协同作用保护了细胞膜免受活性氧伤害,而T2,T3虽初期SOD,POD活性有所上升但已超出了根系自身的保护能力,不能起到有效的保护作用,对根系造成伤害且T3的伤害程度大于T2;其次随浓度升高苯甲酸对氮、磷等与酶合成相关元素的吸收能力的抑制作用逐渐增强,同时抑制其向DNA和RNA的整合进而减少抗氧化酶的数量,最终表现为活性的降低。
根系细胞膜由于发生膜脂过氧化作用胞内内容物大量外渗(Ni,2000;Glass, 1974),同时膜所具有的选择性吸收功能降低,从而影响植株对矿质营养元素的吸收和积累(陈冬梅等,2000),本试验根系MDA含量与矿质营养元素含量变化关系证实了上述结论。T2,T3叶绿素含量的下降可能与苯甲酸抑制了根系对矿质元素的吸收有关。氮、镁等是叶绿素的组成成分(孙玉桃等,2008),而铁、锰、锌等是其合成过程中酶促反应的辅因子(李合生,2002),有研究表明锰、锌等质量分数与叶绿素含量呈正相关(凌丽俐等,2009)。
本论文只探讨了不同浓度苯甲酸对平邑甜茶根系的作用,其浓度梯度设计是基于本研究的预试验和相关文献而设定,但苯甲酸对平邑甜茶根系伤害作用的临界浓度需进一步确定,此外,本文仅就部分生理指标讨论了苯甲酸对根系的伤害作用,更深层的原因没有涉及。因此,苯甲酸等酚酸类物质对平邑甜茶幼苗根系伤害的机制仍需进一步研究。
陈冬梅, 林文雄. 2000. 水稻化感作用研究现状与展望[J]. 福建农业大学学报, 29(3): 281-285. |
何华勤, 梁义元, 陈露洁, 等. 2006. 低磷营养胁迫下水稻化感抑草潜力的变化特性及其生理作用[J]. 应用生态学报, 17(11): 2070-2074. DOI:10.3321/j.issn:1001-9332.2006.11.014 |
李合生. 2002. 现代植物生理学[M]. 北京: 高等教育出版社.
|
孔垂华, 胡飞. 2002. 植物化感作用及其应用[M]. 北京: 中国农业出版社.
|
凌丽俐, 彭良志, 曹立, 等. 2009. 锦橙叶片镁质量分数与若干光合指标的相关性[J]. 果树学报, 26(2): 140-144. |
孙玉桃, 廖育林, 郑圣先, 等. 2008. 连续施用硫酸钾镁肥对柑橘的效应[J]. 中国土壤与肥料, (2): 40-43. DOI:10.3969/j.issn.1673-6257.2008.02.010 |
王爱国, 罗光华. 1990. 植物的超氧自由基与羟胺反应的定量关系[J]. 植物生理学通讯, (6): 55-57. |
王连方, 李菁, 张玲. 1999. 生物样品活性巯基测定法[J]. 地方病通报, 14(4): 22-26. DOI:10.3969/j.issn.1000-3711.1999.04.009 |
王璞, 赵秀琴. 2001. 几种化感物质对棉花种子萌发及幼苗生长的影响[J]. 中国农业大学学报, 6(3): 26-31. |
吴凤芝, 赵凤艳. 2003. 根系分泌物与连作障碍[J]. 东北农业大学学报, 34(1): 114-118. DOI:10.3969/j.issn.1005-9369.2003.01.025 |
吴强盛, 邹英宁, 夏仁学. 2007. 水分胁迫下丛枝菌根真菌对红橘叶片活性氧代谢的影响[J]. 应用生态学报, 18(4): 825-830. DOI:10.3321/j.issn:1001-9332.2007.04.020 |
杨兴洪, 罗新书. 1991. 果树再植问题的研究进展[J]. 果树科学, 8(4): 239-244. |
郁继华, 张韵, 牛彩霞. 2006. 两种化感物质对茄子幼苗光合作用及叶绿素荧光参数的影响[J]. 应用生态学报, 17(9): 1629-1632. DOI:10.3321/j.issn:1001-9332.2006.09.015 |
张江红, 毛志泉, 王丽琴, 等. 2007. 根皮苷对平邑甜茶幼苗生理特性的影响[J]. 中国农业科学, 40(3): 492-498. DOI:10.3321/j.issn:0578-1752.2007.03.009 |
张淑香, 高子勤, 刘海玲. 2000. 连作障碍与根际微生态研究Ⅲ.土壤酚酸物质及其生物学效应[J]. 应用生态学报, 11(5): 741-744. DOI:10.3321/j.issn:1001-9332.2000.05.023 |
张志良. 1990. 植物生理学实验指导[M]. 2版. 北京: 高等教育出版社, 133-135.
|
朱慧, 马瑞君, 陈树思, 等. 2007. 高寒草场主要牧草对黄帚吾水浸液化感胁迫的生理响应[J]. 草业科学, 16(5): 102-106. |
邹琦. 2000. 植物生理学实验指导[M]. 北京: 中国农业出版社, 72-75, 161-162.
|
Akiyama K, Matsuzaki K, Hayashi H. 2005. Plant sesquiterpenes induce hyphal branching in arbuscular mycorrhizal fungi[J]. Nature, 435: 824-827. DOI:10.1038/nature03608 |
Baziramakenga R, Leroux G D, Simard R R. 1995. Effects of benzoic and cinnamic acids on membrane permeability of soybean roots[J]. Journal of Chemical Ecology, 21: 1271-1285. DOI:10.1007/BF02027561 |
Blum U, Shafer S R. 1988. Microbial population and phenolic acids in soil[J]. Soil Biology and Biochemistry, 20(6): 793-800. DOI:10.1016/0038-0717(88)90084-3 |
Cecchi A M, Koskinen W C, Cheng H H. 2004. Sorption-desorption acids as affected by soil properties[J]. Biol Fertil Soils, 39: 235-242. DOI:10.1007/s00374-003-0710-6 |
Dhindsa R S, Plumb Dhindsa P, Thorpe T A. 1982. Leaf senescence correlated with increased levels of membrane permeability and lipid peroxidation and decreased levels dismutase and catalase[J]. J Expe Bot, 32: 91-101. |
Ellman G L. 1959. Tissue sulfhydryl groups[J]. Arch Biochem Boiphys, 82: 70-77. DOI:10.1016/0003-9861(59)90090-6 |
Giannopolitis C N, Ries S K. 1997. Purification and quantitative relationship with water-soluble protein in seeding[J]. Plant Physiol, 59: 315-318. |
Glass D K. 1974. Influence of phenolic acids on ion-uptake[J]. Plant physiol, 54: 855-858. DOI:10.1104/pp.54.6.855 |
Heath R L, Packer L. 1986. Photoperoxidation in isolated chloroplasts. Ⅰ. Kinetics and stoichiometry of fatty acid peroxidation[J]. Arch Bio Biophysio, 125: 189-198. |
Ni H W. 2000. Present status and prospect of crop allelopathy in China.//Kim KU, DH. Rice Allelopathy. Kyungpook: Kyunpook National University, 41- 48.
|
Omran R G. 1980. Peroxide levels and the activities of catalase, peroxidase and indoleacetic acid oxidase during and after chilling cucumber seedlings[J]. Plant Physiol, 65: 407-408. DOI:10.1104/pp.65.2.407 |
Perez P J. Root exudates of wild oats: Allelopathic effect on spring wheat[J]. Phytochemistry, 30(7): 2199-2202. DOI:10.1016/0031-9422(91)83614-Q |
Santos W D, Ferrarese M D L, Finger A, et al. 2004. Lignigication and related enzymes in Glycine max inhibition by ferulic acid[J]. Journal of Chemical Ecology, 30: 1203-1212. DOI:10.1023/B:JOEC.0000030272.83794.f0 |
Spring O, Hager A. 1982. Inhibition of elongtior growth by two sesquiterpene lactones isolated from Helianthus annuus L.[J]. Planta, 156: 433-440. DOI:10.1007/BF00393314 |
Tang C S, Young C C. 1982. Collection and identification of allelopathic compounds from the undisturbed root system of Bigalta limpograss (Henatthria altissima)[J]. Plant Physiol, 69: 155-160. DOI:10.1104/pp.69.1.155 |
Yu J Q, Ye S F, Zhang M F, et al. 2003. Effects of root exudates and aqueous root extracts of cucumber (Cucumis sativus) and allelochemicals, on photosynthesis and antioxidant enzymes in cucumber[J]. Biochemical Systematics and Ecology, 31: 129-139. DOI:10.1016/S0305-1978(02)00150-3 |
Yu J Q, Yoshihisa Matsui. 1997. Effects of root exudates of cucumber(Cucumis sativus) and allelochemicals on ion uptake by cucumber seedlings[J]. Journal of Chemical Ecology, 23(3): 817-827. DOI:10.1023/B:JOEC.0000006413.98507.55 |
 2009, Vol. 45
2009, Vol. 45