文章信息
- 赵燕, 杨龙, 曹露凡, 周成刚, 罗万春
- Zhao Yan, Yang Long, Cao Lufan, Zhou Chenggang, Luo Wanchun
- 4-己基间苯二酚和曲酸对舞毒蛾酚氧化酶的抑制作用
- Inhibitory Effects of Tetra-hexylresorcinol and Kojic Acids on the Phenoloxidase from Lymantria dispar
- 林业科学, 2009, 45(12): 95-99.
- Scientia Silvae Sinicae, 2009, 45(12): 95-99.
-
文章历史
- 收稿日期:2008-03-21
-
作者相关文章
2. 济南市林业局 济南 250102;
3. 山东省林业有害生物防控研究中心 泰安 271000
2. Jinan Forestry Administration Jinan 250102;
3. Research Center of Forest Pest Management of Shandong Province Tai'an 271000
酚氧化酶(PO)原系统是许多无脊椎动物免疫反应中的一个重要组成成分(Saleem et al., 2007)。根据底物专一性,PO可分为单酚氧化酶(EC.1.14.18.1)、儿茶酚氧化酶(EC.1.10.3.1)和漆酶(EC.1.10.3.2)3种,L-酪氨酸是单酚氧化酶的底物,多巴和邻苯二酚是儿茶酚氧化酶的底物(Makoto et al., 2005)。
酚氧化酶是一种多功能氧化还原酶,它既能催化单酚羟基化生成二酚,又能催化二酚氧化为醌(Yamamoto et al., 2000)。在生物体内,它先是将酪氨酸转化为多巴,涉及单酚酶的活性;然后将多巴转化为醌(Bai et al., 1997;Yamamoto et al., 2000),表现其二酚酶的活性;再经过一系列酶反应和非酶反应,醌最终转化为黑色素(Sritunyalucksana et al., 2000;Fang et al., 2002)。在其中的一步酶反应中多巴色素在多巴色素异构酶下生成二羟吲哚,最后二羟吲哚再转化为黑色素(Sugumaran, 1996; Shelby et al., 2000; Olivares et al., 2001)。
在昆虫的生理生化过程中PO有以下作用,包括昆虫表皮的硬化,防御外源入侵以形成包囊或使表皮黑化,伤口愈合(Ashida et al., 1995)等。PO催化醌形成的产物在昆虫的生长发育和生理防御方面起着重要作用,这些产物又是β-骨化、醌鞣化、黑色素合成等级联反应的第一步。抑制PO的活性能引起昆虫防御系统的瘫痪,或造成虫体畸形,因此抑制酚氧化酶的活性可用于害虫的防治,PO抑制剂为研究开发新型环境友好的害虫控制剂提供新线索(Xue et al., 2006)。
PO抑制剂已经应用于医药和化妆品工业(Maeda et al., 1991; Friedman, 1996),后来又发现铜离子螯合剂能抑制蘑菇酪氨酸酶。4-己基间苯二酚(4-Hexylresorcinol, 4HR)是L-多巴氧化过程中蘑菇酪氨酸酶的抑制剂(Chen et al., 2004)。曲酸天然化合物也能强烈地抑制甜菜夜蛾(Laphygma exigua)PO的活性(高兴祥等,2004),因此,PO抑制剂可以用于生产安全的农药来取代对环境危险性高的农药。对鳞翅目昆虫菜粉蝶(Pieris rapae)、槐尺蠖(Semiothisa cinerearia)、甜菜夜蛾、小菜蛾(Plutella xylostella)(Xue et al., 2006;Wang, et al., 2005;高兴祥等,2004)等食叶害虫的PO已有较多的研究,但对鳞翅目林业害虫舞毒蛾(Lymantria dispar)PO的性质还未见报道。本研究测定了4-己基间苯二酚、曲酸2种化合物对舞毒蛾PO(单酚氧化酶和儿茶酚氧化酶)的抑制活性及机制,以期以该酶为靶标研制开发“环境友好害虫控制剂”提供理论依据。
1 材料与方法 1.1 试虫和试剂本研究所用舞毒蛾幼虫皆为卵(采集于泰山林场巴山景区)于实验室孵化,天然饲料饲养至4~5龄,活体冷冻保存后备用。4-己基间苯二酚、曲酸和L-酪氨酸购于Sigma公司,邻苯二酚为国产分析纯。
1.2 酶液的提取将供试幼虫用0.02 mol·L-1、pH 7.0磷酸缓冲液(预冷)清洗后整体置于预冷的匀浆器中,按照8 mL·g-1体质量加入0.02 mol·L-1、pH7.0的磷酸缓冲液,冰浴下匀浆后在8000r·min-1、0 ℃条件下离心30 min,除去液面上的脂类和色素后,取上清液作为粗酶源。然后加入固体硫酸铵使其饱和度为35%,在冰浴下静置40 min后,于8000 r·min-1冷冻离心30 min,收集沉淀并溶解在少量的0.02 mol·L-1 pH7.0磷酸缓冲液中,然后在相同的缓冲液中透析24 h,其间更换5次透析液。浓缩后经Sephadex G-100凝胶过滤,即得到纯化倍数为7.04的舞毒蛾酚氧化酶。以每分钟每毫克蛋白吸光度提高0.001定义为1个酶活力单位(U)。
1.3 蛋白含量测定方法参照Bradford(1976)记述的考马斯亮蓝G-250染色法测定。
1.4 PO活力测定方法 1.4.1 单酚酶活力测定方法参照Benjamin等(1973)的方法并略有改进。以1 mmol·L-1 L-酪氨酸(Tyr)为底物,用0.02 mmol·L-1pH 7.0磷酸缓冲液配制底物,在2 mL的测活体系中,将0.2 mL含不同浓度4-己基间苯二酚或曲酸的磷酸缓冲液与1.6 mL底物溶液混合,在30 ℃恒温水浴下稳定30 min后加入0.2 mL酶液。
1.4.2 二酚酶活力测定方法以50 mmol·L-1邻苯二酚为底物,先将1.4 mL含不同浓度抑制剂的0.02 mmol·L-1磷酸缓冲液与1.5 mL底物溶液混匀,在30 ℃恒温水浴下稳定30 min后加入0.1 mL酶液。上述2种处理均在加入酶液后立刻混匀,测定410 nm波长下的光密度值随时间的增长直线,从直线的斜率求得酶活力。测定仪器为UV-2201分光光度计。4-己基间苯二酚和曲酸对酶抑制作用机制判断通过Lineweaver-Burk双倒数作图,比较酶催化反应的动力学参数。
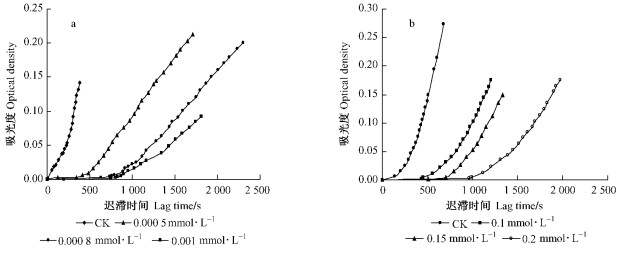
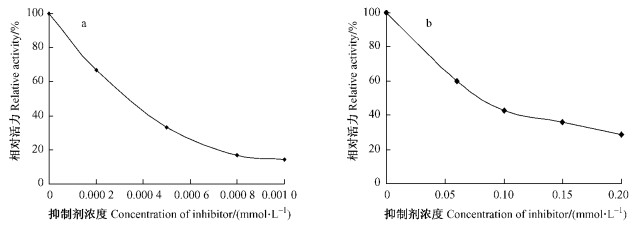
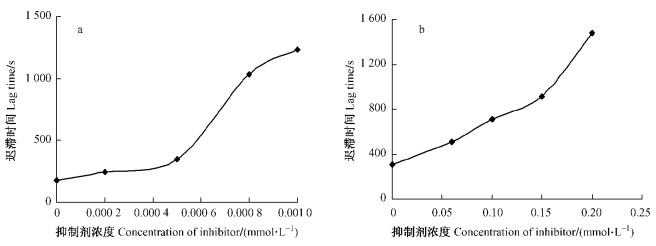
2 结果与分析 2.1 4-乙基间苯二酚和曲酸对酚氧化酶活力的影响将反应体系起始时的吸光度定为零,4-乙基间苯二酚与曲酸存在时舞毒蛾酚氧化酶单酚酶催化反应的进行曲线见图 1(a, b)。开始时,产物形成量缓慢增加,到一定时间后成直线上升,反应体系达到恒定的斜率,说明反应达到稳定态,直线外推得到的横截距为迟滞时间(刘晓丹等,2003)。由曲线可看出酶反应的迟滞时间随抑制剂浓度的增大而增大,而稳态酶活力(直线部分的斜率)随抑制剂浓度的增大而下降,说明这2种抑制剂对单酚酶活力均有明显的抑制作用。图 2(a, b)分别表示抑制剂4-乙基间苯二酚、曲酸对该酶稳态酶活力的影响,图 3(a, b)表示抑制剂对该酶催化L-酪氨酸迟滞时间的影响。由图 2a和图 3a可看出:随着4-乙基间苯二酚浓度的增大,酶反应的迟滞时间迅速增大,舞毒蛾酚氧化酶稳态酶的活力明显下降,其浓度为零时,迟滞时间为181 s;当该抑制剂浓度分别为0.000 2和0.000 5 mmol·L-1时,迟滞时间分别增大到253和372 s,稳态酶活力分别下降34%和69%。由图 2(b)和图 3(b)可看出:加入曲酸可以明显增加该酶催化L-酪氨酸的迟滞时间,当曲酸的浓度分别为0.1和0.15 mmol·L-1.时,其迟滞时间分别由对照的306 s增大到732和900 s,且该酶稳态酶的活力明显下降,分别下降61%和69%。由图 2(a, b)中该酶分别被4-乙基间苯二酚与曲酸抑制的趋势线可求出使该酶稳态酶活力下降50%的抑制剂浓度(IC50)分别为0.000 41和0.06 mmol·L-1。
|
图 1 4HR(a)与曲酸(b)抑制舞毒蛾酚氧化酶单酚酶反应的进程 Figure 1 Progress curves for the inhibition of phenoloxidase by 4HR (a) and kojic acid (b) in L.dispar |
|
图 2 4HR(a)与曲酸(b)对舞毒蛾单酚酶稳态酶活力的影响 Figure 2 Effect of 4HR (a) and kojic acid (b) on the steady-stase activity of monophenolase in L.dispar |
|
图 3 4HR (a)与曲酸(b)对舞毒蛾单酚酶迟滞时间的影响 Figure 3 Effect of 4HR (a) and kojic acid (b) on the lag time of monophenolase in L.dispar |
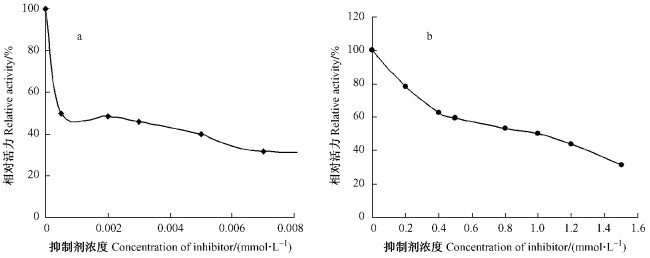
以邻苯二酚为底物,测定4-己基间苯二酚与曲酸对舞毒蛾酚氧化酶二酚酶活力。结果表明,在测定时间内,酶反应的进行曲线均为通过原点的直线,产物的形成量与时间成直线正比关系,表明该酶催化邻苯二酚氧化不存在迟滞过程,直线的斜率即为该酶活力。反应体系分别加入4-己基间苯二酚和曲酸后,直线斜率有不同程度的下降,表明这2种抑制剂对该酶均有抑制作用。图 4(a, b)分别表示4-己基间苯二酚和曲酸对二酚酶活力的抑制曲线,由该结果可看出,随着抑制剂浓度的增大,酶活力逐渐下降,当4-己基间苯二酚浓度为0.000 4 mmol·L-1时,酶活力下降41.74%,当其浓度增大至0.003 mmol·L-1 时,酶活力下降52.10%;当曲酸浓度分别为0.8和1.2 mmol·L-1时,酶活力分别下降47.12%和59.04%。由图 4(a, b)中该酶活力被抑制趋势线可求出4-己基间苯二酚与曲酸抑制舞毒蛾酚氧化酶活力的抑制中浓度(IC50)分别为0.000 35和0.92 mmol·L-1。
|
图 4 4HR(a)与曲酸(b)对舞毒蛾二酚酶活力的影响 Figure 4 Effect of 4HR (a) and kojic acid (b)on the steady-stase of diphenolase in L.dispar |
以邻苯二酚为底物,测定不同4-己基间苯二酚与曲酸浓度下酶液量对酚氧化酶活力的影响,如图 5(a, b)所示。结果表明,在设定的抑制剂浓度下,酚氧化酶活力与酶液量的关系均为通过原点的直线,说明这2种抑制剂抑制该酶活力的反应均为可逆性抑制。
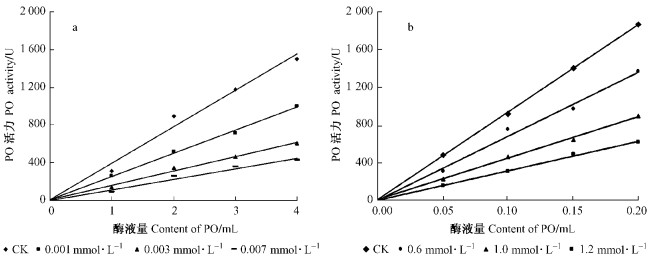
|
图 5 不同4HR(a)与曲酸(b)浓度下不同酶量对舞毒蛾二酚酶活力的影响 Figure 5 Effect of enzyme concentration on diphenolase activity in L.dispar at different concentrations of 4HR (a) and kojic acid (b) concentrations |
研究4-己基间苯二酚对舞毒蛾酚氧化酶二酚酶的抑制作用机制,在测活体系中,固定酶液浓度,改变底物邻苯二酚浓度,测定不同抑制剂浓度下酶活力随底物浓度变化的规律,以Lineweaver-Burk双倒数作图,得到一组相交于纵轴的直线,最大反应速率(Vmax)不变而米氏常数(Km)随抑制剂浓度的增大而增大,表明该抑制剂的抑制机理表现为典型的竞争性类型。Vmax不随抑制剂浓度的变化而变化,增大底物浓度可消除抑制剂对酶的抑制作用,表明底物与抑制剂同酶分子的结合是互相竞争的,而Km随抑制剂浓度的变化而变化,进一步表明该抑制剂与酶分子的结合和底物与酶分子的结合不是相互独立的。Km随抑制剂浓度的增大而增大,表明酶对底物的亲和力下降,抑制剂影响了底物与酶的结合。综合以上分析结果可得出,4-己基间苯二酚对舞毒蛾酚氧化酶为可逆性竞争抑制。以不同抑制剂浓度下测定的Km对抑制剂浓度作图为一条直线,从该直线的斜率可求得抑制常数(KI)为0.00015 mmol·L-1。同样方法测得曲酸也是舞毒蛾酚氧化酶的可逆性竞争抑制剂,其抑制常数(KI)为0.51 mmol·L-1。
3 讨论4-己基间苯二酚是一种抑制褐变的新型抗氧护色剂,它是虾中酪氨酸酶的有效抑制剂,并且安全性高(McEvily et al., 1991);并可有效抑制植物中酚氧化酶的活力(Wititsuwannakul et al., 2002)。4-己基间苯二酚现已应用于蘑菇、马铃薯(Solanum tu berosum)、苹果(Malus pumila)等果蔬的保鲜领域。
曲酸是某些微生物生长过程中经糖代谢产生的一种弱酸性天然化合物,具有酪氨酸酶抑制能力、抑菌能力、抗氧化能力和金属离子螯合能力,因此用途很广(Niwa et al., 1991)。其作为多酚氧化酶抑制剂,很早就有人研究,但到目前,其应用仅限于美白护肤、鲜花、果蔬保鲜和食品防腐(陶文沂等,2000)等领域,在昆虫领域的研究报道不是很多(谢桂英等,2003)。
本论文报道了4-己基间苯二酚和曲酸对从舞毒蛾中提取的PO活性的影响。结果表明4-己基间苯二酚和曲酸是竞争性抑制剂,这说明抑制剂只与游离酶结合形成EI而不是形成ES,这一发现与菜青虫、甜菜夜蛾(Xue et al., 2006; 高兴祥等,2004)报道的结果一致。
鉴于PO在昆虫发育过程中起着的重要作用,因此抑制这种酶的活性或改变这种酶的分布可以用于害虫的控制。这将是研制新型杀虫剂来代替对环境具有严重污染的,引发抗性、残留和再猖獗的传统杀虫剂的理论基础。
高兴祥, 罗万春, 谢桂英, 等. 2004. 甜菜夜蛾多酚氧化酶的特性及其对曲酸等抑制剂的反应[J]. 中国农业科学, 37(5): 687-691. DOI:10.3321/j.issn:0578-1752.2004.05.011 |
刘晓丹, 黄璜, 陈清西. 2003. 苯甲酸对蘑菇酪氨酸酶抑制作用机理的研究[J]. 厦门大学学报, 42(1): 102-106. DOI:10.3321/j.issn:0438-0479.2003.01.023 |
陶文沂, 孙微, 许正宏. 2000. 曲酸在食品中的应用[J]. 中国食品添加剂, 2: 26-30. DOI:10.3969/j.issn.1006-2513.2000.02.008 |
谢桂英, 罗万春, 马琛. 2003. 天然源化合物曲酸对小菜蛾酚氧化酶抑制作用研究初报[J]. 农药学学报, 1: 68-72. DOI:10.3321/j.issn:1008-7303.2003.01.011 |
Ashida M, Brey P. 1995. Role of the integument in insect defense: prophenoloxidase cascade in the cuticular matrix[J]. Proceedings of the National Academy of Science USA, 92: 10698-10702. DOI:10.1073/pnas.92.23.10698 |
Bai G, Brown J F, Watson C, et al. 1997. Isolation and characterization of phenoloxidase from egg masses of the gastropod mollusc, Biomphalaria glabrata[J]. Comp Biochem Physiol B, 118: 463-469. |
Benjamin N D, Montgomery M W. 1973. Phenoloxidase of Royal Ann cherries: purification and characterization[J]. J Food Sci, 38: 799-806. DOI:10.1111/jfds.1973.38.issue-5 |
Bradford M. 1976. A rapid and sensitive me of microgram quantities of protein of protein dye binding[J]. J Annual Biochemistry, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Chen Qingxi, Ke Lina, Song Kongkong, et al. 2004. Inhibitory effects of hexylresorcinol and dodecylresorcinol on mushroom (Agaricus bisporus) tyrosinase[J]. Journal of Protein Chemistry, 23: 135-141. DOI:10.1023/B:JOPC.0000020080.21417.ff |
Fang J, Han Q, Johnson J K, et al. 2002. Functional expression and characterization of Aedes aegypti dopachrome conversion enzyme[J]. Biochem Biophys Res Commun, 290: 287-293. DOI:10.1006/bbrc.2001.6200 |
Friedman M. 1996. Food browning and its prevention: an overview[J]. Journal of Agricultural and Food Chemistry, 44: 631-653. DOI:10.1021/jf950394r |
Maeda K, Fukuda M. 1991. In vitro effectiveness of several whitening cosmetic components in human melanocytes[J]. Journal of Society Cosmetic Chemistry, 42: 361-368. |
Hattori Makoto, Konishi Hirosato, Tamura Yasumori, et al. 2005. Laccase-type phenoloxidase in salivary glands and watery saliva of the green rice leafhopper, Nephotettix cincticeps[J]. Insect Physiology, 51: 1359-1365. DOI:10.1016/j.jinsphys.2005.08.010 |
McEvily A J, Iyengar R, Otwell W S. 1991. Sulfite alternative prevents shrimp melanosis[J]. Food Technology, 45: 80-86. |
Niwa Y, Akamasu H. 1991. Kojic acid scavenges free radical while potentiating leukocyte function including free radical generation[J]. Inflammation, 15(4): 303-315. DOI:10.1007/BF00917315 |
Olivares C, Jimenez C C, Lozano J A, et al. 2001. The 5, 6-dihydroxyindole-2-carboxylic acid (DHICA) oxidase activity of human tyrosinase[J]. Biochem J Rev, 354: 131-139. DOI:10.1042/bj3540131 |
Saleem A, Peters R, Sham V N, et al. 2007. Characterization of phenoloxidase activity in Sydney rock oysters (Saccostrea glomerata)[J]. Comp Biochem and Phys, (Part B): 1-11. |
Shelby K S, Adeyeye O A, Okot K, et al. 2000. Parasitism-linked block of host plasma melanization[J]. J Invertebr Pathol, 75: 218-225. DOI:10.1006/jipa.2000.4925 |
Wang Shudong, Luo Wanchun, Xu Shoujian, et al. 2005. Inhibitory effects of 4-dodecylresorcinol on the phenoloxidase of the diamondback moth Plutella xylostella (L.) (Lepidoptera Plutellidae)[J]. Pesticide Biochemistry and Physiology, 82: 52-58. DOI:10.1016/j.pestbp.2004.12.005 |
Sritunyalucksana K, Söderhäll K. 2000. The proPO and clotting system incrustaceans[J]. Aquaculture, 191: 53-69. DOI:10.1016/S0044-8486(00)00411-7 |
Sugumaran M. 1996.Roles of the insect cuticle in immunity//Söderhäll K, Iwanga S, Vasta G. New Directions in Invertebrate Immunology. SOS Publications, Fair Haven, 355-374.
|
Wititsuwannakul D, Chareyhiphakorn N, Pace M. 2002. Polyphenol oxidases from latex of Hevea brasiliensis: purification and characterization[J]. Photochemistry, 61(2): 115-121. DOI:10.1016/S0031-9422(02)00234-0 |
Wang Xiaoyun, Liu Chunying, Zhang Jiedao, et al. 2005. Inhibitory kinetics of quercetin on phenoloxidase from loopworm[J]. Insect Science, 12: 435-441. DOI:10.1111/ins.2005.12.issue-6 |
Xue Chaobin, Luo Wanchun, Chen Qingxi, et al. 2006. Enzymatic properties of phenoloxidase from Pieris rapae (Lepidoptera) larvae[J]. Insect Science, 13: 251-256. DOI:10.1111/ins.2006.13.issue-4 |
Yamamoto K, Yakiyama M, Fujii H, et al. 2000. Expression of prophenoloxidase mRNA during silkworm hemocyte development[J]. Biosci Biotechnol Biochem, 64: 1197-1202. DOI:10.1271/bbb.64.1197 |
 2009, Vol. 45
2009, Vol. 45

