文章信息
- 何学友, 黄金水, 蔡守平, 杨希, 余培旺, 陈顺立
- He Xueyou, Huang Jinshui, Cai Shouping, Yang Xi, Yu Peiwang, Chen Shunli
- 金龟子绿僵菌在松墨天牛成虫僵虫体上的宿存动态
- Survival Dynamics of Metarhizium anisopliae on Cadaverof Monochamus alternatus Adults
- 林业科学, 2009, 45(12): 77-82.
- Scientia Silvae Sinicae, 2009, 45(12): 77-82.
-
文章历史
- 收稿日期:2008-10-13
-
作者相关文章
2. 武夷山市林业局 武夷山 354300;
3. 福建农林大学林学院 福州 350002;
4. 国家林业局南方山地用材林培育重点实验室 福州 350012
2. Wuyishan Forest Bureau Wuyishan 354300;
3. Forestry College, Fujian Agriculture and Forestry University Fuzhou 350002;
4. Key Laboratory of Southern Moutain Timber Forest Cultivation, SAF Fuzhou 350012
昆虫流行病学研究是生物防治的重要研究内容之一,昆虫病原宿存动态是昆虫疾病流行学的重要组成部分之一,前人对多种病原真菌在不同生态环境下的宿存能力和影响因子做了较多研究,如球孢白僵菌(Beauveria bassiana)(Lingg et al., 1981;Ochi et al., 1982;Quinn et al., 1986;Studdert et al., 1990;樊美珍等,1996b;Rosin et al., 1996;孙继美等,1997;Arthurs et al., 2001;冯明光等,2002;王滨等,2003a;2003b;代鹏等,2005),金龟子绿僵菌(Metarhizium anisoplia)(樊美珍等,1991;1996a),莱氏野村菌(Nomuraea rileyi)(Ignoffo,1985),舞毒蛾噬虫霉(Entomophage maimaiga) (Weseloh et al., 1997),根虫瘟霉(Zoophthora radicans)(Furlong et al., 1997)等。僵虫作为侵染循环中病原体的初始载体,虫体上的大量病原体通过再次扩散、传播是造成林间流行病的重要途径;孢子在自然界中受紫外线、雨水、温度和湿度的影响(Walstead et al., 1970),这些因素直接影响到真菌孢子在林间的存活与散失,但有关僵虫体上病原体宿存动态方面的研究非常匮乏(Arthurs et al., 2001)。
绿僵菌是一种重要的虫生真菌,目前已广泛应用于农林害虫的生物防治中(Donald et al., 2004;代鹏等,2005)。松墨天牛(Monochamus alternatus)是松材线虫(Bursaphelenchus xylophilus)病的主要媒介昆虫,也是松林的重要蛀干害虫(杨宝君等,2003)。前人在筛选金龟子绿僵菌对松墨天牛强致病力菌株方面取得较大进展(Krueger et al., 1988;王四宝等,2004;何学友等,2005;2007;2008)。本试验根据松墨天牛的卵、幼虫及蛹3个虫态均生活在树干内难以防治的特点,以金龟子绿僵菌(以下简称绿僵菌)感染致死的松墨天牛成虫为材料,定量研究在林间然自条件下僵成虫体上绿僵菌孢子的宿存动态,对其传播和流行机理进行了探讨,为今后生产上利用绿僵菌防治暴露在树干外的松墨天牛成虫期提供理论依据。
1 材料与方法 1.1 供试僵成虫来源松墨天牛僵虫主要来自2006年、2007年绿僵菌MaYTTR-04菌株生物测定试验(何学友等,2007;2008),选择产孢良好且肉眼观察产孢量相当的僵成虫做为试验材料。
僵虫移放到林间前,测定其含孢量及孢子萌发率。测定方法参看何学友等(2005)方法。
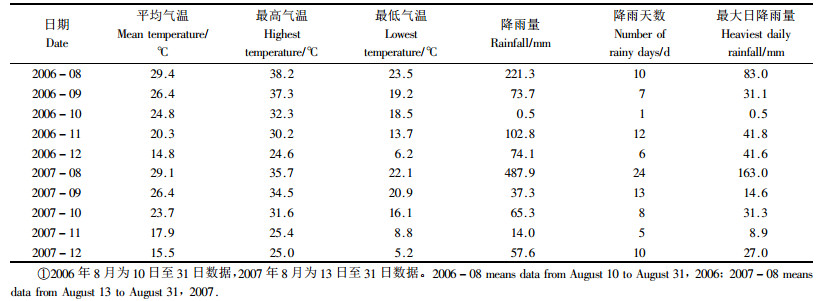
1.2 林间僵成虫体上孢子动态调查 1.2.1 试虫设置试验地位于福建省福州市北郊的福州国家森林公园,119°17.031′E,26°09.230′N,海拔105 m,东坡中部,红壤土。林分为马尾松(Pinus massoniana)与木荷(Schima superba)混交林,林龄为35年生,郁闭度0.85,马尾松平均树高21.5 m,平均胸径22.5 cm;木荷平均树高15 m,平均胸径14 cm。选择3块1.0 m×1.0 m的试验小区,小区间距离约8 m,对地被物稍作整理后在地面土表上挖若干个比僵虫略大且深度不超过1 cm的凹槽,将供试僵虫分别轻轻放置在3个小区地面的凹槽中(以使僵虫在地表相对固定),模拟僵虫自然掉落林地状态。每头僵虫的间距约15 cm,每小区34头,编号并插上标签。试验时间为2006年08-10—12-20、2007年08-13—2008-01-01,2年度重复试验。试验地气象条件见表 1。
|
|
每隔14天按随机取样法抽取各小区3头成虫,接种环沾取少量孢子于SDAY平板上,用灭过菌的三角形玻棒在平板上涂抹均匀,(25±1)℃培养24 h后,用小型接种铲切取大小1 cm2左右的培养基,置于干净的载玻片上(接种面朝上),滴一小滴杀菌液(0.85%氯化钠+3.5%福尔马林液),盖上盖玻片,显微镜下随机视野,利用目镜方格测微尺计数发芽孢子数(不论芽管长短,有芽管者均计为发芽)、未发芽孢子数,每次计数孢子数200~250个,每皿按三角形取样3点(3次重复),计算平均发芽率。
再将僵虫分别放入加有5 mL 0.3‰吐温-80的试管中,振荡5 min,充分洗下僵虫体(残肢)上的孢子并分散、稀释后,血球计数板测定孢子浓度,3次重复取平均值,换算成每头僵虫孢子含量。随着时间的推移,林间供试的僵虫逐渐腐烂,样本采集时应尽量仔细拾取掉落在地面尚未完全腐烂的头、足、前翅等残肢。
1.3 僵成虫体上孢子对松墨天牛幼虫致病力测定由于试验的前期在当地也是松墨天牛成虫发生的末期,成虫数量很少。因此,统一用松墨天牛幼虫进行致病力的测定。测定含孢量后的菌液,用0.3‰吐温-80无菌水配制成107孢子·mL-1浓度的菌悬液接种幼虫。如试验过程中因林间僵成虫体上孢子数量减少而不能配制成上述浓度的菌悬液,则直接将测定含孢量后的菌悬液用于接种。
将供试幼虫分别浸入菌液中7~10 s后取出,置于滤纸上稍微吸干水分。再将幼虫头朝下放入准备好的松木段孔中,每孔1头,塞上灭菌的棉花后,放入塑料密封袋中置于(25±1)℃的恒温箱中饲养,每3天观察记录死亡情况。每处理接种25头幼虫。死虫置于培养皿中保湿培养观察菌丝生长及产孢情况,并挑片在显微镜下确认是否为目标菌株感染。空白对照组用0.3‰吐温-80无菌水处理,其他步骤同前。另外,同时用在室内保存的纯孢粉分别配制成107 ,106,105孢子·mL-1浓度的菌悬液,每处理接种25头幼虫,与僵成虫体上孢子对幼虫的致病力进行对照。由于试虫数量的关系,对照仅在2007年8,10,12月各测定1次,取平均值。
1.4 数据处理数据应用DPS数据处理系统进行统计分析(唐启义等,2002)。
2 结果与分析 2.1 松墨天牛僵成虫体上含孢量与萌发率经测定,2006年供试僵虫平均含孢量(产孢量)为每成虫2.01×108个孢子,僵虫含孢量是菌株生物测定试验时接种量的109.8倍;2007年僵虫体上平均含孢量为2.30×108个,僵虫含孢量是接种量的100倍。2年度含孢量的差异不显著。孢子萌发率均在98%以上。
|
|
林间僵虫体上的孢子主要受3种因素作用而减少。首先,由风吹、雨淋等物理作用造成孢子被风吹散或冲刷到土壤中;其次,伴随虫体的腐烂,菌丝和孢子死亡后被其他微生物分解的生物化学作用;第三,林间各种动物,尤其是蚂蚁类小型节肢动物活动中有意或无意的碰触携带走孢子。孢子的散失过程也是绿僵菌扩散与传播的过程。
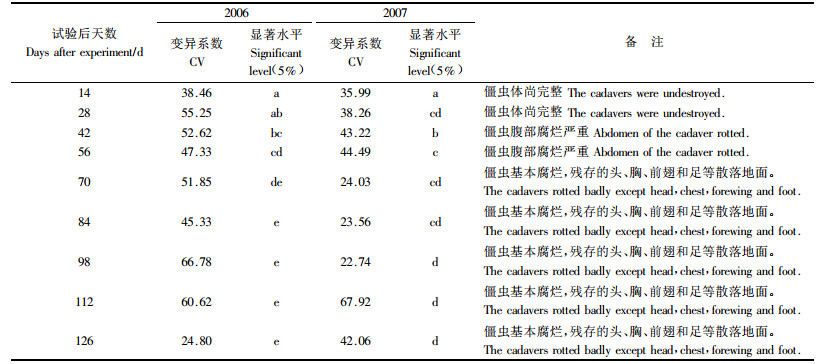
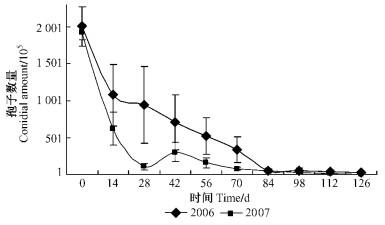
从图 1、表 3中可以看出,2年试验中僵虫体上绿僵菌孢子数量变化趋势较为一致,总体上在林地内变化动态可大致分3个阶段,即试验初期(0~42天)、中期(42~84天)和后期(84天后)。试验初期供试僵虫体上孢子量从108急剧下降到107~106数量级,下降了90%~99%,此期虫体基本完整,肉眼尚能清楚见到附着的绿色孢子。至中期,僵虫明显腐烂,部分肢体掉落分散,此时仍有个别僵虫上肉眼可见到分生孢子。到后期,僵虫腹部完全腐烂,在设置僵虫的位点附近只能见到较难分解且残缺不全的头壳、胸壳、前翅、足等部位,宿存于残肢上的孢子数量为105数量级水平。
|
图 1 松墨天牛僵成虫体上孢子动态 Figure 1 Dynamic of spores on the cadaver of M. alternatus |
|
|
数据分析表明,试验前期与后期孢子量变异系数比中期小,说明试验中期各僵虫个体上的孢子量差异较大。前期僵虫体上孢子数量较大,微环境没有对其体上的孢子量产生明显影响;随着时间的延续,不同位置雨水的冲刷、树叶的遮盖、光线的强弱等造成僵虫腐烂程度必然不尽相同,且累积效应差异越来越大,从而导致中期僵虫孢子量的变化往往因个体位点不同而出现很显著的差异(如一片树叶的遮挡就可避免孢子被雨水冲刷);随着试验的继续进行,后期僵虫基本腐烂且体上的孢子也大多损失殆尽,个体间微环境趋向一致(如树叶的覆盖程度),因此不同僵虫间孢子量差异较小。Duncan多重比较分析表明,试验初期、中期和后期的孢子量间存在显著差异,84天以后,孢子数量差异不显著,且与接种量处于同一数量级(图 1、表 3)。
2.3 不同年度林间僵成虫体上孢子数量变化比较孢子数量的减少与多种因素有关,如雨水、温湿度、风等,是一个非常复杂的过程,尤其是雨水,雨水具有淋溶与冲刷作用,同时雨多也导致林地潮湿,加速微生物分解。
僵虫体上的孢子在2007年下降速度较2006年快,下降幅度也更剧烈。2006年在试验的前70天,僵虫体上还保持有107数量级的孢子,而2007年僵虫在林间14天后,孢子就基本下降到106数量级,这是由于在2007年8月(僵虫于8月放置)降雨量(487.9 mm)为2006年8月(221.3 mm)的2倍多造成的。
2.4 僵成虫体上孢子萌发率的变化动态2年试验,林间松墨天牛僵虫体上的孢子在126天内、试虫已基本腐烂的情况下,附着在残体上的孢子平均萌发率虽然存在显著差异,但均保持在90%以上(图 2),说明僵虫体上的孢子能较长时间保持高萌发率,同时通过分析发现萌发率变异系数较小,均在10以下,说明不同个体的萌发率较为一致。
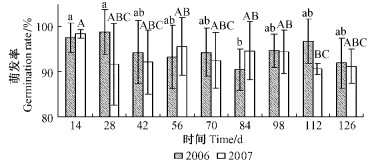
|
图 2 林间松墨天牛僵成虫体上绿僵菌孢子萌发率变化动态 Figure 2 Germination dynamic of M. anisopliae on cadavers in the forest 经Duncan新复极差检验不同大写字母表示差异极显著(P < 0.01),小写字母表示差异显著(P < 0.05)。下同。 Different small and capital letters indicate significant difference (5%) and very significant difference (1%) by Duncan's multiple range test, respectively. The same below. |
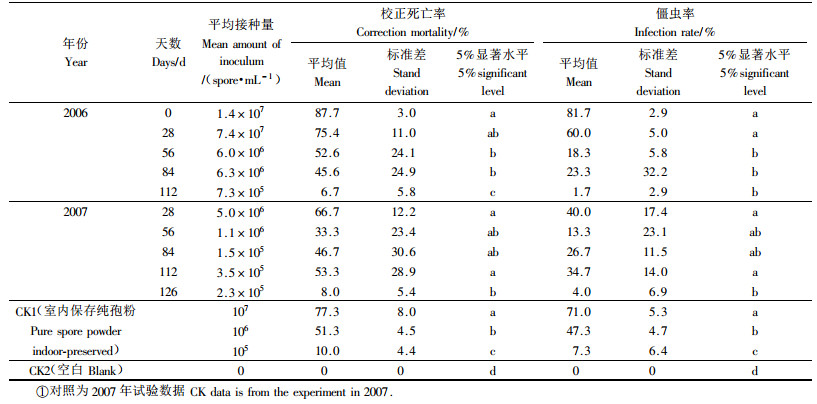
僵成虫体上孢子的致病力测定结果见表 4。由于僵虫体上孢子数量的减少,试验末期已不能配制到107数量级的孢悬液,随着孢悬液浓度的降低,绿僵菌对松墨天牛的校正死亡率与僵虫率均显著下降,但106数量级的孢悬液校正死亡率仍然在30%~67%之间。而105数量级的孢悬液校正死亡率则在6%~54%之间,出现很大的变化,且高死亡率的标准差很大,如2007年第84天所得死亡率标准差达到30.6,说明不同个体僵虫上孢子的致病力出现了较大差异。在107、106数量级的接种量下,僵虫体上的孢子致病力与对照差异不显著;在105数量级接种量下,僵虫体上孢子的致病力差异较大,如2007年84天、112天时僵虫体上孢子的致病力分别为46.7%和53.3%,显著高于126天的8.0%和对照的10.0%。研究结果说明僵虫体上的孢子在野外宿存的过程中可以较好地保持其致病力。
|
|
1) 研究病原菌在林间的传播、流行机制,需要获得病原体在自然界中的宿存和致病力的变化以及环境对宿存的影响等相关知识。Arthurs等(2001)研究发现,被绿僵菌感染的蝗虫不会被食腐动物(如蚂蚁等)清理,可在自然界中保留数周,有报道称可达数月(Hajek et al., 1994);僵虫宿存最大的影响因素是降雨(降雨量与降雨的频率)。本研究中,松墨天牛僵虫在马尾松与木荷混交林分,孢子量在试验初期下降速度最快,是由于2年试验中8月降雨量均较大;到84天后,僵虫含孢量降低到每成虫105~106个孢子水平,接近于当初松墨天牛成虫跗节法的接种量水平。说明绿僵菌孢子在林间地表的僵虫体上能够较长时间的宿存。
2) 真菌在昆虫体内生长的过程中会产生类似于抗生素等物质,使得僵虫不会被腐生物分解,通常可在林间保持几周至数月的活力(Hajek et al., 1994)。本研究中在林地湿度较大的条件下,各僵成虫体上的孢子在126天内均保持了90%以上的高萌发率,与前人研究结论基本吻合。
3) 由于供试僵虫孢子数量下降的原因,后期致病力测定的接种量虽然只有105孢子·mL -1浓度水平,没有达到通常致病力测定107孢子·mL-1的浓度,但仍表现出一定致病力。致病力强是筛选优良菌株的最终目标,孢子的萌发率高并不一定就具有强的致病力。本研究僵虫上孢子的致病力与室内同一数量级的接种浓度没有差异。因此,绿僵菌在僵虫体上的宿存过程中可较好的保存致病力,这对于林间绿僵病的传播和延续具有较大作用。
4) 感染病原真菌致死的僵虫,尤其是鞘翅目昆虫,体壁和其他组织器官组成成分差异较大,降解次序和速率不同,如虽内部组织完全腐烂降解,虫尸外表看上去还比较完好,但在内部组织与体壁之间的腔隙之间可能会形成产生和宿存孢子的场所,这部分孢子因体壁保护免受风、雨、光照的直接影响,对病原菌宿存和延续较为重要。本研究中测定僵虫体上孢子宿存量是直接将僵虫(残肢、体)放入吐温80溶液中振荡,可能存在某些部位的孢子不能彻底洗出的情况,这是否对结果有一定影响,需进一步研究。
5) 由于林间掉落于土壤表面的僵虫,较土壤中宿存的绿僵菌更容易传播,如风吹,雨水冲刷,林间昆虫、螨类、蜘蛛等小动物活动均能携播绿僵菌孢子。一般情况下,在林间鞘翅目成虫类僵虫较其他目昆虫或幼虫的僵虫难于腐烂。本研究在8—12月5个月间的马尾松与木荷混交林进行,由于不同年度、季节的林间温湿度等气象条件以及不同林分、立地等环境条件的差异,必然导致孢子数量、萌发率变化不尽相同。因此,在不同月份(松墨天牛成虫大多从5月开始羽化)、不同林分的孢子数量和萌发率变化有待进一步研究。
代鹏, 宋妍, 许天委, 等. 2005. 绿僵菌的研究进展[J]. 热带农业科学, 25(4): 73-77. |
樊美珍, 李建乾, 郭超, 等. 1991. 绿僵菌在土壤中宿存形式和存活时间的测定[J]. 西北林学院学报, 6(1): 48-54. |
樊美珍, 李增智. 1996a. 绿僵菌在土壤中的延续及控制桃小食心虫的潜力[J]. 应用生态学报, 7(1): 49-55. |
樊美珍, 李增智, 王成树, 等. 1996b. 感染球孢白僵菌的马尾松毛虫僵虫产孢量的测定[J]. 安徽农业大学学报, 23(3): 392-396. |
冯明光, 应盛华. 2002. 不同含水量和温度下贮存中球孢白僵菌分生孢子活力与内贮营养的衰变[J]. 应用生态学报, 13(4): 439-443. DOI:10.3321/j.issn:1001-9332.2002.04.014 |
何学友, 陈顺立, 黄金水. 2005. 感染松墨天牛的金龟子绿僵菌菌株的初步筛选[J]. 昆虫学报, 48(6): 975-981. DOI:10.3321/j.issn:0454-6296.2005.06.026 |
何学友, 陈顺立, 杨希, 等. 2007. 金龟子绿僵菌在森林土壤中的分布及对松墨天牛致病性测定[J]. 菌物学报, 26(2): 289-294. |
何学友, 蔡守平, 余培旺, 等. 2008. 金龟子绿僵菌MaYTTR-04菌株对松墨天牛成虫致病力[J]. 昆虫学报, 51(1): 102-107. DOI:10.3321/j.issn:0454-6296.2008.01.016 |
孙继美, 丁珊, 肖华, 等. 1997. 球孢白僵菌防治松褐天牛的研究[J]. 森林病虫通讯, (3): 16-18. |
蒲蛰龙, 李增智. 1996. 昆虫真菌学[M]. 合肥: 安徽科学技术出版社, 26, 714.
|
唐启义, 冯明光. 2002. 实用统计分析及其DPS数据处理系统[M]. 北京: 科学出版社.
|
王滨, 聂英奇, 李增智, 等. 2003a. 白僵菌在土壤中宿存的数量、毒力及产孢量变化的研究[J]. 安徽农业大学学报, 30(1): 40-43. |
王滨, 樊美珍, 李增智. 2003b. 白僵菌无纺布结合引诱剂防治鞘翅目林业害虫研究初报[J]. 中国生物防治, 19(2): 91-92. |
王四宝, 黄勇平, 张心团, 等. 2004. 松褐天牛成虫高毒力病原菌筛选及林间感染试验[J]. 中国森林病虫, 23(6): 13-16. DOI:10.3969/j.issn.1671-0886.2004.06.003 |
杨宝君, 潘宏阳, 汤坚, 等. 2003. 松材线虫病[M]. 北京: 中国林业出版社.
|
张立钦, 刘军, 吴鸿. 2000. 松墨天牛优良白僵菌菌株筛选[J]. 南京林业大学学报, 24(2): 33-37. DOI:10.3969/j.issn.1000-2006.2000.02.008 |
Arthurs S P, Thomas M B, Lawton J L. 2001. Seasonal patterns of persistence and infectivity of Metarhizium anisopliae var. acridum in grasshopper cadavers in the Sahel[J]. Entomologia Experimentalis et Applicata, 100(1): 69-76. DOI:10.1046/j.1570-7458.2001.00849.x |
Donald W R, Raymond J S L. 2004. Metarhizium spp., cosmopolitan insect-pathogenic fungi:mycological aspects[J]. Advances in Applied Microbiology, 54: 1-70. DOI:10.1016/S0065-2164(04)54001-7 |
Furlong M J, Pell J K. 1997. The influence of environmental factors on the persistence of Zoophthora radicans conidia[J]. J Invertebr Pathol, 69: 223-233. DOI:10.1006/jipa.1996.4649 |
Hajek A E, St.Leger R J. 1994. Interactions between fungal pathogens and insect hosts[J]. Annual Review of Entomology, 39: 293-321. DOI:10.1146/annurev.en.39.010194.001453 |
Ignoffo C M. 1985. Manipulating enzootic-epitzootic diseases of arthropods//Hoy M A, Herzog D C. Biological Control in Agricultura1 IPM System. New York & London: Academic Press, 241-279.
|
Krueger S R, Villani M G, Roberts D W. 1988. Bioassay of Beauveria brongniartii and Metarhizium anisopliae dry mycelium in soil against scarab larvae. Progr Abstr, 21st SIP AnnMeet, San Diego, CA.
|
Lingg A J, Donaldson M D. 1981. Biotic and abiotic factors affecting stability of Beauveria bassiana conidia in soil[J]. J Invertebr Pathol, 38: 191-200. DOI:10.1016/0022-2011(81)90122-1 |
Ochi K, Igarashi Y, Shimazu M. 1982. Natural microbial enemies to control Monochamus alternatus. Trans 93rd Ann Meet Jap For Soc, 401-402.
|
Quinn M A, Hower A A. 1986. Isolation of Beauveria bassiana from alfalfa field soil and its effect on adult Sitona hispidulus[J]. Environ Entomol, 14(5): 650-653. |
Rosin F, Shapiro D I, Lewis L C. 1996. Effects of fertilizers on the survival of Beauveria bassiana[J]. J Inverterbr Pathol, 68: 194-195. DOI:10.1006/jipa.1996.0083 |
Studdert J P, Kaya H K. 1990. Water potential, temperature, and soil type on the formation of Beauveria bassiana soil colonies[J]. J Inverterbr Pathol, 56: 380-86. DOI:10.1016/0022-2011(90)90125-P |
Walstead J D, Anderson R F, Stambaugh W J. 1970. Effects of environmental conditions on two species of muscardine fungi (Beauveria bassiana and Metarhizium anisopliae)[J]. J Invertebr Pathol, 16: 221-226. DOI:10.1016/0022-2011(70)90063-7 |
Weseloh R M, Andreadis T G. 1997. Persistence of resting spores of Entomophaga maimaiga, a fungal pathogen of the gypsy moth, Lymantria dispra[J]. J Inverterbr Pathol, 69: 195-196. DOI:10.1006/jipa.1996.4645 |
 2009, Vol. 45
2009, Vol. 45