文章信息
- 谢树章, 秦平伟, 张迷, 胡雨晴, 李名扬, 眭顺照
- Xie Shuzhang, Qin Pingwei, Zhang Mi, Hu Yuqing, Li Mingyang, Sui Shunzhao
- 蜡梅几丁质酶基因的克隆与原核表达
- Cloning and Prokaryotic Expression of a Chitinase cDNA from Chimonanthus praecox
- 林业科学, 2009, 45(12): 36-41.
- Scientia Silvae Sinicae, 2009, 45(12): 36-41.
-
文章历史
- 收稿日期:2009-02-26
-
作者相关文章
2. 重庆市农业科学院生物技术研究中心 重庆 400055
2. Biotechnology Research Center, Chongqing Academy of Agricultural Sciences Chongqing 400055
几丁质(chitin)是广泛存在于自然界的直链状高分子生物多聚体,为地球上第二大可再生的天然多聚物资源,仅次于纤维素(Boller et al., 1983)。它不仅是大多数真菌细胞壁的主要成分之一,同时也大量存在于昆虫和海洋生物的甲壳及昆虫的肠道中(Watanabe et al., 1999)。几丁质酶(chitinase)是一种能催化降解几丁质的糖苷酶,主要水解几丁质多聚体中β-1, 4糖苷键, 产生几丁质单糖——N-乙酰氨基葡萄糖(NAG)。
资料显示,几丁质酶具有抗菌、抗寒和抗冻等多种抗逆作用,受到广泛关注(赵晓芳等, 2008)。Brogue等(1991)和Pasonen等(2004)通过转基因等生物技术手段研究表明几丁质酶跟植物的抗病虫害密切相关。Kikuchi等(2009)研究表明几丁质酶的积累能够提高高丛蓝莓(Vaccinium corymbosum)茎芽的抗寒性。Hon等(1995)在经低温驯化后的冬黑麦(Secale cereale)中分离纯化得到了同时具有内切几丁质酶活性和抗冻活性双重活性的酶。因此,深入研究植物几丁质酶,对探索植物的抗逆机制具有重要的意义。然而,正常情况下,植物几丁质酶作为一种诱导酶在植物体内含量很低(Gao et al., 2003),在植物体内分析其性质、作用存在相当的难度,客观上阻碍了对几丁质酶生物学功能的分析及进一步的应用研究。
蜡梅(Chimonanthus praecox)花期正值腊月寒冬,秦华等(2006)首次从分子角度对其抗寒性进行了研究。蜡梅开花过程具有高耐寒、无病虫害、无机械损伤等特点,蜡梅几丁质酶在这一过程中的性质和作用如何,是个值得探索的问题。本研究从实验室已构建好的蜡梅花cDNA文库(眭顺照等, 2007)中克隆到1个ORF长为954 bp的几丁质酶基因cDNA序列, 并构建原核表达载体pET-28a/Cpchia,转化宿主大肠杆菌(Esherichia coli) BL21,诱导表达获得了重组蛋白。然后进行纯化复性,进而对该几丁质酶进行活性检测和特性分析。这对于蜡梅几丁质酶的功能分析, 深入研究该几丁质酶在蜡梅开花生理过程中的作用具有重要意义,并为蜡梅花抗寒机制的研究提供新思路和开辟新途径。
1 材料与方法 1.1 材料大肠杆菌XL1-Blue菌株; 原核表达载体pET-28a(+)及宿主菌BL21菌株; 蜡梅花cDNA文库由西南大学花卉研究所构建保存。
1.2 目标克隆子的获得及序列分析随机挑选文库克隆, 提取质粒DNA, 以5′ pTriplEx2 Sequence primer为测序引物, 采用A BI 3 700 DNA Sequence DNA自动序列测定仪进行正向序列测定得到EST序列, 然后运用DNAStar软件包的SeqMan进行EST聚类, 在本地运行BLASTX与nr库进行比对, 对目标克隆子(编号:CH0694)再以SP5和T7为测序引物进行2次正反向序列测定。本地分析主要采用DNAMAN4.0和DNAStar7.0软件包进行。利用SignalP分析蛋白信号肽,利用PSORT软件预测亚细胞定位情况,利用NetPhos 2.0分析蛋白磷酸化位点。
1.3 原核表达载体的构建根据目的基因序列,切除一段20个氨基酸构成的信号肽序列,并设计合成1对PCR扩增引物。上游引物: 5’-GCGGATCCACTGGAAGCCAAGCAG-3’,下划线为BamHⅠ酶切位点; 下游引物: 5’-CCCAAGCTTCCTAAGCATTGAAAGGCCT-3’,下划线为HindⅢ酶切位点。将PCR产物与pMD18-T载体连接转化大肠杆菌XL1-Blue,提取质粒与表达载体pET-28a(+)均用BamHⅠ和HindⅢ双酶切, 分别回收目的片段和线性载体并连接, 转化大肠杆菌BL2l感受态细胞,PCR、酶切及测序验证。筛选阳性克隆,命名为pET-28a/Cpchia。
1.4 pET-28a/Cpchia在BL21(DE3)中的表达和原核表达体系的优化挑取pET-28a/Cpchia阳性克隆,接种于3 mL含有50 μg·mL-1卡那霉素的LB液体培养基中过夜培养,次日按1:50的比例扩大培养,至OD600≈0.6时,加入IPTG(浓度分别为0,0.1,0.5,1,1.5,2 mmol·L-1); 诱导温度分别设定为18,28,37 ℃; 诱导时间设为3,4,5,6 h,设置对照处理(CK)。SDS-PAGE电泳检测分析。利用复日FR-980生物电泳图像分析系统所内含的SMART VIEW分析软件分析蛋白电泳图,计算重组蛋白的表达丰度值。
1.5 重组蛋白pET-28a/Cpchia包涵体的分离纯化与复性将诱导表达后的菌液高速离心(13 000 r·min-1),沉淀按比例(20 mL裂解液/1g湿菌体)加入细胞裂解液(50 mmol·L-1 Tris-HCl,2 mmol·L-1 EDTA,100 mmol·L-1 NaCl,0.5% Triton X-100,1 mg·mL-1溶菌酶,0.1 mmol·L-1 PMSF)裂解30 min,超声波细胞破碎15 min,离心沉淀用洗涤缓冲液洗涤后加入20 mL包涵体溶解缓冲液(50 mmol·L-1 Tris-HC l,2 mmol·L-1 EDTA,100 mmol·L-1 NaCl,8 mol·L-1尿素,0.1 mmol·L-1 PMSF),室温静置3 h,期间不断振荡混匀,直至沉淀全部溶解。低温高速离心(4 ℃, 13 000 r·min-1),上清在一定尿素梯度(4 m ol·L-1—3 mol·L-1—2 mol·L-1—1.5 mol·L-1—1 mol·L-1—0.5 mol·L-1—0 mol·L-1)下从高到低于4 ℃低温透析,每8 h更换1次透析缓冲液。并利用Bradford法测定复性后蛋白质含量(Bradford, 1976)。
1.6 几丁质酶酶学性质的测定与分析 1.6.1 几丁质酶定性分析按Hunag等(1997)的方法,稍做改进。在2%几丁质-琼脂平皿上,放3张灭过菌的小圆形滤纸,分别用50 μL酶液、100 μL酶液和100 μL灭活酶液处理,37 ℃培养48 h,观察水解几丁质后形成透明圈的大小。
1.6.2 几丁质酶活性的测定按Thamthiankul等(2001)方法,略作改进。取0.5 mL的酶液,加0.5 mL 2%胶体几丁质及0.5 mL磷酸缓冲液(pH 7.0)于37 ℃反应1 h后煮沸灭活10 min。冷却后离心取上清1.3 mL加双蒸水至2 mL,加入2 mL 3, 5-二硝基水杨酸(DNS)沸水浴6 min显色, 530 nm下测吸光度以确定还原糖的量。以N-乙酰氨基葡萄糖(NAG)作标准曲线。1单位几丁质酶酶活性定义为:在指定条件下每分钟从几丁质中释放的1 μg NAG所需的酶量。
1.6.3 温度及pH值对几丁质酶活性和稳定性的影响取0.5 mL的酶液,加0.5 mL 2%胶体几丁质及0.5 mL pH调节缓冲液(范艳华,2006), 制成不同pH的反应混合液。将pH 7.0的反应混合液置于不同的温度下(0~80 ℃)反应1 h,测定酶活性。将酶液分别于上述不同的温度下放置1 h后,再测定残余酶活性。将上述不同pH的反应混合液在37 ℃反应1 h,测定酶活性。将酶液分别于不同pH调节缓冲液(pH 3.0~10.0)下放置1 h后,再测定残余酶活性。
2 结果与分析 2.1 Cpchia克隆子的获得及其cDNA序列特征随机测序后EST分析显示,EST序列DW222925对应的目标克隆子CH0694上的cDNA片段可能属几丁质酶基因,以SP5和T7为测序引物的测序结果初步表明获得的CH0694是源于蜡梅几丁质酶的全长cDNA。克隆的Cpchia cDNA长1 184 bp, 包含1个954 bp的ORF,编码蛋白由317个氨基酸残基组成,理论分子质量约33.5 ku,预测等电点为5.07,命名为Cpchia(GenBank登录号:FJ749130)。
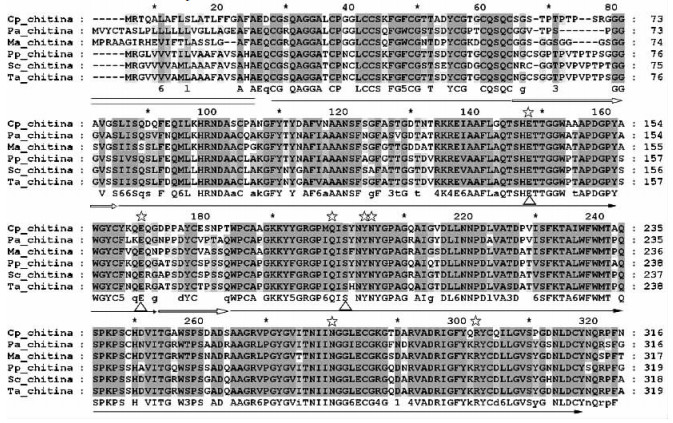
运用Blastx进行比对发现,Cpchia与多个种类几丁质酶序列有较高的同源性,排在第1,2位的分别为草地早熟禾(Poa pratensis)和小麦(Triticum aestivum)(图略)。保守结构域分析显示,该几丁质酶为19家族几丁质酶,大部分的植物几丁质酶都属于这个家族。如图 1所示,包含1个富含cys和gly的几丁质结合域和1个完整保守的几丁质酶催化区,以及1个富含pro的链接区,无C端扩展区,根据Yeh等(2000)的研究结果,初步推测为Class Ⅰb型几丁质酶。信号肽分析显示在N端含有1个长约20 aa信号肽序列。蛋白亚细胞定位分析显示该蛋白可能定位于胞外,这与该几丁质酶功能推测结果相一致。磷酸化位点分析显示该几丁质酶有多个磷酸化位点,推测翻译后蛋白可能进行多样化修饰,这与几丁质酶多抗性特性相关。
|
图 1 Cpchia与同源基因编码区氨基酸序列比对 Figure 1 Alignment of the deduced amino acid sequences of ORF of Cpchina Cp:蜡梅 Chimonanthus praecox; Pa:鳄梨 Persea americana(Z78202);Ma:小果野芭蕉 Musa acuminata(AJ277279);Pp:草地早熟禾 Poa pratensis(AF000966); Sc:冬黑麦 Secale cereale(AF280437);Ta:小麦 Triticum aestivum(AY437443). =:信号肽序列Signal peptide sequence; —:几丁质结合域ChtBD1; :链接区 Hinge region→:催化区 Catalytic domain; ☆:推定的糖结合位点 Putative sugar binding site; △:催化残基 Catalytic residues. :链接区 Hinge region→:催化区 Catalytic domain; ☆:推定的糖结合位点 Putative sugar binding site; △:催化残基 Catalytic residues. |
将Cpchia蛋白质序列与其他植物同源序列比较发现,该序列与鳄梨(Persea americana)、小果野芭蕉(Musa acuminata)、草地早熟禾、冬黑麦、小麦等植物的几丁质酶序列高度同源,同源性分别为73.0%,71.9%,72.6%,71.4%,72.6%(图 1),进一步证明本试验克隆得到的基因为编码蜡梅几丁质酶的全长cDNA。进而将该蛋白质序列与其他24条同源序列利用ClustalW方法进行多重比对,然后构建进化树(图 2)。结果显示,Class Ⅳ、Class Ⅱ、单子叶植物和双子叶植物几丁质酶分别形成单独的一支,这与Hamel等(1997)的研究结果是一致的。另外蜡梅与鳄梨、葡萄(Vitis vinifera)的几丁质酶单独形成了1个小分支,显示它们的同源关系较近。

|
图 2 几丁质酶类蛋白质进化树分析 Figure 2 The phyligenetic tree of the chitinase-like protein Nucleotide substitutions(×100):表示经100个重复的 bootstrap 分析所得的核苷酸替换率 Indicating the nucleotide substitutions of 100 replications of bootstrap analysis. |
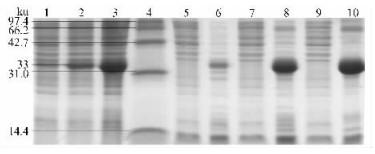
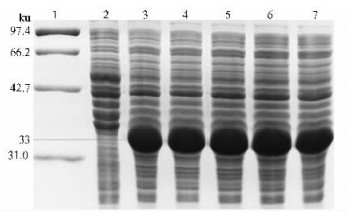
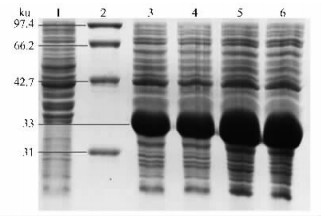
以CH0694克隆子为模板,用设计引物扩增出目的片段,将其连接到pMD-18T载体上,PCR和测序结果表明连接成功并准确无误。然后用HindⅢ+BamHⅠ同时双酶切pMD-18T/Cpchia和pET-28a(+),分别胶回收基因片段和线性载体并连接转化大肠杆菌BL21感受态细胞。用双酶切方法验证,电泳结果和条带大小都与预期一致。测序结果(略)鉴定出插入的序列及其读码框准确无误。从结果(图 3)来看,在18 ℃下,重组蛋白基本不表达。28 ℃和37 ℃都出现了33 ku左右的表达特异带,与预期大小相符,且37 ℃要比28 ℃表达量高很多。但破碎上清都没有目的条带,表明没有可溶蛋白产生。综合表明诱导温度在试验范围内对可溶融合蛋白的产生影响不大,且温度下降会降低融合蛋白的表达量,这与董娜等(2008)的研究结果一致。在试验条件下,加入IPTG的浓度变化对表达量影响不明显(图 4),而未加IPTG的没有特异条带出现,根据结果综合考虑选择0.5 mmol·L-1的IPTG作为试验诱导浓度。随着诱导时间的增加,目的蛋白的表达量逐渐增加(图 5)。到5 h达到最大值(占菌体总蛋白的52%),5 h后表达量没有继续增加。因此,选择5 h作为试验诱导时间。
|
图 3 温度对pET-28a/Cpchia表达的影响 Figure 3 The expression of pET-28a/Cpchia at different temperatures 1-3:18,28,37 ℃诱导表达菌液 Total protein induced at 18, 28, 37 ℃;4:蛋白质标准分子质量 Protein marker; 5,7,9:18,28,37℃破碎上清 Supernatant after supersonic (18, 28, 37 ℃);6,8,10:18,28,37 ℃ 破碎沉淀 Inclusion body after supersonic (18, 28, 37 ℃). |
|
图 4 IPTG终浓度对pET-28a/Cpchia表达的影响 Figure 4 The expression of pET-28a/Cpchia in different IPTG 1:蛋白质标准分子质量 Protein marker; 2:未加 IPTG 的 pET-28a/Cpchia Non-induced pET-28a/Cpchia; 3-7:分别为0.1,0.5,1,1.5,2 mmol·L-1 IPTG终浓度诱导的 pET-28a/Cpchia Induced with 0.1,0.5,1,1.5,2 mmol·L-1 of IPTG. |
|
图 5 诱导时间对pET-28a/Cpchia表达的影响 Figure 5 The expression of pET-28a/Cpchia in different time 1:空载 pET-28a(+);2:蛋白质标准分子质量 Protein marker;3-6:分别加入0.5 mmol·L-1 IPTG诱导3,4,5,6 h Induced pET-28a/Cpchia at 3,4,5,6 h respectively. |
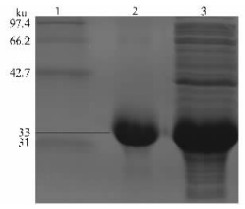
重组蛋白以包涵体的形式存在,通过8 mol·L-1尿素缓冲液进行溶解,然后使用透析袋透析复性,SDS-PAGE电泳检测结果(图 6)与预期一致,显示通过分离纯化获得较高浓度(0.729 mg·mL-1)和纯度(95%)的复性蛋白。
|
图 6 重组目的蛋白的分离与纯化 Figure 6 The purification of fusion protein 1:蛋白质标准分子质量 Protein marker; 2:纯化复性蛋白 Protein after purified and refolded; 3:IPTG 诱导后菌液 pET-28a/Cpchia induced by IPTG. |
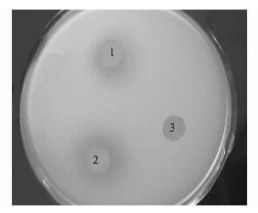
由图 7可以看出,50 μL酶液具有较高的几丁质酶活性,在几丁质平板形成明显的水解圈(R≈2.5 cm),100 μL酶液处理的水解圈更加明显,直径长达3.5 cm,而对照却没有形成水解圈,初步说明重组复性蛋白具有一定的几丁质酶活性。
|
图 7 几丁质酶定性分析 Figure 7 Chitinase assay 1:50 μL酶液50 μL refolded chitinase; 2:100 μL酶液100 μL refolded chitinase; 3:100 μL灭活后酶液100 μL inactivated chitinase. |
以2%的胶体几丁质为底物,通过DNS法检测出重组复性蛋白的几丁质酶活性达到200 U·mL-1, 说明复性蛋白具有较高的酶活力。
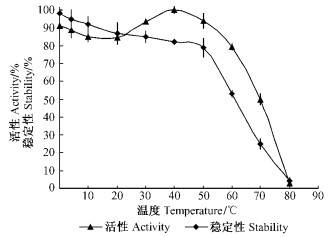
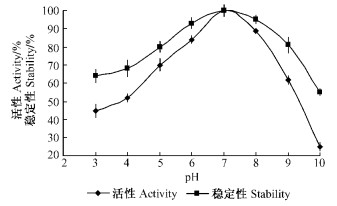
2.5.3 温度及pH值对活性和稳定性的影响在不同的温度下酶解底物,结果如图 8所示,几丁质酶在40 ℃活性最高,50 ℃以下保持活性稳定,80 ℃接近失活。但在0 ℃低温下,活性比10,20 ℃时要高,说明该几丁质酶在低温下也具有很高的活性。由图 9可以看出,几丁质酶活性和稳定性在pH7.0时达到最高,并随着pH值的增减,活性和稳定性出现了不同程度的下降。
|
图 8 温度对几丁质酶活性/稳定性的影响 Figure 8 The activity and stability of chitinase at the different temperature |
|
图 9 pH值对几丁质酶活性/稳定性的影响 Figure 9 The activity and stability of chitinase at the different pH |
本研究从实验室已构建好的蜡梅花cDNA文库中克隆到1个长约1 184 bp的几丁质酶基因Cpchia, 该基因编码317个氨基酸,与鳄梨、草地早熟禾等植物的几丁质酶具有较高的同源性,在N端有一段长20aa的信号肽序列。进化树分析显示ClassⅣ几丁质酶基因从原祖序列分化可能发生在单子叶和双子叶植物分化之前,与ClassⅠ和ClassⅡ几丁质酶基因同源关系较远。而蜡梅ClassⅠb几丁质酶与葡萄和鳄梨ClassⅠa几丁质酶作为1个独立的分支出现,是否形成ClassⅠ几丁质酶的1个新亚型还有待进一步研究。
一般认为,表达水平过高是包涵体形成的原因之一(Baneyx,1999), 在本研究中,通过降低诱导温度可降低目的蛋白的表达量,但同时并不会促使产生可溶性目的蛋白。包涵体中杂蛋白含量较低,且只需要超声破碎和离心就可以与可溶性蛋白分离,有利于分离纯化。本研究在纯化时先用溶菌酶破碎细菌的细胞膜,再结合超声破碎方法,显著提高了包涵体的纯度和回收率。利用8 mol·L-1尿素缓冲液将包涵体变性溶解,然后通过透析复性,得到浓度和纯度较高的重组蛋白。几丁质酶活性检测证实复性后的目的蛋白具有一定的活性,温度梯度试验显示该酶在低温下同样具有较高的活性,这一点很值得关注。Yeh等(2000)在经过冷驯化的冬黑麦中发现低温诱导2种抗冻蛋白与几丁质酶CHT9、CHT46具有很高的同源性,区别只在于少量的化学修饰,推测是基因复制的结果。蜡梅花具有在腊月寒冬开花的特性,有很高的耐寒性。本试验获得的蜡梅几丁质酶基因Cpchia是否与体内抗冻机制有关,尚需进一步深入研究,其结果对揭示蜡梅花的抗冻机制、丰富几丁质酶的多抗性研究具有重要意义。
董娜, 张增艳, 辛志勇. 2008. 病原诱导的小麦ERF转录因子TaERF1b的原核表达及纯化[J]. 植物遗传资源学报, 9(3): 283-287. |
范艳华. 2006. 球孢白僵菌降解寄主体壁的几丁质酶和蛋白酶的分子改良. 西南大学博士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10635-2006150788.htm
|
秦华, 眭顺照, 李名扬, 等. 2006. 蜡梅(Chimonanthus praecox(L.)Link) COR413蛋白基因(Cpcor413 pm1)的分子特性与表达分析[J]. 中国生物化学与分子生物学报, 22(7): 547-552. DOI:10.3969/j.issn.1007-7626.2006.07.006 |
眭顺照, 李名扬, 蒋安, 等. 2007. 蜡梅花cDNA文库构建及其高频出现脂转移蛋白cDNA的表达[J]. 中国农业科学, 40(3): 644-648. DOI:10.3321/j.issn:0578-1752.2007.03.031 |
赵晓芳, 王贵禧, 王艳娜, 等. 2008. 鸭梨果实接种轮纹病菌后的生长期、贮藏期几丁质酶和β-1, 3葡聚糖酶活性变化[J]. 林业科学, 44(3): 162-165. DOI:10.3321/j.issn:1001-7488.2008.03.030 |
Baneyx F. 1999. Recombinant protein expression in Escherichia coli[J]. Current Opinion in Biotechnology, 10: 411-421. DOI:10.1016/S0958-1669(99)00003-8 |
Boller J, Gehri A, Mauch F, et al. 1983. Chitinase in bean leaves: induction by ethylene, purification, properties, and possible function[J]. Planta, 157: 22. DOI:10.1007/BF00394536 |
Bradford M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Brogue K, Chet I, Holliday M, et al. 1991. Transgenic plants with enhanced resistance to the fungal pathogen Rhisoctonia solani[J]. Science, 254: 1194-1197. DOI:10.1126/science.254.5035.1194 |
Gao J, Bauer M W, Shockley K R, et al. 2003. Growth of hyperther mophilic archaeon Pyrococcus furiosus on chitin involves two family 18 chitinases[J]. Appl and Environ Microbiol, 69: 3119-3128. DOI:10.1128/AEM.69.6.3119-3128.2003 |
Hamel F, Boivin R, Tremblay C, et al. 1997. Structural and evolutionary relationships among chitinases of flowering plants[J]. J Mol Evol, 44(6): 614-624. DOI:10.1007/PL00006184 |
Hon W C, Griffith M, Mlynarz A, et al. 1995. Antifreeze proteins in winter rye are similar to pathogenesis-related proteins[J]. Plant Physiol, 109: 879-889. DOI:10.1104/pp.109.3.879 |
Hunag Z, White D G, Pyane G A. 1997. Corn seed proteins inhibitory to Aspergil lusflavus and aflatoxin biosynthesis[J]. Phytopathology, 87(6): 622-627. DOI:10.1094/PHYTO.1997.87.6.622 |
Kikuchi T, Masuda K. 2009. Class Ⅱ chitinase accumulated in the bark tissue involves with the cold hardiness of shoot stems in highbush blueberry (Vaccinium corymbosum L)[J]. Scientia Horticulturae, 120: 230-236. DOI:10.1016/j.scienta.2008.11.007 |
Pasonen H L, Seppanen S K, Degefu Y, et al. 2004. Field performance of chitinase transgenic silver birches (Betula pendula): resistance to fungal diseases[J]. Theor Appl Genet, 109: 562-570. DOI:10.1007/s00122-004-1650-8 |
Thamthiankul S, Suan-Ngay S, Tantimavanich S, et al. 2001. Chitinase from Bacillus thuringiensis subsp. pakistani[J]. Appl Biochem Bioteehnol, 56: 395-401. |
Watanabe T, Kanai R, Kawase T, et al. 1999. Family 19 chitinase of Streptomyces species:characterization and distribution[J]. Microbiology, 145: 3353-3363. DOI:10.1099/00221287-145-12-3353 |
Yeh S, Moffatt B A, Griffith M, et al. 2000. Chitinase genes responsive to cold encode antifreeze proteins in winter cereals[J]. Plant Physiol, 124(3): 1251-1264. DOI:10.1104/pp.124.3.1251 |
 2009, Vol. 45
2009, Vol. 45

