文章信息
- 王洁华, 卢孟柱.
- Wang Jiehua, Lu Mengzhu
- 木本植物次生维管系统形态建成的基因调控与信号转导研究进展
- Progress in Study on the Gene Regulation and the Signal Transduction in the Morphogenesis of Secondary Vascular System in Woody Plants
- 林业科学, 2009, 45(11): 127-134.
- Scientia Silvae Sinicae, 2009, 45(11): 127-134.
-
文章历史
- 收稿日期:2009-05-12
-
作者相关文章
2. 中国林业科学研究院林业研究所 国家林业局林木培育重点实验室 北京 100091
2. Key Laboratory of Tree Breeding and Cultivation of State Forestry Administration Research Institute of Forestry, Chinese Academy of Forestry Beijing 100091
木材是木本植物通过次生生长所形成的木质化组织,是维管形成层近轴向产生的次生维管组织的统称。近几年,随着拟南芥(Arabidopsis thaliana)和杨树(Populus)全基因组测序的完成,以及先进研究手段的建立与成熟,人们对植物维管组织的建立与分化在分子水平上有了进一步的认识。例如冰冻切片技术可以获得大量的、处于维管发育不同时期的、具有相同分化特异性的细胞群体,极大地推动了人们对于维管系统发育过程中基因表达的时空特异性的理解和认识(Schrader et al., 2004);百日草(Zinnia elegans)叶肉细胞的原生质体可以被植物激素等诱导分化为木质细胞后,这种可控的分化体系分离出了决定木质部分化的重要信号分子木质形成素xylogen (Motose et al., 2004);而利用正反向遗传学分析手段对拟南芥突变体进行研究则发现了对维管组织极性排列有决定作用的转录因子HD-ZIPⅢ基因家族等。本文围绕着草本模式植物——拟南芥和木本模式植物——杨树,对近年来有关维管组织形态建成的信号机制与基因调控的研究进展作一个简单的概括,同时侧重于对比2种模式物种之间及不同分生组织之间的异同。
1 植物维管组织的功能与形成高等植物内的木质部和韧皮部的主要细胞形态呈管状结构,因此又将它们称为维管组织(图 1)。维管组织的出现是植物由水生到陆生进化的标志,具有维管组织的蕨类植物和种子植物常被称为维管植物。除去支撑功能以外,维管组织在植物体内主要起着输导作用,其中韧皮部负责对参与植物生长发育及生物抗性等生理活动的碳水化合物、蛋白及mRNA的转运。木质部则负责水分及矿物质从根到叶的运输以及多种植物激素在植物体内的运送。

|
图 1 6月龄杨树茎的次生维管组织(Baucher et al., 2007) Figure 1 Cross-section of a 6-month-old aspen stem showing the organization of the secondary vascular tissues(Baucher et al., 2007) 形成层由1层或多层纺锤母细胞和射线母细胞组成。f.木质纤维Xylem fibre; r.射线薄壁细胞Parenchymatous ray; v.导管Vessel. Scale bar = 100 μm. The term cambium refers to one or several layers of initial cells composed of fusiform and ray initials. |
虽然在结构和功能上,韧皮部和木质部的不同细胞类型之间存在着很大的差异,但在发育上它们都来自于同一个初生分生组织即原形成层(procambium)。原形成层向内生成初生木质部,向外生成初生韧皮部,丧失分生能力。初生木质部和初生韧皮部紧密结合在一起,共同组成的束状结构称为初生维管束。初生维管束围绕髓成一圆圈,但不连接。待束间薄壁细胞恢复分生能力后,所形成的束间形成层与束中形成层共同构成形成层。形成层属次生分生组织,为细胞分裂活跃的生长层。形成层具有较低的分生能力,向内生成次生木质部,向外生成次生韧皮部。树干的径向生长就是由于形成层的细胞分裂而引起的。树木的次生生长决定着木材的产量,因而具有重要的经济价值。
2 维管形成层的细胞类型及在形成层具有特异性表达的基因维管形成层的活动直接决定着植物次生维管组织的形成、形成层自身分生活性的保持,以及不同细胞类型之间的信号传导、树干的径向生长等重要生理过程(Savidge, 2001)。维管形成层通常含有2种形态特征不同的原始细胞:纺锤状原始细胞和大致等径的射线原始细胞。纺锤状原始细胞向内产生次生木质部,向外产生次生韧皮部,两者组成纵向的输导系统。射线原始细胞产生薄壁细胞,形成的维管射线组成横向的输导系统,亦与营养物质的贮藏有关(Iqbal et al., 1990)。长期以来,人们对于寻找那些具有形成层特异性表达的基因始终怀有浓厚兴趣,因为这些基因的表达与调控被认为直接决定着形成层原始细胞的不同分化方向,从而产生次生维管组织内的细胞特异性。例如,射线负责着韧皮部和木质部之间的营养传送及信号传递,因而决定着植物的次生生长(van Raemdonck et al., 2005)。山杨(Populus davidiana)中1个编码RING-H2蛋白的基因(PtaRHE1)在射线原始细胞里及其后代薄壁细胞里均有表达,但是不在纺锤状原始细胞及其分化细胞里表达。这表明PtaRHE1基因可能具有决定或(及)维持形成层内特定细胞类型的作用(van Raemdonck et al., 2005)。值得一提的是,当拟南芥在短日照下生长时,下胚轴里虽然会出现次生维管组织,但其中缺乏射线细胞(Chaffey et al., 2002),这说明不同物种的维管组织发育过程存在着重大差异。
目前由于缺乏能够清楚区分形成层原始细胞与它所形成的木质母细胞和韧皮母细胞的结构解剖学指标,因此尽管它们在各自的细胞壁组成(Catesson et al., 1994)、超显微结构(Arend et al., 2003),以及转录图谱(Schrader et al., 2004)上均有明显差异,这3类细胞所处的位置仍被统称为形成层区域(Samuels et al., 2006)。近年来,杨树形成层区域的组织特异性转录图谱(Schrader et al., 2004)以及次生维管系统不同发育阶段的转录图谱和蛋白质图谱分别构建成功(Du et al., 2006; Prassinos et al., 2005; van Raemdonck et al., 2005),从而可以更容易地分离在特定维管组织中表达的基因。另外,基因陷阱和增强子陷阱标记技术也被证明是寻找和鉴定在形成层区域(Johansson et al., 2003)或在次生维管组织中特异表达基因的有效手段(Groover et al., 2004)。
3 负责建立木质部和韧皮部细胞极性的关键基因木质部和韧皮部在维管束中呈极性排列,即它们分别位于维管束的近轴及远轴。这种极性的建立在拟南芥内被认为依赖于2个基因家族的互相拮抗(图 2)。一是HD-ZIPⅢ (class Ⅲ homeodomain-leucine zipper)转录因子家族,包括PHB (PHABULOSA/ATHB14)、REV (REVOLUTA)、PHV (PHAVOLUTA/ATHB9)、ATHB15 (CORONA)和AtHB8五个基因。HD-ZIPⅢ基因的表达受到miRNA165/166的负调控,miRNA165在拟南芥中的过量表达可以降低HD-ZIP Ⅲ基因家族所有成员的转录水平(Zhou et al., 2007)。二是包括KAN1-3在内的KANADI GARP转录因子家族。拟南芥HD-ZIPⅢ和KAN1-3基因突变体具有类似的表型,即拟南芥中初生木质部和初生韧皮部发生易位效应(Emery et al., 2003; Eshed et al., 2001; Juarez et al., 2004; McHale et al., 2004; Zhong et al., 2004)。基因敲除试验证明当PHB、PHV和REV 3个基因位点突变后,miRNA失去对其表达位置应有的控制,导致近轴的基因表达区域扩大(Emery et al., 2003; Zhong et al., 2004)。而KANADI可能通过调节miRNA165/166来实现对HD-ZIPⅢ表达的负调控(Bowman, 2004)。或者不借助miRNA,以未知的途径独立调节HD-ZIPⅢ基因的表达。最近分离到的ZPR (LITTLE ZIPPER)编码产物可以和REV蛋白之间形成异源二聚体,从而阻止REV与DNA目的序列的结合(Wenkel et al., 2007),使其无法行使转录调节功能,这也许是第3种调节HD-ZIPⅢ转录因子活性的模式。
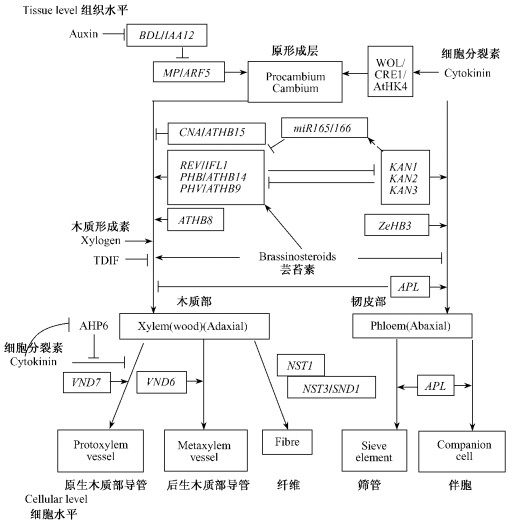
|
图 2 转录因子及信号分子在组织和细胞水平上调控木质部及韧皮部的形成(Demura et al., 2007) Figure 2 Multiple transcriptional factors and signaling molecules control the formation of xylem and phloem at the tissue and cellular levels (Demura et al., 2007) |
mRNA原位杂交结果显示,HD-ZIPⅢ基因家族的5个成员在维管组织中都有表达,其中尤以ATHB15和ATHB8两个基因在维管组织中的表达最为明显(Prigge et al., 2005)。试验表明不同的HD-ZIPⅢ转录因子在维管发育中所起的作用是不同的。例如,当拟南芥过量表达1个不被miRNA166剪切降解的ATHB15突变cDNA时,次生分化减弱,木质化组织比例相对缩小,维管束数目减少(Kim et al., 2005),说明ATHB15可能对木质部生成起着负调控作用。而ATHB8的过量表达则导致拟南芥木质部的合成增加(Baima et al., 2001), 由此可见,ATHB15和ATHB8两个基因可能在控制木质部发育的过程中具有相反的调节作用。
在山杨的形成层区域,HD-ZIPⅢ基因家族成员同样具有不同的组织表达特异性(Ko et al., 2006; Schrader et al., 2004)。其中PHV、PttHB9、PttHB15和PttHB8在形成层区域的木质部一侧相对韧皮部一侧基因表达水平较高(Hertzberg et al., 2001; Schrader et al., 2004)。在欧洲山杨和银白杨的杂交后代(Populus tremula × P. alba)中,REV同源基因PtaHB1在茎进入次生生长时表达上调,并且倾向于积累在形成层区域的木质部一侧(Ko et al., 2006)。由于杨属植物上述HD-ZIPⅢ基因的表达方式与各自的同源基因在拟南芥中的表达方式大致相同(Ko et al., 2004a; 2004b;Oh et al., 2003; Zhao et al., 2005),提示着拟南芥和杨树可能具有类似的、决定形成层分化和初生维管组织极性排列的分子机制。更为重要的是,在杨树中发现PtaHB1的转录水平与Pta-miR166的转录水平呈现负相关(Ko et al., 2006),为上述论点提供了新的支持。
4 维管形成层及茎端分生组织具有类似的干细胞分化机制维管形成层具有3方面基本的功能:维持干细胞的活性;防止过早的细胞分化;对组织和器官分化的正常启动(Baurle et al., 2003)。WUSCHEL (WUS)和CLAVATA (CLV)是拟南芥茎端分生组织中控制干细胞活性及分生能力的关键因素。WUS编码一个同源异型结构域转录因子,对干细胞的分化具有决定作用(Mayer et al., 1998)。拟南芥wus突变体中,由于干细胞的提早分化,茎端分生组织虽然可以形成但无法维系(Laux et al., 1996)。而CLV1-3中的任何1个基因发生突变后,会导致干细胞数目增多、分生组织膨大等,与wus突变体相反的表型(Clark et al., 1993; 1995; Kayes et al., 1998)。CLVs和WUS之间的信号传递目前还没有被完全了解,但初步认为CLV3作为1个配基,激活CLV1/CLV2受体复合物,限制WUS的表达(Brand et al., 2000; Schoof et al., 2000)。最近,1个WUS的同源基因WOX5被证明对于维持根尖分生组织的干细胞活性具有重要作用(Sarkar et al., 2007),这说明不同类型的分生组织有可能采取类似的分子机制控制干细胞的分化。
HD-ZIP Ⅲ基因家族在拟南芥茎端分生组织(SAM)的建立中也具有关键作用(Green et al., 2005; McHale et al., 2004; Otsuga et al., 2001),这突出表现在拟南芥rev phb双突变体(Prigge et al., 2005)和rev phb phv三突变体(Emery et al., 2003)均缺少功能性的茎端分生组织。同时,HD-ZIP Ⅲ基因家族成员PHV, PHB和ATHB15 (CNA)可以通过下调WUS转录,来限制茎端分生组织的活性,从而以平行的方式同CLV基因途径共同调节着分生组织的细胞分化潜能(Green et al., 2005)。在维管形成层里,HD-ZIP Ⅲ基因也可能参与维管形成层分生组织的活性保持及分化调控。例如,在拟南芥维管束分化过程中,ATHB15启动子引导的GUS蛋白表达始终与未分化的原形成层位置完全吻合(Fisher et al., 2007)。另外,拟南芥里1个类似于CLV1的受体激酶PXY最近被分离,pxy突变不但使原形成层细胞在分裂时丧失方向性,同时减少维管束中的分化的木质部细胞和韧皮部细胞,而保留更多的未分化的原形成层细胞,因此,PXY对于维持原形成层的极性细胞分裂和正常分化活性是必需的(Fisher et al., 2007)。同时,与CLV3同属CLE多肽蛋白家族的CLE41/44和CLE42也被证明具有促进原形成层细胞维持或(及)增殖的作用,并且能够抑制原形成层细胞分化为导管分子(Ito et al., 2006)。与拟南芥相比,杨树中形成层区域与分生组织活性及分化有关的研究甚少,目前已知山杨中2个与WUS和CLV1相关的基因PttHB3和PttRLK3在维管形成层区域具有表达,且在木质部端的表达水平高于韧皮部端,这说明山杨的形成层区域或许也存在着1个类似于茎端分生组织的CLV-WUS的信号途径(Schrader et al., 2004)。
在拟南芥中维持干细胞活性的其他主要基因还包括STM基因(Barton et al., 1993)、BP (BREVIPEDICELLUS)基因(也称为KNAT1基因) (Byrne et al., 2002; Long et al., 1996),以及KNAT6基因(Belles-Boix et al., 2006)。3个基因所编码的蛋白都属于KNOX家族。STM是植株胚胎发育过程中最早表达的基因之一,主要在茎端分生组织的中心区域表达, 对于保证其正常的大小起着关键作用(Kim et al., 2003)。拟南芥stm突变体不能够建立茎端分生组织,即使建立后茎端分生组织中未分化细胞数量也会减少,这说明STM具有建立和维持茎端分生组织的双重作用(Barton et al., 1993; Endrizzi et al., 1996; Long et al., 1996)。BP具有与STM部分重叠的功能,它和KNAT6均被证实参与着STM维持茎端分生组织的作用(Belles-Boix et al., 2006; Byrne et al., 2002)。另外,BP还具有调控细胞壁成分木质素的生物合成与沉积过程的作用(Mele et al., 2003)。杨树中STM同源基因PttSTM(Schrader et al., 2004)和PttARK1(Groover et al., 2006)在茎端及维管形成区的表达说明后者可能利用类似于茎端分生组织里的调控机制来维持干细胞活性及防止细胞提前分化。当STM在拟南芥中和ARK1在杨树中分别过量表达时,都会在初生生长阶段产生易位的分生组织,并且具有生长过度、外观高度分支的丛状表型(Groover et al., 2006)。此外,35S::STM和35S::ARK1植株茎的直径较细,与野生型相比,次生生长被推迟。在6月龄的杨树中,木质素化的次生木质部虽然也会在茎的下端形成连续的圆形,但形成层和次生木质部的界线与野生型相比变得起伏不平,而且几乎没有木质素化的韧皮纤维(Groover et al., 2006)。对ARK1过量表达的转基因杨树进行转录分析表明,在表达水平上调的基因中,42%基因的功能涉及到细胞外基质的交联(Groover et al., 2006)。与STM同属KNOX家族的杨树PttKNOX1, PttKNOX2, PttKNOX6在茎端分生组织和维管形成层区域均有高表达,且韧皮部一侧比木质部一侧表达水平又略高(Schrader et al., 2004)。这些数据表明在杨树维管形成层内,可能存在有一个和茎端分生组织类似的,通过STM对其他基因的抑制,实现对分生组织的活性进行有效调控的模式。
5 维管组织发育中的激素调控网络拟南芥维管组织的发育过程除受到上述重要遗传因素的调节控制外,植物激素信号的整合对于形成层和维管组织的正确布局及其连贯性的保持也具有同等重要的作用。生长素很早就被认为是通过极性运输(PAT)参与了维管组织发育的调控。外源或内源生长素是形成层生长的重要调节者, 也是木质部和韧皮部分化的关键信号。植物茎尖、幼嫩叶片合成的生长素沿着主茎向茎基部连续性地极性运输, 确保了维管组织的连续分化(Tuominen et al., 1997; Uggla et al., 1998)。另外,在杨树次生维管组织内具有一个生长素的浓度梯度,在形成区达到最大值(Tuominen et al., 1997; Uggla et al., 1996)。PAT(polar auxin transport)对原形成层和维管组织的形态建立具有关键作用(Mattsson et al., 2003; Scarpella et al., 2004)。在拟南芥中,如果对重要的PAT基因PIN1(PIN-FORMED)进行突变(Koizumi et al., 2000)、通过化学方法抑制PAT(Mattsson et al., 1999),或者在植物体内过量生成生长素(Uggla et al., 1996),都将导致拟南芥维管系统的分化发生大的改变,例如维管组织局部增生,维管束不再形成连续结构等,由此充分说明了PAT所维持的生长素梯度对于保证维管组织在正确的位点分化非常重要。目前,杨树的生长素外运蛋白PttPIN1和PttPIN2被定位于杨树的维管形成层,说明形成层是生长素极性运输的主要位点,也很可能是形成层维持高生长素浓度的原因之一。
细胞分裂素对于形成层活性的影响,通过转基因方法最近在杨树中得到了进一步的直接验证(Nieminen et al., 2008)。分裂状态下的形成层细胞具有细胞分裂素受体基因的最高表达水平。当利用细胞分裂素受体启动子控制细胞分裂素氧化酶基因转化杂交欧美山杨后,发现其内源细胞分裂素水平被降低,顶端及横向生长均减少,尤以后者为突出,外在表现为杨树的直径缩小,这一表型随后发现是由于形成层细胞层数减少造成的(Nieminen et al., 2008)。这说明细胞分裂素是维管形成层活动的主要调节者。
芸苔素对维管组织发育也起着重要作用。在芸苔素缺乏的拟南芥突变体中,维管束内的韧皮部增大,而木质部缩小,证实了芸苔素具有控制细胞分裂的作用,这种作用在韧皮部比在木质部表现得更为明显(Szekeres et al., 1996)。目前认为生长素和芸苔素同miRNA165/166一样,对HD-ZIPⅢ基因发挥正调控作用。在rev突变体中,极性生长素运输减少了70% (Zhong et al., 2001)。而在百日草中的研究发现,HD-ZIPⅢ基因的过量表达会导致芸苔素受体BRL3和LRR-RLK的表达上调,这说明HD-ZIPⅢ基因对芸苔素的信号传导具有正反馈的促进作用(Oh et al., 2003)。
值得注意的是,激素的作用是以相互交流影响的网络的形式存在的,每一种激素既不独立存在,所起的作用也不能被单独看待。例如最新研究表明在拟南芥根的早期胚胎发育过程中,干细胞的专一性依赖于生长素和细胞分裂素之间的相互对立关系(Muller et al., 2008),类似的作用关系是否也存在于维管组织发育的不同阶段是很值得探讨的。又如,脱落酸在杨树中控制着形成层的活性。当与生长素共同作用时,GAs对形成层分生活性的增强作用就会变得更加明显(Bjorklund et al., 2007)。当形成活性GA4 的限速酶GA20氧化酶在转基因山杨内组成型表达时,转基因植株呈现生长速度加快,高度增加,直径加粗的外在表型。除了GA之外,其他激素包括生长素、细胞分裂素以及乙烯,也都会影响次生木质部的发育。最新研究表明木材形成过程中,生长素可以诱导山杨维管组织内乙烯生物合成的基因表达(Nilsson et al., 2008)。这充分说明了激素之间的相互作用是维管系统生长发育过程中重要的调节方式。
6 维管系统研究的策略与展望综上所述,采用拟南芥突变体分析和杨树基因特异表达技术,在揭示维管系统形态建成过程中所涉及的基因及其调控等方面取得了一定的进展。例如,我们最近对于参与次生维管系统建立的主要基因进行了功能聚类分析,明确了主要的基因类型(Wang et al., 2009)。但相比于参与细胞壁组分,例如木质素(Boerjan et al., 2003)、纤维素(Somerville, 2006)和半纤维素(Farrokhi et al., 2006; Lerouxel et al., 2006)等的生物合成过程中的基因鉴定,维管系统发育的分子基础研究仍比较肤浅,特别是对于木本植物维管形成层的起始、维持及分化的分子决定机制方面还需要大量的研究工作。
维管形成层是次生维管系统发育的起始中心,其分生组织的维持、细胞的分化控制是研究重点之一。茎端分生组织和维管形成层细胞都涉及到干细胞的数量维持和分化,它们之间可能存在着重叠的信号传导及基因调控机制,但又具有各自的独特方式(Groover, 2005; Schrader et al., 2004)。一方面,茎端分生组织和维管形成层都要保持细胞分化潜能,即细胞分化的不确定性。试验证明包括STM、CLV1、KANADI以及HD-ZIP Ⅲ基因家族在内的基因在这2种分生组织内都有表达,且担负着重要的调控细胞分化的重要作用。而在茎端分生组织中表达并对其干细胞的活性维持具有重要作用的WUS和CLV3,也在形成层中检测到类似基因的表达(Schrader et al., 2004),这说明植物不同的分生组织之间存在着功能上的进化保守性。另一方面,营养生长的茎端分生组织为了保证花器官的形成,可以由营养分生组织彻底转变为花分生组织。相反,维管形成层的分生活性和细胞类型的不确定性状态是树木的多年生特点的保障。因此,精细分析上述基因从茎端分生组织过度到侧生分生组织的特异性表达,有助于揭示这些基因在分生组织的维持、细胞的分化控制上的功能及其所在的调控网络。
拟南芥和杨树在木质部发育调控机制上具有相似性,但杨树木质部的发育远比拟南芥复杂。因此在杨树上采用组织特异性抑制或超表达相关基因,才能明确它们在木质部形成、发育过程中的作用。预计未来几年,利用现有的维管系统转录组学研究成果,在全基因组范围内对候选基因进行筛选,才有可能找到那些决定维管形成层分生能力、分化特性及木质部发育的重要基因,实现人为调控次生维管系统发育过程,实现木材材性改良的最终目标。
Arend M, Fromm J. 2003. Ultrastructural changes in cambial cell derivatives during xylem differentiation in poplar[J]. Plant Biol, 5: 255-264. DOI:10.1055/s-2003-40796 |
Baima S, Possenti M, Matteucci A, et al. 2001. The Arabidopsis ATHB-8 HD-Zip protein acts as a differentiation-promoting transcription factor of the vascular meristems[J]. Plant Physiol, 126: 643-655. DOI:10.1104/pp.126.2.643 |
Barton M K, Poethig R S. 1993. Formation of the shoot apical meristem in Arabidopsis thaliana: an analysis of development in the wild type and in the shoot meristemless mutant[J]. Dev, 119: 823-831. |
Baucher M, EI Jaziri M, Vandeputte O. 2007. From primary to secondary growth: origin and development of the vascular system[J]. J Exp Bot, 58: 3485-3501. DOI:10.1093/jxb/erm185 |
Baurle I, Laux T. 2003. Apical meristems: the plant's fountain of youth[J]. BioEssays, 25: 961-970. DOI:10.1002/bies.10341 |
Belles-Boix E, Harmant O, Witiak S M, et al. 2006. KNAT6: an Arabidopsis homeobox gene involved in meristem activity and organ separation[J]. Plant Cell, 18: 1900-1907. DOI:10.1105/tpc.106.041988 |
Bjorklund S, Antti H, Uddestrand I, et al. 2007. Cross-talk between gibberellin and auxin in development of Populus wood: gibberellin stimulates polar auxin transport and has a common transcriptome with auxin[J]. Plant J, 52: 499-511. DOI:10.1111/j.1365-313X.2007.03250.x |
Boerjan W, Ralph J, Baucher M. 2003. Lignin biosynthesis[J]. Annu Rev Plant Biol, 54: 519-546. DOI:10.1146/annurev.arplant.54.031902.134938 |
Bowman J L. 2004. Class Ⅲ HD-Zip gene regulation, the golden fleece of ARGONAUTE activity?[J]. BioEssays, 26: 938-942. DOI:10.1002/(ISSN)1521-1878 |
Brand U, Fletcher J C, Hobe M, et al. 2000. Dependence of stem cell fate in Arabidopsis on a feedback loop regulated by CLV3 activity[J]. Science, 289: 617-619. DOI:10.1126/science.289.5479.617 |
Byrne M E, Simorowoski J, Martienssen R A. 2002. ASYMMETRIC LEAVES1 reveals knox gene redundancy in Arabidopsis[J]. Dev, 129: 1957-1965. |
Catesson A M, Funada R, Robertbaby D, et al. 1994. Biochemical and cytochemical cell-wall changes across the cambial zone[J]. IAWA J, 15: 91-101. DOI:10.1163/22941932-90001347 |
Chaffey N E, Regan C S, Sundberg B. 2002. Secondary xylem development in Arabidopsis: a model for wood formation[J]. Physiol Plant, 114: 594-600. DOI:10.1034/j.1399-3054.2002.1140413.x |
Clark S E, Running M P, Meyerowitz E M. 1993. CLAVATA1, a regulator of meristem and flower development in Arabidopsis[J]. Dev, 119: 397-418. |
Clark S E, Running M P, Meyerowitz E M. 1995. CLAVATA3 is a specific regulator of shoot and floral meristem development affecting the same process as CLAVATA1[J]. Dev, 121: 2057-2067. |
Demura T, Fukuda H. 2007. Transcriptional regulation in wood formation[J]. Trends Plant Sci, 12: 64-70. |
Du J, Xie H L, Zhang D O, et al. 2006. Regeneration of the secondary vascular system in poplar as a novel system to investigate gene expression by a proteomic approach[J]. Proteomics, 6: 881-895. DOI:10.1002/(ISSN)1615-9861 |
Emery J F, Floyd S K, Alvarez J, et al. 2003. Radial patterning of Arabidopsis shoots by class Ⅲ HD-ZIP and KANADI genes[J]. Curr Biol, 13: 1768-1774. DOI:10.1016/j.cub.2003.09.035 |
Endrizzi K B, Moussian A, Haecker J Z, et al. 1996. The SHOOT MERISTEMLESS gene is required for maintenance of undifferentiated cells in Arabidopsis shoot and floral meristems and acts at a different regulatory level than the meristem genes WUSCHEL and ZWILLE[J]. Plant J, 10: 967-979. DOI:10.1046/j.1365-313X.1996.10060967.x |
Eshed Y, Baum S F, Perea J V, et al. 2001. Establishment of polarity in lateral organs of plants[J]. Curr Biol, 11: 1251-1260. DOI:10.1016/S0960-9822(01)00392-X |
Farrokhi N, Burton R A, Brownfield J, et al. 2006. Plant cell wall biosynthesis: genetic, biochemical and functional genomics approaches to the identification of key genes[J]. Plant Biotech J, 4: 145-167. DOI:10.1111/pbi.2006.4.issue-2 |
Fisher K, Turner S. 2007. PXY, a receptor-like kinase essential for maintaining polarity during plant vascular-tissue development[J]. Curr Biol, 12: 1061-1066. |
Green K A, Prigge M J, Katzman R B, et al. 2005. CORONA, a member of the class Ⅲ homeodomain leucine zipper gene family in Arabidopsis, regulates stem cell specification and organogenesis[J]. Plant Cell, 17: 691-704. DOI:10.1105/tpc.104.026179 |
Groover A, Fontana J R, Dupper G, et al. 2004. Gene and enhancer trap tagging of vascular-expressed genes in poplar trees[J]. Plant Physiol, 134: 1742-1751. DOI:10.1104/pp.103.034330 |
Groover A T. 2005. What genes make a tree a tree?[J]. Trends Plant Sci, 10: 210-214. DOI:10.1016/j.tplants.2005.03.001 |
Groover A T, Mansfield S D, DiFazio S P, et al. 2006. The Populus homeobox gene ARBORKNOX1 reveals overlapping mechanisms regulating the shoot apical meristem and the vascular cambium[J]. Plant Mol Biol, 61: 917-932. DOI:10.1007/s11103-006-0059-y |
Hertzberg M, Aspeborg H, Schrader J, et al. 2001. A transcriptional roadmap to wood formation[J]. Proc Natl Acad Sci U S A, 98: 14732-14737. DOI:10.1073/pnas.261293398 |
Iqbal M, Ghouse A H M. 1990. Cambial concept and organisation//Iqbal M. The Vascular Cambium (Research Studies in Botany and Related Applied Fields: vol. 7). Research Studies Press, Taunton, USA: 1-36.
|
Ito Y, Nakanomyo I, Motose H, et al. 2006. Dodeca-CLE peptides as suppressors of plant stem cell differentiation[J]. Science, 313: 842-845. DOI:10.1126/science.1128436 |
Johansson A M, Wang C, Stenberg A, et al. 2003. Characterization of a PttRPS18 promoter active in the vascular cambium region of hybrid aspen[J]. Plant Mol Biol, 52: 317-329. DOI:10.1023/A:1023919331037 |
Juarez M T, Kui J S, Thomas J, et al. 2004. MicroRNA-mediated repression of rolled leaf1 specifies maize leaf polarity[J]. Nature, 428: 84-88. DOI:10.1038/nature02363 |
Kayes J M, Clark S E. 1998. CLAVATA2, a regulator of meristem and organ development in Arabidopsis[J]. Dev, 125: 3843-3851. |
Kim J, Jung J H, Reyes J L, et al. 2005. microRNA-directed cleavage of ATHB15 mRNA regulates vascular development in Arabidopsis inflorescence stems[J]. Plant J, 42: 84-94. DOI:10.1111/tpj.2005.42.issue-1 |
Kim J Y, Yuan Z, Jackson D. 2003. Developmental regulation and significance of KNOX protein trafficking in Arabidopsis[J]. Dev, 130: 4351-4362. DOI:10.1242/dev.00618 |
Ko J H, Han K H. 2004a. Arabidopsis whole-transcriptome profiling defines the features of coordinated regulations that occur during secondary growth[J]. Plant Mol Biol, 55: 433-453. DOI:10.1007/s11103-004-1051-z |
Ko J H, Han K H, Park S, et al. 2004b. Plant body weight induced secondary growth in Arabidopsis and its transcription phenotype revealed by whole-transcriptome profiling[J]. Plant Physio, 135: 1069-1083. DOI:10.1104/pp.104.038844 |
Ko J H, Prassinos C, Han K H. 2006. Developmental and seasonal expression of PtaHB1, a Populus gene encoding a class Ⅲ HD-Zip protein, is closely associated with secondary growth and inversely correlated with the level of microRNA (miR166)[J]. New Phytol, 169: 469-478. DOI:10.1111/nph.2006.169.issue-3 |
Koizumi K, Sugiyama M, Fukuda H. 2000. A series of novel mutants of Arabidopsis thaliana that are defective in the formation of continuous vascular network: calling the auxin signal flow canalization hypothesis into question[J]. Dev, 127: 3197-3204. |
Laux T, Mayer K F X, Berger J, et al. 1996. The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis[J]. Dev, 122: 87-96. |
Lerouxel O, Cavalier D M, Liepman A H, et al. 2006. Biosynthesis of plant cell wall polysaccharides: a complex process[J]. Curr Opin Plant Biol, 9: 621-630. DOI:10.1016/j.pbi.2006.09.009 |
Long J A, Moan E I, Medford J I, et al. 1996. A member of the KNOTTED class of homeodomain proteins encoded by the STM gene of Arabidopsis[J]. Nature, 379: 66-69. DOI:10.1038/379066a0 |
Mattsson J, Sun Z R, Berleth T. 1999. Responses of plant vascular systems to auxin transport inhibition[J]. Dev, 126: 2979-2991. |
Mattsson J, Ckurshumova W, Berleth T. 2003. Auxin signaling in Arabidopsis leaf vascular development[J]. Plant Physio, 131: 1327-1339. DOI:10.1104/pp.013623 |
Mayer K F X, Schoof H, Haecker A, et al. 1998. Role of WUSCHEL in regulating stem celAl fate in the Arabidopsis shoot meristem[J]. Cell, 95: 805-815. DOI:10.1016/S0092-8674(00)81703-1 |
McHale N A, Koning R E. 2004. MicroRNA-directed cleavage of Nicotiana sylvestris PHAVOLUTA mRNA regulates the vascular cambium and structure of apical meristems[J]. Plant Cell, 16: 1730-1740. DOI:10.1105/tpc.021816 |
Mele G, Ori N, Sato Y, et al. 2003. The knotted1-like homeobox gene BREVIPEDICELLUS regulates cell differentiation by modulating metabolic pathways[J]. Genes Dev, 17: 2088-2093. DOI:10.1101/gad.1120003 |
Motose H, Sugiyama M, Fukuda H. 2004. A proteoglycan mediates inductive interaction during plant vascular development[J]. Nature, 429: 873-878. DOI:10.1038/nature02613 |
Muller B, Sheen J. 2008. Cytokinin and auxin interaction in root stem-cell specification during early embryogenesis[J]. Nature, 453: 1094-1097. DOI:10.1038/nature06943 |
Nieminen K, Immanen J, Laxell M, et al. 2008. Cytokinin signaling regulates cambial development in poplar[J]. Proc Natl Acad Sci U S A, 105: 20032-20037. DOI:10.1073/pnas.0805617106 |
Nilsson J, Karlberg A, Antti A, et al. 2008. Dissecting the molecular basis of the regulation of wood formation by auxin in hybrid aspen[J]. Plant Cell, 20: 843-855. DOI:10.1105/tpc.107.055798 |
Oh S, Park S, Han K H. 2003. Transcriptional regulation of secondary growth in Arabidopsis thaliana[J]. J Exp Bot, 54: 2709-2722. DOI:10.1093/jxb/erg304 |
Otsuga D, DeGuzman B, Prigge M J, et al. 2001. REVOLUTA regulates meristem initiation at lateral positions[J]. Plant J, 25: 223-236. DOI:10.1046/j.1365-313x.2001.00959.x |
Prassinos C, Ko J H, Yang J, et al. 2005. Transcriptome profiling of vertical stem segments provides insights into the genetic regulation of secondary growth in hybrid aspen trees[J]. Plant Cell Physiol, 46: 1213-1225. DOI:10.1093/pcp/pci130 |
Prigge M J, Otsuga D, Alonso J M, et al. 2005. Class Ⅲ homeodomain-leucine zipper gene family members have overlapping, antagonistic, and distinct roles in Arabidopsis development[J]. Plant Cell, 17: 61-76. DOI:10.1105/tpc.104.026161 |
Samuels A L, Kaneda M, Rensing K H. 2006. The cell biology of wood formation: from cambial divisions to mature secondary xylem[J]. Can J Bot, 84: 631-639. DOI:10.1139/b06-065 |
Sarkar A K, Luijten M, Miyashima S, et al. 2007. Conserved factors regulate signalling in Arabidopsis thaliana shoot and root stem cell organizers[J]. Nature, 446: 811-814. DOI:10.1038/nature05703 |
Savidge R A. 2001. Intrinsic regulation of cambial growth[J]. J Plant Growth Regul, 20: 52-77. DOI:10.1007/s003440010002 |
Scarpella E, Meijer A H. 2004. Pattern formation in the vascular system of monocot and dicot plant species[J]. New Phytol, 164: 209-242. DOI:10.1111/j.1469-8137.2004.01191.x |
Schoof H, Lenhard Z M, Haecker A, et al. 2000. The stem cell population of Arabidopsis shoot meristems is maintained by a regulatory loop between the CLAVATA and WUSCHEL genes[J]. Cell, 100: 635-644. DOI:10.1016/S0092-8674(00)80700-X |
Schrader J, Nilsson J, Mellerowicz E, et al. 2004. A high-resolution transcript profile across the wood-forming meristem of poplar identifies potential regulators of cambial stem cell identity[J]. Plant Cell, 16: 2278-2292. DOI:10.1105/tpc.104.024190 |
Somerville C. 2006. Cellulose synthesis in higher plants[J]. Annu Rev Cell Dev Biol, 22: 53-78. DOI:10.1146/annurev.cellbio.22.022206.160206 |
Szekeres M, Nemeth K, Koncz-Kalman Z, et al. 1996. Brassinosteroids rescue the deficiency of CYP90, a cytochrome P450, controlling cell elongation and de-etiolation in Arabidopsis[J]. Cell, 85: 171-182. DOI:10.1016/S0092-8674(00)81094-6 |
Tuominen H, Puech L, Fink S, et al. 1997. A radial concentration gradient of indole-3-acetic acid is related to secondary xylem development in hybrid aspen[J]. Plant Physiol, 115: 577-585. DOI:10.1104/pp.115.2.577 |
Uggla C, Mellerowicz E J, Sundberg B. 1998. Indole-3-acetic acid controls cambial growth in Scots pine by positional signaling[J]. Plant Physiol, 117: 113-121. DOI:10.1104/pp.117.1.113 |
Uggla C, Moritz T, Sandber G, et al. 1996. Auxin as a positional signal in pattern formation in plants[J]. Proc Natl Acad Sci USA, 93: 9282-9286. DOI:10.1073/pnas.93.17.9282 |
van Raemdonck D, Pesquet E, Cloquet S, et al. 2005. Molecular changes associated with the setting up of secondary growth in aspen[J]. J Exp Bot, 56: 2211-2227. DOI:10.1093/jxb/eri221 |
Wang M J, Qi X L, Zhao S T, et al. 2009. Dynamic changes in transcripts during regeneration of the secondary vascular system in Populus tomentosa Carr. revealed by cDNA microarrays[J]. BMC Genomics, 10: 215. DOI:10.1186/1471-2164-10-215 |
Wenkel S, Emery J, Hou B H, et al. 2007. A feedback regulatory module formed by LITTLE ZIPPER and HD-ZIPIII genes[J]. Plant Cell, 19: 3379-3390. DOI:10.1105/tpc.107.055772 |
Zhao C, Craig J C, Petzold H E, et al. 2005. The xylem and phloem transcriptomes from secondary tissues of the Arabidopsis root-hypocotyl[J]. Plant Physio, 138: 803-818. DOI:10.1104/pp.105.060202 |
Zhong R, Ye Z H. 2001. Alteration of auxin polar transport in the Arabidopsis ifl1 mutants[J]. Plant Physiol, 126: 549-563. DOI:10.1104/pp.126.2.549 |
Zhong R, Ye Z H. 2004. Amphivasal vascular bundle 1, a gain-of-function mutation of the IFL1/REV gene, is associated with alterations in the polarity of leaves, stems and carpels[J]. Plant Cell Physiol, 45: 368-385. |
Zhou G K, Kubo M, Zhong R, et al. 2007. Overexpression of miR165 affects apical meristem formation, organ polarity establishment and vascular development in Arabidopsis[J]. Plant Cell Physiol, 48: 391-404. DOI:10.1093/pcp/pcm008 |
 2009, Vol. 45
2009, Vol. 45

