文章信息
- 王小红, 郭起荣, 周祖基.
- Wang Xiaohong, Guo Qirong, Zhou Zuji
- 水竹和慈竹开花代谢关键因子主成分分析
- Principal Component Analysis on the Key Metabolism Factors for Bloom of Phyllostachys heteroclada and Neosinocalamus affinis
- 林业科学, 2009, 45(10): 158-162.
- Scientia Silvae Sinicae, 2009, 45(10): 158-162.
-
文章历史
- 收稿日期:2008-09-17
-
作者相关文章
2. 四川农业大学林学园艺学院 雅安 625014;
3. 国际竹藤网络中心 北京 100102
2. College of Forestry and Horticulture, Sichuan Agricultural University Ya'an 625014;
3. International Centre for Bamboo and Rattan Beijing 100102
开花是植物从营养生长向生殖生长的转换,是植物生存、繁衍和进化的途径。大多数植物开花需要经过某些特定条件的诱导,比如低温春化和光周期诱导(张云等,2003)。竹类植物是典型的多年生一次开花植物,目前还没有迹象表明竹子的开花与日照长度和低温诱导有关。但任何一种植物开花,必须是在经过一定的营养生长量,进入成花敏感状态并接受开花信号的刺激后才有可能(张学文等,2003),竹子开花也不例外。竹类植物是禾本科植物,但同时又是典型的多年生一次开花植物,具有比其他禾本科植物更长的幼年期和营养生长阶段,在长达几十年甚至上百年的生长周期中,营养生长向生殖生长的转变过程非常值得研究。目前的研究结果虽然已经表明竹类植物开花的根本原因是其既定的生长周期即内在基因遗传因素,但同种植物开花周期的较大差异却无法完全用周期论进行解释。所以,从内部代谢角度来筛选植物开花的关键代谢因子,探寻竹子开花的具体生理机制就具有非常重要的意义。
王小红(2007)、王小红等(2008)对影响水竹(Phyllostachys heteroclada)开花的外部环境因子进行了调查和分析,并对开花期间水竹、慈竹(Neosinocalamus affinis)叶片内激素和碳氮代谢相关物质进行了测定,发现了水竹和慈竹开花期间物质变化的一些规律。本文以开花初期水竹和慈竹碳氮代谢相关物质及激素含量测定结果为基础,利用统计分析软件对水竹和慈竹开花的关键代谢因子进行筛选,并在此基础上建立竹类植物开花进程模拟模型,希望能为竹类植物开花预测和控制提供一定的研究思路和理论基础。
1 试验地区概况和试验方法 1.1 试验地生境概况试验地设在四川省雅安市碧峰峡大熊猫繁育基地及其周边地区,该地区位于雅安市北16 km处。土壤以山地黄壤为主,兼有山地黄棕壤、红壤;属亚热带湿润性季风气候区,气候温和湿润,雨量充沛,年降雨量1 250~1 800 mm;年均气温10.1~16.8 ℃,全年无霜期240~280天,年日照时数约1 000 h。
试验选取碧峰峡景区内自然分布的开花与未开花竹林为研究对象。未开花水竹林面积约100 m2,坡度33°,海拔1 171~1 210 m,竹子生长状况良好,没有开花迹象;开花水竹林面积约120 m2,坡度30°,海拔1 140~1 190 m,2004年出现零星开花,2005年开花面积增至整个竹林面积的85%左右。开花慈竹林面积约200 m2,海拔1 060~1 100 m,于2005年3月出现零星开花,开花竹面积约占竹林总面积的10%左右。所有的采样均在这些样地内进行。
1.2 调查测定项目及方法1) 取样和处理 通过对试验区域水竹开花的长时间仔细观察,发现水竹开花存在着自然的开花逆转现象,即在植株已经出现少许花苞(一般在植株的上部出现)后,由于某种未知原因,植物停止开花并表现出良好的营养生长态势,这为深入研究水竹开花的内部机制提供了有利条件。于2005年10月开始至翌年5月,选择刚开花的当年生水竹和慈竹,已出现明显逆转并保持良好生长状态的开花逆转水竹,采集各枝条顶稍2~4轮叶,用保鲜袋包好后加冰块冷藏运至实验室处理。采回样品部分液氮冷冻后放入-70 ℃超低温冰箱保存做酶和内源激素的测定,其余部分105 ℃杀青后在75 ℃烘至恒质量用于可溶性糖、淀粉和蛋白质总量测定。
2) 测定项目和方法 可溶性糖和淀粉含量。称取0.1 g竹叶干样,用蒽酮比色法测定可溶性糖含量,提取可溶性糖后的残渣参照《植物生理实验手册》(上海市植物生理学会,1999)测定淀粉含量。
可溶性蛋白质含量。取1 g冷冻叶片在冰浴上研磨成匀浆离心后用考马斯亮蓝试剂盒(南京建成生物工程研究所生产)测蛋白质含量。
蛋白质总量。取0.2 g干样浓硫酸消煮后用凯氏定氮仪测定。
蔗糖酶活性测定。取1 g冷冻叶片在冰浴上研磨成匀浆离心后用蔗糖酶试剂盒(南京建成生物工程研究所生产)进行测定。在37 ℃、pH6.0条件下,每毫克蛋白组织每分钟水解1 nmol蔗糖定义为一个酶活性单位,单位为mg·g-1min-1。
淀粉酶活性。取1 g冷冻叶片在冰浴上研磨成匀浆离心后参照熊庆娥(2003)方法测定淀粉酶活性,单位为mg·g-1min-1。
谷胺酰胺合成酶(GS)活性。取1 g冷冻叶片在冰浴上研磨成匀浆离心后参照赵宏伟(2003)的方法,根据比色测定的OD值和蛋白质含量计算谷氨酰胺合成酶活性,单位为mg·g-1h-1。
内源激素含量测定。取冷冻叶片1 g,用2 mL纯甲醇浸提24 h,将头次浸提液倒出,再加2 mL纯甲醇浸提24 h,再加2 mL纯甲醇浸提12 h后倒出,将3次浸提液合并,取出叶片在冰浴上研磨成匀浆,用80%甲醇转移入15 mL离心管中,浸提12 h后离心4 500 r·min-1 5 min,倒出上清液,与所有浸提液一并倒入培养皿中在低温培养箱2 ℃下放干溶液至5 mL以下(需24 h),用80%甲醇润洗至10 mL离心管,离心5 000 r·min-1 5 min,取上清液过C18小柱转入10 mL容量瓶中用80%甲醇定容,摇匀后取1 mL于UP管中离心1 000 r·min-1 10 min,上清液倒入样品瓶中上液相色谱仪,分析仪器为美国产Agilent 1100 LC型高效液相色谱仪系统,dC18色谱柱为150 mol×4.6 mm,流动相为0.8%乙酸纯水和色谱甲醇,流速1.0 μL·min-1,柱温35 ℃,进样量10 μL,检测波长254 nm;梯度洗脱,刚开始和5 min时纯水与甲醇体积比7:3,12 min时1:1,16和20 min时2:8。
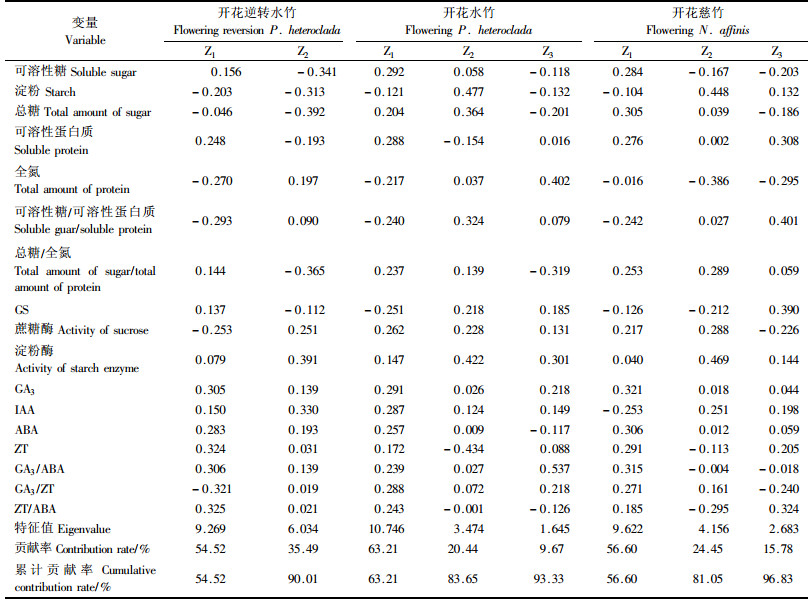
1.3 统计分析方法利用DPS统计分析软件对开花初期水竹和慈竹与代谢有关的指标进行主成分分析,根据累积贡献率≥85%的标准(郝日明等,2006),对主成分进行筛选,计算出相关矩阵的特征根和相应的特征向量以及特征根的累计贡献率,找出开花关键代谢因子。
2 结果与分析 2.1 水竹开花代谢关键因子主成分分析结果1) 开花水竹代谢物质主成分分析。对开花初期水竹17个代谢指标测定值进行主成分分析,前3个主成分的贡献率分别为63.21%,20.44%和9.67%,累计贡献率为93.33%。根据累积贡献率≥85%的标准,这3个主成分代表了水竹开花时期所测17个代谢指标的绝大部分相关信息,故选取作为综合指标。
开花水竹第1主成分在可溶性糖含量上有最大正载荷,表明水竹开花与可溶性糖含量的增加呈最大正相关;赤霉素GA3含量正载荷也较大,表明GA3对水竹开花同样呈正向作用。第2主成分在淀粉含量上有最大正载荷,特征值为3.474,贡献率为20.44%,表明水竹开花与淀粉含量的增加呈正相关;玉米素ZT含量具有较大负载荷,说明ZT含量增加与水竹开花呈负相关。第3主成分在赤霉素与脱落酸之比GA3/ABA上有最大的正载荷,其特征值为1.645,贡献率为9.67%,说明GA3/ABA增加与水竹开花呈正相关(表 1)。总体来看,可溶性糖、淀粉、GA3、ZT以及GA3/ABA与其他各代谢因子相比与水竹开花之间具有更明显的相关性,可溶性糖、淀粉、GA3和GA3/ABA表现为与开花呈正相关;而ZT则呈负相关。
|
|
2) 开花逆转水竹代谢物质主成分分析。对开花逆转水竹17个代谢指标测定值进行主成分分析,前2个主成分累计贡献率达到90.01%,具有分析价值。
开花逆转水竹第1主成分在ZT/ABA和ZT上有最大正载荷,特征值为9.269,贡献率为54.52%;在GA3/ZT有最大负载荷,且三者特征向量绝对值几乎相等,说明在水竹逆转过程中,玉米素ZT和ZT/ABA与开花逆转呈正相关,而GA3/ZT则为负相关,且三者作用的重要性几乎相等。第2主成分在总糖含量上有最大负载荷,特征值为6.034,贡献率为35.49%,其次是淀粉酶活性具有较大正载荷,说明开花逆转水竹具有较高的淀粉酶活性和较低的总糖含量。总的来说,ZT、ZT/ABA、淀粉酶含量与水竹开花逆转之间相关性明显,同时逆转过程伴随着总糖含量的降低。
2.2 慈竹开花代谢关键因子主成分分析结果对开花慈竹17个代谢指标测定值进行主成分分析,前3个主成分累计贡献率达到96.83%,具有分析价值。
开花慈竹第1主成分在GA3上有最大正载荷,特征值为9.622,贡献率为56.60%,其次是GA3/ABA,具有较大正载荷,说明赤霉素GA3和GA3/ABA对慈竹开花均有重要作用。第2主成分在淀粉酶活性上有最大正载荷,特征值为4.156,贡献率为24.45%,其次是淀粉含量,说明开花慈竹具有较高的淀粉酶活性和淀粉含量。第3主成分在可溶性糖/可溶性蛋白质上具有最大正载荷,特征值为2.683,贡献率为15.78,其次是GS酶活性具有较大正载荷,说明开花慈竹有较高的可溶性糖/可溶性蛋白,而较高的GS酶活性有利于慈竹开花(表 1)。对慈竹来说,GA3、GA3/ABA、淀粉、淀粉酶和GS酶活性与开花呈正向促进作用,可溶性糖/可溶性蛋白质则与慈竹开花成负向作用。
3 结论与讨论 3.1 水竹和慈竹开花代谢关键物质及其作用机制综合开花水竹和开花慈竹代谢物质主成分分析结果,可以肯定的是GA3,GA3/ABA,可溶性糖及淀粉是这2种竹子开花期间代谢的关键物质,其次是淀粉酶和GS酶活性,这些物质均与竹子开花呈正相关关系;而ZT对开花也有很重要的作用,但主要呈负相关。ZT、ZT/ABA、淀粉酶是开花逆转过程中代谢的重要物质。
对于水竹和慈竹开花开花期代谢关键物质的筛选结果和作用机制与很多学者的研究结果基本一致。Chailakhgan(1937)提出了开花素学说,他认为开花素是由赤霉素和成花素2种物质组成的复合物,缺少任何一种植物都不能开花;虽然经过半个多世纪的分离提取并未获得成功,但说明赤霉素在植物开花中的重要作用。经过多年的研究,虽然激素和激素平衡具体的作用机制在不同植物种类中有一定的差异,但对于其在植物开花过程中的重要作用已得到了大家的普遍认同(傅永福等,1998)。Sachs(1977)认为苹果(Malus pumila)花芽分化的主要条件是充足的营养和各种激素保持平衡;Plimmer(1977)提出激素的平衡变化可导致与成花有关的基因解除阻遏;孙文全(1989)、周学明等(1988)分析了细胞分裂素和赤霉素在花芽分化期的变化,均认为与成花有关的非芽组织中的“CTK/GA3”有高比值的倾向。以往的研究结果也表明碳水化合物对开花起重要作用。在光诱导条件下,茎、叶中贮藏的淀粉等碳水化合物转化为蔗糖,在茎端分生组织积累(张云等,2003)。Araki等(1993)通过试验证明在完全黑暗的条件下,对拟南芥(Arabidopsis thaliana)的地上部分施以蔗糖、葡萄糖后仍能开花;Roldan等(1997)也证明施用蔗糖能够绕过FRL,FLC对开花的抑制作用,也能加速fve,fpa,fca,gi等突变体的开花。
关于激素对成花的机制以及植物的开花过程,韩守金(2003)认为,植物成花并不是某种物质单独起作用的结果,而是多因子参与,多步骤控制,各物质进行一系列复杂作用,由量变到质变的过程。该过程中,营养是成花的基础,激素调节是成花的关键,基因表达是成花的途径。
根据测定和分析的结果再结合其他学者的研究成果,从植物生理代谢的角度可以初步阐述水竹和慈竹开花的基本原理:在经过一定时间的营养生长后,竹子生理已经成熟,具备了向生殖生长转变的可能,在外界不良环境因子(高温和干旱)的影响下,植物产生应激反应,首先是GA3,ABA,ZT等激素类物质含量发生变化,与此同时碳氮代谢发生相应的变化,淀粉含量升高,淀粉酶活性增强,对淀粉的分解作用增加,从而导致可溶性糖含量增加,在各物质的含量达到一定的程度并趋于平衡以后,植物完成花芽分化阶段,进入有性生殖即开花过程。而如果在花芽分化过程中有其他原因导致ZT含量和ZT/ABA发生较大大的变化,则可能会发生开花过程的逆转,促使竹子又恢复到营养生长阶段。
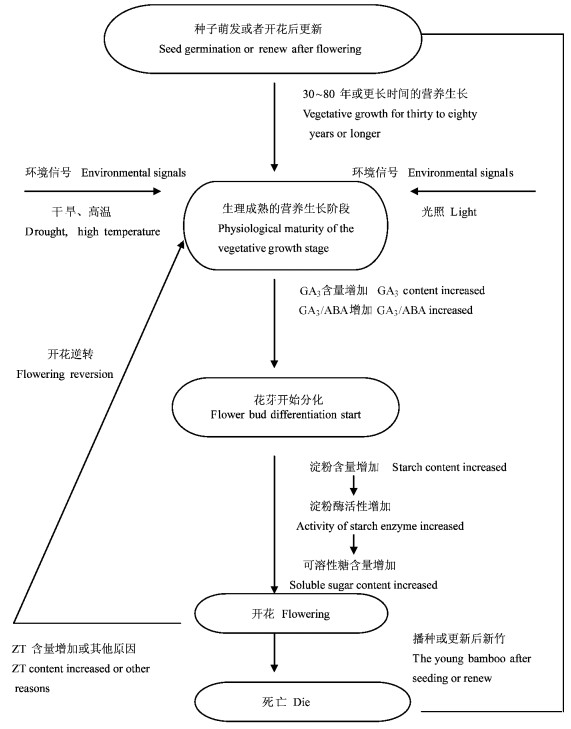
3.2 竹类植物开花过程初步模拟综合环境因素对水竹开花的影响、水竹和慈竹开花期间物质代谢规律以及开花初期水竹和慈竹代谢因子主成分分析结果,再结合高等植物开花基本理论和前人的研究结果,可以初步推断并构建竹子开花模型(图 1)。从图 1中可以看出,竹子从营养生长到生殖生长直至开花是一个比较漫长的过程,如果在此过程中任一环节被影响或打断均有可能加速或者停止生长和开花进程,而这也正是竹类植物开花具有更多变数的原因。当然,开花模型的构建非常简单,而且都是基于对生理代谢指标的分析。从目前植物开花研究的情况来看,如果能加上开花相关基因和开花信号物质传导的研究则会更准确反映竹类植物开花的详细机制。
|
图 1 竹子开花进程模拟 Figure 1 Simulating model of bamboo flowering |
傅永福, 孟繁静. 1998. 植物的成花生理信号[J]. 中国农业大学学报, 3(3): 1-11. DOI:10.3321/j.issn:1007-4333.1998.03.001 |
郝日明, 张璐, 张明娟, 等. 2006. 影响南京地区桂花秋季开花期变化的关键气候因子研究[J]. 植物资源与环境学报, 15(3): 31-34. DOI:10.3969/j.issn.1674-7895.2006.03.007 |
韩守金. 2003. 植物开花机理及调控研究进展[J]. 彭城职业大学学报, 18(2): 32-37. |
上海市植物生理学会. 1999. 植物生理实验手册[M]. 上海: 上海科技出版社.
|
孙文全. 1989. 植物激素分布、相互作用及平衡关系对果树花芽分化影响[J]. 北方园艺, 11(12): 43-47. |
王小红. 2007. 水竹和慈竹开花研究. 四川农业大学博士学位论文.
|
王小红, 周祖基. 2008. 水竹开花期间碳氮代谢特性[J]. 林业科学, 44(4): 35-40. |
熊庆娥. 2003. 植物生理学实验教程[M]. 成都: 四川科学技术出版社.
|
赵宏伟. 2003. 不同氮素营养水平下春玉米碳氮代谢机理的研究. 东北农业大学博士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10224-2004041489.htm
|
张云, 刘青林. 2003. 植物花发育的分子机理研究进展[J]. 植物学通报, 20(5): 589-601. DOI:10.3969/j.issn.1674-3466.2003.05.011 |
张学文, 洪亚辉, 赵燕. 2003. 植物开花时期的分子控制[J]. 湖南农业大学学报:自然科学版, 29(6): 523-527. |
周学明, 马焕普. 1988. 不同时期苹果花芽和叶芽中内源赤霉素、脱落酸和细胞分裂素活性的变化[J]. 中国农业科学, 21(3): 41-45. |
Araki T, Komeda Y. 1993. Flowering in darkness in Arabidopsis thaliana[J]. Plant J, 4: 801-811. DOI:10.1046/j.1365-313X.1993.04050801.x |
Chailakhyan M H. 1937. Concerning the hormonal nature of plant development process[J]. Compt Rend Acad Sci URSS, 16: 227-230. |
Plimmer J R. 1977. Pesticide chemistry in the 20's century: Asymposium. American Chemical Society.
|
Roldan M, Gomez-Mena, Ruiz-Trillo M, et al. 1997. Effect of darkness and sugar availability to the aper on morphogenesis and flowering time of Arabidopsis[J]. Flowering Newsl, 24: 18-24. |
Sachs R M. 1977. Nutrient diversion: an hypothesis to explain the chemical control of flowering[J]. Hort Science, 12: 220-222. |
 2009, Vol. 45
2009, Vol. 45