文章信息
- 翟晓巧, 程斐, 朱延林.
- Zhai Xiaoqiao, Cheng Fei, Zhu Yanlin
- 二乔刺槐愈伤组织超低温保存及适宜降温方法
- Methods of Lowering Temperature for Cryopreservation of Calli of Robinia bella-rosea
- 林业科学, 2009, 45(10): 49-54.
- Scientia Silvae Sinicae, 2009, 45(10): 49-54.
-
文章历史
- 收稿日期:2009-05-03
-
作者相关文章
2. 河南省林业科学研究院 郑州 450008
2. Henan Academy of Forestry Zhengzhou 450008
植物种质资源是植物物种进化和对其进行遗传育种研究的物质基础,但是由于自然和人为因素,植物种质资源流失与浪费问题十分严重,许多植物的栽培品种和野生资源正日益受到严重的破坏,一些珍稀植物已经灭绝或濒临灭绝,植物种质资源的保存已越来越受到关注。超低温保存被视为能够安全稳定、长期有效保存植物种质资源的方法(An et al., 2003;Maria et al., 2008; Sant et al., 2008)。目前超低温保存植物种质资源的研究主要集中在种质材料超低温保存及其植株再生体系的建立(陈勇等,2004;吴黎明等, 2006;刘剑锋等,2007a; 2007b;Wang et al., 2004;Kaczmarczyk et al., 2008; Rajnesh et al., 2008)及冻后材料的遗传稳定性检测(艾鹏飞等,2004; Martina et al., 2006; Kaity et al., 2008; krlep et al., 2008)等方面。
二乔刺槐(Robinia bella-rosea)又名二度红花槐。该品种树干通直,是城乡道路、庭园、风景区和森林公园绿化难得的树种,具有推广价值。本研究在成功建立二乔刺槐组织培养体系的基础上(翟晓巧等,2006; 翟晓巧, 2007),以其叶片诱导产生的愈伤组织为材料研究愈伤组织超低温保存的适宜降温程序和方法,并对冻后恢复过程和保存后的愈伤组织诱导形成新的植株的过程进行观察,旨在探索超低温保存各环节对材料活力的影响和建立超低温保存体系的方法,以便为其超低温保存体系的建立提供技术依据。
1 材料与方法 1.1 试验材料二乔刺槐叶片接种在培养基(MS+5.0 mg·L-1 6-BA,附加20 g·L-1蔗糖和4.85 g·L-1琼脂)(翟晓巧,2007)上, 培养温度(23±2)℃,光照强度130 μmoL·m-2s-1, 光照时间16 h·d-1的条件下培养40天后,选取颜色鲜绿组织致密的愈伤组织作为试验材料。
1.2 试验方法 1.2.1 保护剂处理以MS液体培养基为基质配制4种冰冻保护剂:10%二甲基亚砜(DMSO)+0.5 mol·L-1蔗糖; 10%DMSO+0.5mol·L-1葡萄糖;10% DMSO+0.5mol·L-1蔗糖+10%(w/v)聚乙二醇6000(PEG6000);10%DMSO+0.5 mol·L-1葡萄糖+10%(w/v) PEG6000。将愈伤组织切成约1 cm3大小,放入内盛冰冻保护剂的无菌烧杯中在4 ℃条件下分别处理0,2和4 h,随后等量装入高温灭菌过的10 mL冻存管,每管6块,每个处理3管,管内注入4 ℃预冷过的新鲜保护剂4 mL。将冻存管送入4 ℃培养箱备用。
1.2.2 程序解冻存将存于4 ℃培养箱内装有样品的冻存管取出放入英国PLANER公司生产的KRYO550-16型程序降温仪中,将样品冷却至0 ℃后用采用3种方法降温至-10 ℃:1)以每分钟-1 ℃的速率从0 ℃降到-10 ℃(记为A);2)以每分钟-1 ℃的速率从0 ℃降到-7 ℃, 维持此温度10 min,再以每分钟-0.1 ℃的速率降到-10 ℃(记为B);3)以每分钟-1 ℃的速率从0 ℃降到-7 ℃, 维持此温度1 h,再以每分钟-0.1 ℃的速率降到-10 ℃(记为C)。在-10 ℃时取样进行4 min 38 ℃温水浴快速解冻和TTC染色检测(Steponkus et al., 1967),以相对成活率高低筛选此温度段的最适降温方式。
筛选出此温度段的最佳降温方式后依此方法将样品降温至-10 ℃,在温度段-10~-40 ℃采用3种降温方式对样品进行降温:1)以每分钟-0.3 ℃的速率从-10 ℃降到-40 ℃后投入液氮(记为D);2)以每分钟-0.1 ℃的速率从-10 ℃降到-20 ℃,再以每分钟-0.3 ℃的速率从-20 ℃降到-40 ℃后投入液氮(记为E);3)以每分钟-0.1 ℃的速率从-10 ℃降到-20 ℃,维持于此温度1 h,再以每分钟-0.3 ℃的速率从-20 ℃降到-40 ℃后投入液氮(记为F)。在3种处理结束时取样进行4 min,38 ℃温水浴快速解冻和TTC染色检测,以相对成活率高低筛选最适降温方式。
以所筛选出的0~-40 ℃最适降温方式对样品进行降温,在降温终点温度上分为40 ℃和-80 ℃,分别在样品温度到达后将样品投入液氮保存1天以筛选最适降温终点温度,从而最终确立二乔刺槐愈伤组织的完整最适降温方法。
1.2.3 冷冻材料的恢复培养及植株再生解冻后将愈伤组织用液体培养基(MS+6-BA 5 mg·L-1+30 g·L-1蔗糖)洗涤2次,每次10 min。解冻洗涤后的愈伤组织块转移至内盛50 mL培养基(MS+5.0 mg·L-16-BA,附加20 g·L-1蔗糖和4.85 g·L-1琼脂)的150 mL三角瓶中于闭光培养箱中(23±2)℃培养。暗培养时间设0,7,14天3个处理。暗培养后转移至温度(23±2)℃,光强130 μmoL·m-2s-1, 光照时间16 h·d-1的条件下于14天后统计成活率。从愈伤组织置于光下培养开始对恢复生长过程进行观察和拍照。将培养所得的1 cm以上的芽剪下,转入附加IBA 0.3 mg·L-1的1/2MS生根培养基中,进行生根培养以获得完整植株。选取其中的健壮带根试管苗进行炼苗,移栽前打开试管苗的三角瓶盖,于实验室温度、散射光下炼苗3~4天;用镊子取出小苗洗去根部残余培养基,移栽于疏松腐殖质壤土中,并加盖透光塑料杯,7天后去杯,30天后统计炼苗成活率。
1.2.4 数据计算及处理解冻后采用TTC法(Steponkus et al., 1967)测定细胞活力的材料,每个处理的3次重复均利用下式计算愈伤组织相对成活率:

|
(1) |
解冻后进行暗培养的材料在转至光下1周后以新生出愈伤组织颗粒者为成活,利用下式计算愈伤组织成活率:
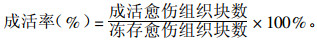
|
(2) |
所获得的数据在经过反正弦转换后以邓肯氏新复极差法计算差异显著性分析,统计分析采用SPSS12.0数据处理软件进行。
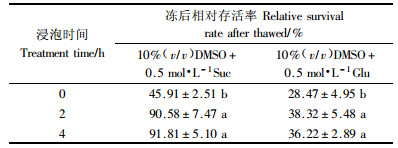
2 结果与分析 2.1 保护剂种类及浸泡时间对愈伤组织活力的影响采用TTC法比较4种冰冻保护剂对超低温保存后愈伤组织活力的影响(表 1,2)。由表 1可见:4种冰冻保护剂处理下的二乔刺槐愈伤组织冻后相对存活率具有显著差异。在4种冰冻保护剂以不同浸泡时间处理下,均以冰冻保护剂10%DMSO+0.5 mol·L-1蔗糖处理的相对存活率为佳,最高可达91.81%,显著高于其余3种冰冻保护剂(P<0.05)。而由表 2可见:在采用保护剂10%DMSO+0.5 mol·L-1蔗糖处理的情况下,浸泡2 h组与浸泡4 h组的结果差异不显著,与不浸泡组的结果显著差异(P<0.05),表明在超低温保存前使样品受到充分的保护剂浸泡对于降温过程中愈伤组织活力的保持十分重要,并且可知过多的延长保护剂浸泡时间并不能显著提高冻后活力。综上所述,采用保护剂10%DMSO+0.5 mol·L-1蔗糖和2 h的冻前保护剂浸泡时间对二乔刺槐愈伤组织程序解冻存是较为适宜的。
|
|
|
|
降温至-10 ℃的二乔刺槐愈伤组织的相对成活率结果如表 3所示。结果表明:以在-7 ℃维持1 h的处理方式结果为最好,相对成活率高达86.67%,和其他处理方式结果呈现明显差异(P<0.05);以在-7 ℃维持10 min的处理方式次之,相对成活率为55.39%;而直接降温至-10 ℃的样品其-10 ℃时解冻后相对成活率仅为13.04%。表明在温度段0~-10 ℃采取适当的降温措施对二乔刺槐愈伤组织活力的保持至关重要,这可能与在此温度段冻存管结冰时其内装载的刺槐愈伤组织对外界环境温度敏感有关,措施不当将严重影响其活力。
|
|
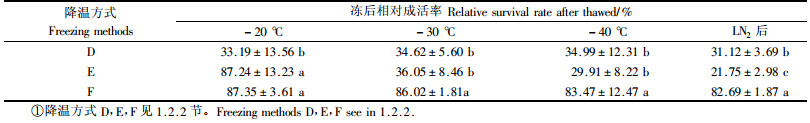
从-10 ℃降温至-40 ℃后的相对成活率结果见表 4。以-0.3 ℃·min-1直接降至-40 ℃的愈伤组织在到达-20 ℃时已经丧失了大部分活力,相对成活率仅为33.19%,与其他降温方式下处于此温度的愈伤组织活力呈显著差异,而其他2种降温方式下的愈伤组织在此温度时的活力比较则无明显差别,说明从-10 ℃到-20 ℃采用-0.1 ℃·min-1的降温速率对二乔刺槐愈伤组织来说较为适宜;在-20 ℃直接以-0.3 ℃·min-1降至-40 ℃的愈伤组织在温度到达-30 ℃时活力已显著降低,从87.24%降为36.05%;而在-20 ℃停留1 h后以-0.3 ℃·min-1降至-40 ℃的愈伤组织即使在液氮保存后也保持了大部分活力,解冻后相对成活率达到了80%以上,这表明在-20 ℃以后的降温过程中降温速率和低温停留时间仍会显著影响二乔刺槐愈伤组织活力,并且可以看出某一阶段降温方式的不适宜将会显著影响后续结果。
|
|
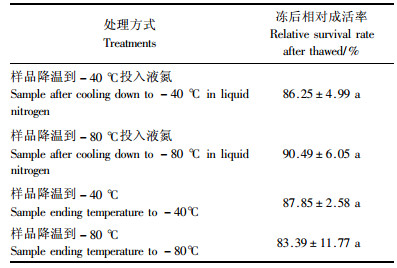
以所筛选出的最适降温方式对样品进行降温,样品温度到达-40,-80 ℃和液氮保存后测得的相对成活率结果如表 5所示。样品温度到达-40 ℃投入液氮前后和-80 ℃投入液氮前后的活力差异不显著(P>0.05),相对成活率均可达到80%以上。可见按既有技术流程冻存的情况下-40和-80 ℃都可作为将二乔刺槐愈伤组织安全投入液氮保存的降温终点温度。从节约时间与物力的考虑,以-40 ℃作为投入液氮保存的降温终点温度较为适宜。
|
|
暗培养前对冻后愈伤组织取样测得相对成活率达到(88.44±2.53)%,暗培养后转移至光下14天统计成活率的结果如表 6所示。没有进行暗培养的愈伤组织冻后成活率为0,暗培养时间为7和14天的愈伤组织冻后成活率分别为12.78%和54.44%,3者之间呈显著性差异(P<0.05)。这表明在二乔刺槐愈伤组织冻后恢复培养的最初阶段,足够长时间的暗培养对冻后二乔刺槐愈伤组织成活率十分重要,不进行暗培养和暗培养时间不足都会对二乔刺槐愈伤组织冻后成活率产生显著影响。这与众多前人的研究结果相符(陈勇等,2004;刘剑锋等,2007),这是由于细胞恢复生长的早期修复冻存过程中受到的损伤需要一段时间,在此期间细胞功能受损不但致使合成如氨基酸、碱基,核糖之类的必需物质受阻,而且造成抗逆能力低下,此时也会造成细胞死亡。
|
|
二乔刺槐愈伤组织超低温保存后其外观仍保持颜色鲜绿(图 1A),但在经历14天暗培养后颜色转为暗绿(图 1B)。光培养的第1天,刚从闭光培养箱取出的愈伤组织块在8 h内褪去残余绿色转变为白色或淡黄色(图 1C)。从第3天开始,白色或淡黄色的愈伤组织块上于7天内开始先后长出若干个外观呈鹅黄色,体积约1 mm3,逐渐变绿的新生愈伤组织颗粒(图 1D)。新生的愈伤组织颗粒在度过一段长短不一的生长迟缓期后开始迅速长大(图 1E),逐渐开始覆盖原有愈伤组织块表面(图 1F),外部形态鲜绿致密,极少呈现玻璃化状态。长时间生长迟滞的愈伤组织颗粒如不及时转移到新培养基与培养基表面直接接触则逐渐开始干枯直至死亡(图 1G)。在开始迅速长大的同时部分新生组织块渐渐长出新生芽(图 1H,I)。新生芽长至1 cm时剪下放入附加适当激素(IBA0.3 mg·L-1)的1/2MS生根培养基上先长出海绵状半透明疏松愈伤继而生根(图 1J),生根培养基未添加上述激素的大部分芽只长出海绵状疏松愈伤而不生根(图 1K)。生根苗约1个月可长成健壮苗。炼苗成活率达90%以上(图 1L)。

|
图 1 二乔刺槐愈伤组织冻后恢复及植株再生 Figure 1 Regrowth and regeneration of the callus of Robinia pseudoacacia after cryopreservation A.暗培养0天的愈伤组织Callus with 0 d’s dark culture;B.暗培养14天的愈伤组织Callus with 14 d's dark culture;C.光培养1天的愈伤组织Callus with 1 d's light culture;D.光培养4天的愈伤组织Callus with 4 d's light culture;E.光培养5天的愈伤组织Callus with 5 d's light culture;F.光培养14天的愈伤组织Callus with 14 d's light culture;G.枯死的新生愈伤Withered new callus;H-I.新生芽New bud;J.生根苗Shoots with adventitious root on rooting medium;K.未生根苗Shoots with no adventitious root on rooting medium;L.移栽成活苗Survival plantlets after transplanting. |
使用程序降温仪进行的超低温保存是一种基于渗透调节细胞内容物和慢速冻结导致细胞脱水,从而使细胞得以安全液氮保存的方法,在脱水过程中,降温速率起着主导作用。如果降温速率适当,细胞内的多余水分则可在冻结成冰前排出,从而避免冰晶的伤害;如果降温速率不当,则高降温速率下细胞脱水过少产生致命的胞内冰,低降温速率下脱水过多产生溶液效应,同样会伤害细胞。细胞的活力必须在解冻后大部分得以保持,所以在冻存的各个环节中细胞活力都不能损失太多。本文对二乔刺槐愈伤组织的程序降温研究中将冻存过程按温度分为0~-10 ℃和-10~-40 ℃ 2个温度段,在2个温度段降温方式、降温终点温度设置处理,以单因素试验确定各阶段适宜的技术细节,在保证前面既有技术流程活力检测结果稳定的情况下才进行下一环节的试验,出现问题则及时回溯排查,从而最终确立二乔刺槐愈伤组织的控速降温超低温保存体系。研究表明在0~-10 ℃温度段设立的3个降温程序中,程序降温仪冷槽以1 ℃·min-1的速率降温至-7 ℃停留1 h,二乔刺槐愈伤组织活力最高;在-10~-40 ℃温度段设立的3个程序中采用0.1 ℃·min-1的冷却速率将样品冷却至-20 ℃,平衡1 h。然后以0.3 ℃·min-1的冷却速率将样品冷却至-40 ℃,愈伤组织活力最高。不同种、不同类型组织细胞其各自的最佳降温方式不同,梨(Pyrus)悬浮细胞的最佳降温方式是以0.1 ℃·min-1的速率降温至-40 ℃后投入液氮(Reed, 1990);刘剑锋等(2007b)在高山红景天(Rhodiola sachalinensis)愈伤组织超低温保存中采用1 ℃·min-1的速率降温至-40 ℃,冻后愈伤组织成活率可达75.64%。在采用程序降温仪开展超低温保存植物材料时需根据各自的材料进行降温速率试验,以便找到最适宜的降温方式。
超低温保存后的二乔刺槐愈伤组织并不是以整体复绿继而生长的方式,而是以旧有愈伤组织表面长出活力旺盛的新生愈伤组织颗粒继而生长的方式恢复生长。这与郭玉琼等(2007)观察到的结果相类似,但并未观察到旧有愈伤组织在原有体积上膨大生长的迹象。除了种间特异性的因素之外,这也可能与所使用的冻存方法不同有关。有部分新生愈伤组织颗粒出现生长不良甚至干枯死亡的现象,将生长不良的新生愈伤组织颗粒转移至与培养基表面直接接触后现象得到缓解。这表明旧有愈伤组织可能会对新生愈伤组织颗粒的营养吸收产生阻碍作用,可采用适时继代转移的办法予以解决。新生愈伤组织较未冻存愈伤组织普遍生长旺盛,这可能是由于超低温保存本身也是逆境选择的过程,能存活下来的组织细胞活力较强所致。
艾鹏飞, 罗正荣. 2004. 柿和君迁子试管苗茎尖玻璃化法超低温保存及再生植株遗传稳定性研究[J]. 中国农业科学, 37(12): 2023-2027. DOI:10.3321/j.issn:0578-1752.2004.12.042 |
陈勇, 陈娴婷, 王君晖. 2004. 瓯柑愈伤组织的玻璃化法超低温保存研究[J]. 浙江大学学报:理学版, 31(2): 197-201. |
郭玉琼, 赖钟雄, 吕柳新. 2007. 玻璃化法超低温保存荔枝胚性愈伤组织及其植株再生[J]. 福建农林大学学报:自然科学版, 36(1): 34-37. |
刘剑锋, 阎秀峰, 程云清, 等. 2007a. 高山红景天愈伤组织的玻璃化法保存及植株再生[J]. 北京林业大学学报, 29(2): 147-151. |
刘剑锋, 阎秀峰, 程云清, 等. 2007b. 高山红景天愈伤组织的超低温保存[J]. 林业科学, 43(6): 57-60. |
吴黎明, 曾继吾, 彭抒昂, 等. 2006. 香蕉茎尖的玻璃化法超低温保存及其植株再生[J]. 园艺学报, 33(3): 501-506. DOI:10.3321/j.issn:0513-353X.2006.03.009 |
翟晓巧, 胡文远, 王念, 等. 2006. 二乔刺槐愈伤组织诱导及植株再生研究[J]. 中国农学通报, 22(11): 103-105. DOI:10.3969/j.issn.1000-6850.2006.11.023 |
翟晓巧. 2007. 二乔刺槐叶片的组织培养[J]. 河南林业科技, 27(4): 16. DOI:10.3969/j.issn.1003-2630.2007.04.007 |
An C S, Wang X D, Yuan X F, et al. 2003. Optimization of cryopreservation of Artemisia annua L. callus[J]. Biotechnology Letters, 25: 35-38. DOI:10.1023/A:1021717828907 |
Kaity A, Ashmore S E, Drew R A, et al. 2008. Assessment of gene tic and epigenetic changes following cryopreservation in papaya[J]. Plant Cell Report, 27: 1529-1539. DOI:10.1007/s00299-008-0558-1 |
Kaczmarczyk A, Shvachko N, Lupysheva Y, et al. 2008. Influence of alternating temperature preculture on cryopreservation results for potato shoot tips[J]. Plant Cell, Tissue and Organ Culture, 27: 1551-1558. |
Maria T G, Ana P, William M, et al. 2008. Development and large scale application of cryopreservation techniques for shoot and somatic embryo cultures of tropical crops[J]. Plant Cell, Tissue and Organ Culture, 92: 1-13. |
Martina U, Jan K, Eva Č. 2006. Genetic and biochemical analysis of Hypericum perforatum L. pants regenerated after cryopreservation[J]. Plant Cell Report, 25: 140-147. DOI:10.1007/s00299-005-0050-0 |
Rajnesh S, Bart P, Mary T, et al. 2008. Cryopreservation of shoot-tips by droplet vitrification applicable to all taro(Colocasia esculenta var. esculenta) accessions[J]. Plant Cell, Tissue and Organ Culture, 92: 107-111. |
Reed B M. 1990. Survival of in vitro-grown apical meristems of Pyrus following cryopreservation[J]. HortScience, 25: 111-113. |
Sant R, Panis B, Taylor M, et al. 2008. Cryopreservation of shoot-tips by droplet vitrification applicable to all taro(Colocasia esculenta var. esculenta) accessions[J]. Plant Cell, Tissue and Organ Culture, 92: 107-111. |
Škrlep K, Bergant M, Winter G M, et al. 2008. Cryopreservation of cell suspention cultures of Taxus × media and Taxus floridana[J]. Biologia Plantarum, 52(2): 329-333. DOI:10.1007/s10535-008-0067-7 |
Steponkus P L, Lanphear F O. 1967. Refinement of the triphenyl tetrazolium chloride method of determining cold injury[J]. Plant Physiology, 42: 1423-1426. DOI:10.1104/pp.42.10.1423 |
Wang Q C, Munir M, Nachman S, et al. 2004. Cryopreservation of grapevine(Vitis spp.) embryogenic cell suspensions by encapsulation-vitrification[J]. Plant Cell, Tissue and Organ Culture, 77: 267-275. DOI:10.1023/B:TICU.0000018393.58928.b1 |
 2009, Vol. 45
2009, Vol. 45