文章信息
- 胡增辉, 沈应柏, 王宁宁, 王金凤, 周艳超, 张志毅.
- Hu Zenghui, Shen Yingbai, Wang Ningning, Wang Jinfeng, Zhou Yanchao, Zhang Zhiyi
- 不同挥发物诱导的合作杨叶片中POD,PPO及PAL活性变化
- Activities of POD, PPO and PAL in Poplar(Populus simonii × P. pyramidalis 'Opera 8277') Leaves Exposed to Different Volatiles
- 林业科学, 2009, 45(10): 44-48.
- Scientia Silvae Sinicae, 2009, 45(10): 44-48.
-
文章历史
- 收稿日期:2008-06-23
-
作者相关文章
2. 北京农学院园林系 北京 102206
2. Garden Department, Beijing University of Agriculture Beijing 102206
植物在遭到机械损伤、昆虫取食后,会释放出一系列挥发性物质(Ping et al., 2001)。其中一些挥发物能够驱避害虫或招引害虫的天敌,而另一些则可作为株间信号,诱导邻近植物产生防御反应(Peñuelas et al., 2004)。某些挥发性物质被认为可能是植物间的信号分子,如茉莉酸甲酯(MeJA)(Farmer et al., 1990)、水杨酸甲酯(MeSA) (Shulaev et al., 1997)、某些萜烯类化合物(Arimura et al., 2000)和某些C6-C10醛类(Zeringue, 1992)。作为研究最多的气体信号,MeJA可以从被剪伤的山艾树(Artemisia tridentata)中大量释放出来,诱导离体番茄(Lycopersicom esculentum)叶片中蛋白酶抑制剂的增加(Farmer et al., 1990)。外源的MeJA熏蒸提高了甘蓝(Brassica oleracea)和烟草(Nicotiana tabacum)对昆虫的抗性(Avdiushko et al., 1997),番茄中多酚氧化酶(PPO)水平(Constabel et al., 1995)、苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)等关键酶活性(Walters et al., 2002)也显著增加。MeSA是烟草在受病原侵染后释放出的挥发物,能够诱导同种植物抗性的升高(Shulaev et al., 1997)。经过MeJA和MeSA熏蒸后的黑杨(Populus deltoides)叶片中,酚类物质含量发生了显著变化(An et al., 2006),用这些叶片喂食的杨扇舟蛾(Clostera anachoreta)幼虫生长发育受到了明显抑制(赵玲等, 2005; Hu et al., 2004)。C6挥发物,包括己醛(hexanal)、顺式己烯醛(cis-hexenal)和反式己烯醛(trans-hexenal)等,是植物叶片受损后早期释放出的成分,由茉莉酸(JA)途径支路的氢过氧化物裂解酶催化产生,能够激活邻近植物体内的防御反应。试验证明:C6挥发物引起棉花(Gossypium hirsutum)中植物毒素的积累(Zeringue, 1992),诱导了拟南芥(Arabidopsis thaliana)中许多防御基因的表达,提高了其对灰霉菌(Botrytis cinerea)的抗性(Kishimoto et al., 2005)。外源trans-hexenal诱导的拟南芥幼苗中基因的表达,与MeJA处理相似,提高了JA途径相关基因和PAL基因的表达(Arimura et al., 2001)。
在植物间传递的挥发物信号可能是多种挥发物组成的“复合信号”。为了研究植物间的这种“复合信号”,本试验利用MeJA分别与MeSA,trans-hexenal,cis-hexenal和苯骈噻唑(benzothiazole)混合后,熏蒸1年生合作杨(Populus simonii × P. pyramidalis ‘Opera 8277’)扦插苗,检测POD, PPO及PAL 3种防御酶活性的变化,探索植物间“复合信号”的作用方式。
1 材料与方法 1.1 试验材料以1年生合作杨扦插苗为试验材料。3月份将插条扦插于直径25 cm、盛有果园土的塑料盆中,定期浇水,缓苗后定期供给全Hoagland营养液,试验于6—7月份进行,苗高约70 cm。
1.2 化合物熏蒸处理单一化合物熏蒸是将扦插苗与分别滴有MeJA,MeSA,trans-hexenal,cis-hexenal和benzothiazole的脱脂棉球放在一密闭玻璃罩中,避免接触,终浓度为1 μmol·L-1。混合挥发物熏蒸是将滴有MeJA的脱脂棉,分别与其他4种化合物同时放在玻璃罩中熏蒸扦插苗,挥发物的终浓度均为1 μmol·L-1。熏蒸12 h后,采集从顶端开始第6,7片叶,立即投入液氮,以相同条件下未受熏蒸扦插苗上的相同位置的叶片作为对照,共10个处理,每个处理重复3次,每次处理1棵苗。
1.3 POD活性测定称取0.1 g叶片(不含叶柄和叶脉),研钵中液氮研磨,加入1 mL经4 ℃预冷的50 mmol·L-1磷酸缓冲液(pH 7.5),4 ℃下12 000 g离心20 min,上清液用于POD活性测定。反应体系包括:2 mL磷酸缓冲液(50 mmol·L-1, pH 7.0);0.2 mL 0.3%过氧化氢;0.1 mL酶液;1 mL 0.1%的愈创木酚。于470 nm处测吸光值变化,每15 s记1次数,测3 min,结果以ΔOD·min-1g-1 FW表示。
1.4 PPO活性测定称取0.1 g叶片(不含叶柄和叶脉),研钵中液氮研磨,加入1 mL经4 ℃预冷的50 mmol·L-1磷酸缓冲液(pH 7.5),震荡均匀后,4 ℃下12 000 g离心20 min,上清液用于PPO活性测定。反应体系包括:2 mL磷酸缓冲液(50 mmol·L-1, pH 7.0);1 mL 0.1 M邻苯二酚;0.3 mL酶液。于398 nm处测吸光值变化,每15 s记1次数,测3 min,结果以ΔOD·min-1g-1 FW表示。
1.5 PAL活性测定称取0.1 g叶片(不含叶柄和叶脉),研钵中液氮研磨,按1:10(W/V)加入1 mL经4 ℃预冷的50 mmol·L-1硼酸缓冲液(pH 8.8),4 ℃下12 000 g离心20 min,上清液用于PAL活性测定。反应体系包括:2 mL的双蒸水;0.8 mL 20 mmol·L-1 L-苯丙氨酸;200 μL酶液。于290 nm处测定吸光值,然后30 ℃温育30 min,再测定吸光值,酶活性以ΔOD·h-1g-1 FW表示。
2 结果与分析 2.1 MeJA+MeSA诱导的合作杨叶片中POD,PPO及PAL活性变化MeJA是在一些植物间传递信号的化合物(Farmer et al., 1990)。MeSA也是一种潜在的信号分子,对其大部分的研究集中在病原侵染上(Shulaev et al., 1997)。在合作杨叶片中,MeJA和MeSA单独熏蒸均诱导了POD, PPO和PAL 3种酶活性的增加(图 1)。MeJA均诱导了POD, PPO, PAL 3种防御酶活性的显著增加(P<0.05)。MeSA没有引起PPO活性的显著增加(图 1B),但对POD和PAL 2种酶具有与MeJA相似的诱导效果(图 1A,C)。当经二者混合的挥发物熏蒸后,3种酶的活性较单独诱导均有升高,说明MeJA和MeSA混合后的诱导能力高于各自单独诱导的能力,但从活性的升高幅度来看,仅比单独挥发物诱导中活性较高者高1/5倍,差异显著(P<0.05)。
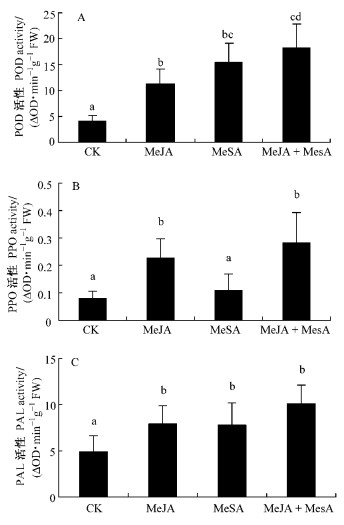
|
图 1 MeJA+MeSA诱导的合作杨叶片中POD,PPO及PAL活性变化 Figure 1 Activities of POD, PPO and PAL in poplar leaves exposed to MeJA+MeSA 图中数据为平均值±标准差,n=3;数据经过LSD分析; 不同字母表示不同处理间差异显著(P<0.05)。下同。 The data are means ±SD, n=3.Data were analyzed using LSD test. Letters indicate significant difference among different treatments(P < 0.05). The same below. |
Bate等(1998)研究发现,trans-hexenal诱导了拟南芥中查儿酮合成酶、丙二烯氧化合成酶等防御基因的表达。当单独用 trans-hexenal熏蒸合作杨时,POD,PPO及PAL 3种酶活性较对照有显著增加(图 2),并且对于POD和PPO活性的诱导能力明显的高于MeJA,而对PAL活性,二者的诱导效果相似。用二者的混合挥发物熏蒸后,3种酶活性较单独熏蒸有了显著升高(P<0.05),增加最明显的是POD,接近2种挥发物单独诱导活性的加和。而另外2种酶活性升高与MeJA和MeSA混合的诱导结果相似,比单独诱导的较高者高1/4倍。
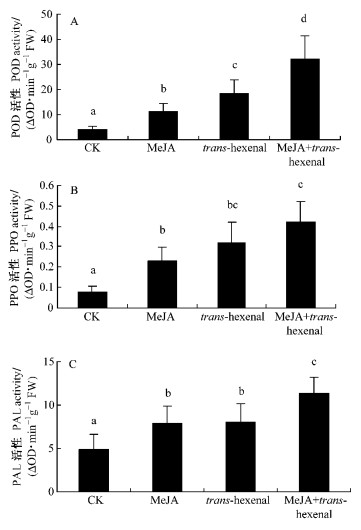
|
图 2 MeJA+trans-hexenal诱导的合作杨叶片中POD,PPO及PAL活性变化 Figure 2 Activities of POD, PPO and PAL in poplar leaves exposed to MeJA+ trans-hexenal |
经过另一种C6醛cis-hexenal熏蒸后,合作杨叶片中的POD和PPO活性也有了明显的增加,但是其诱导能力低于MeJA,对PAL活性的诱导效果不明显,而MeJA和cis-hexenal混合挥发物表现出很强的诱导能力(图 3)。二者混合后诱导的POD和PPO活性,较单独诱导有显著增加(P<0.05),高于2种挥发物单独诱导的加和,PAL活性较MeJA单独熏蒸高出1/4倍,但差异不显著(P<0.05)。
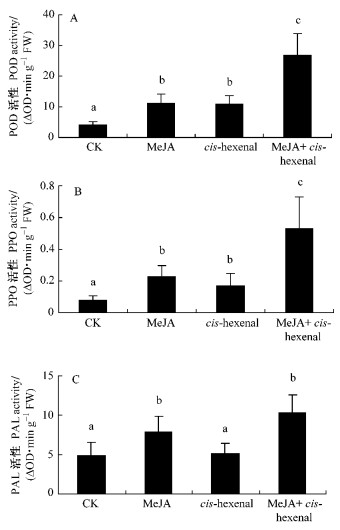
|
图 3 MeJA+cis-hexenal诱导的合作杨叶片中POD,PPO及PAL活性变化 Figure 3 Activities of POD, PPO and PAL in poplar leaves exposed to MeJA+cis-hexenal |
苯骈噻唑(benzothiazole)在复叶槭(Acer negundo)、杨树等木本植物受到损伤后检测到的挥发物,可能是木本植物间传递信息的信号分子,因此对MeJA和benzothiazole混合挥发物诱导的POD,PPO及PAL活性变化也进行了检测(图 4)。与前面几种混合的挥发物诱导结果相似,MeJA和benzothiazole混合后诱导了比2者单独诱导更高的酶活性,除诱导的POD活性与单独诱导相比并不显著外,PPO和PAL的活性与单独诱导相比均显著升高(P<0.05)。

|
图 4 MeJA+benzothiazole诱导的合作杨叶片中POD,PPO及PAL活性变化 Figure 4 Activities of POD, PPO and PAL in poplar leaves exposed to MeJA+benzothiazole |
植物间由气态信号分子介导的信息是存在于植物中的一种普遍现象(Karban et al., 2003; Engelberth et al., 2004),是植物在与恶劣环境及病虫害斗争过程中,为了更好生存而进化的结果。多种具有信号功能的挥发物已经被发现,包括MeJA,MeSA,萜烯类化合物及绿叶气味挥发物等(平立岩等, 2001)。一部分挥发物受到胁迫前不释放,受胁迫后才开始合成,而有些挥发物在受胁迫前也有释放,但浓度较低,当受到胁迫后,释放量增大,同样起到传递信号的作用。并且植物在受到虫咬等胁迫后能够释放出多种信号分子,并且具有明显的、呈时序性的释放规律(Ping et al., 2001)。因此推测植物间存在的由挥发物介导的信息传递,是由多种信号分子组成的“复合信号”来完成的,单一的挥发物虽然也能诱导防御基因的表达,但不能传递完整的信息,并且不同挥发物的组合及不同浓度的组合可能代表了不同的含义(孔垂华等, 2003)。而对植物间挥发性信号的这种作用方式研究还较少。为了破译植物间的通讯密码,将MeJA分别与MeSA,trans-hexenal,cis-hexenal,benzothiazole,以1 μmol·L-1的熏蒸浓度混合,检测了其诱导的合作杨叶片中POD,PPO及PAL活性变化,对植物“复合信号”进行初步探索。
无论单一挥发物还是混合挥发物都诱导了3种防御酶活性显著增加,表明激活了合作杨体内的防御反应。吴国昭等(2007)研究发现,一定浓度的MeJA和MeSA能够诱导挺立型普通野生稻中POD活性的增加。刘彧等(2007)通过电泳试验证明,外源MeJA诱导小麦根中POD表达量的增加。本文推测,虽然气体信号分子也能诱导原有酶活性的增强,但在本试验中检测到防御酶活性的增加,主要是由于诱导3种酶合成的增加而引起的。
从单一挥发物诱导酶活性增加的结果来看,trans-hexenal诱导能力最强,其次是MeJA和MeSA,然后是benzothaizole,诱导效果最差的是cis-hexenal。同样作为C6醛,且是同分异构体的trans-hexenal和cis-hexenal,在诱导酶活增加上表现出明显的差异,由于本文使用的熏蒸浓度相同,因此认为引起这种差异的原因在于它们结构的不同;但混合挥发物诱导的酶活性增加却表现出不同的结果。4种混合挥发物的诱导结果表明,混合挥发物的诱导能力都要高于单一挥发物的诱导能力。与其他3种混合挥发物相比,MeJA+cis-hexenal诱导的防御酶活性升高更为显著,因此其诱导能力最强,其他3种混合挥发物的诱导效果相近。从混合挥发物诱导酶活性升高的结果来看,“复合信号”诱导的防御反应不仅仅是单一挥发物诱导防御反应的加和。不同挥发物诱导酶活性差异的结果表明,植物能够分辨和识别不同的气体信号,从而激活相应的防御途径。植物细胞质膜上不同挥发物的受体,是植物能够识别不同气体信号的根本原因。
信号分子到达受熏蒸的叶片后,通过与质膜上的受体结合,激活各自下游的信号传递途径,共同诱导防御反应产生。这些信号途径间可能各自独立,也可能存在交叉。对于MeJA与MeSA混合后诱导的PAL活性升高这一类变化,它们各自诱导能力相近,而混合后诱导的酶活性增加仅比单独诱导的高约1/4,推测诱导PAL活性增加的MeJA和MeSA信号途径间存在重叠。而对于POD活性,MeJA与MeSA单独诱导的效果存在差异,混合后诱导的酶活性增加较单独诱导中较大的高约1/5~1/4,虽比单独诱导中较低的有显著增加,但远低于二者单独诱导的加和,这2种信号分子的信号途径间存在部分重叠和交叉。其他如MeJA和MeSA混合后诱导的PPO活性升高,MeJA与trans-hexenal混合诱导的POD活性升高,各自单独诱导的活性加和相等,其信号途径中交叉较少。MeJA与cis-hexenal混合后诱导的POD和PPO活性的增加,较2者单独诱导的活性的加和大,表明这2种物质的信号途径相互促进,使各自的诱导能力充分发挥。
从试验结果可以看出,对于同一种酶,不同的挥发物诱导效果不同,特别是不同的挥发物混合后,诱导效果差异明显,暗示其诱导信号传递途径的复杂性。由于对于植物间这种“复合信号”的研究还处于初级阶段,对于不同信号分子的浓度组合,代表含义,植物如何接受“复合信号”都需要进行进一步研究。
孔垂华, 胡飞. 2003. 植物化学通讯研究进展[J]. 植物生态学报, 27(4): 561-566. DOI:10.3321/j.issn:1005-264X.2003.04.020 |
刘彧, 赵秀兰, 李欢庆. 2007. 茉莉酸甲酯抑制小麦根生长及体内抗氧化酶活性变化[J]. 安徽农业科学, 35(4): 988-989, 1008. DOI:10.3969/j.issn.0517-6611.2007.04.026 |
平立岩, 沈应柏. 2001. 植物创伤诱导的挥发物及其信号功能[J]. 植物生理学通讯, 37(2): 166-172. |
吴国昭, 曾任森. 2007. 外源水杨酸甲酯和茉莉酸甲酯处理对挺立型普通野生稻保护酶活性的影响[J]. 西北农业学报, 16(3): 82-84. DOI:10.3969/j.issn.1004-1389.2007.03.021 |
赵玲, 胡增辉, 赵凤君, 等. 2005. 水杨酸甲酯诱抗黑杨对杨扇舟蛾生长发育的影响[J]. 北京林业大学学报, 27(1): 75-78. DOI:10.3321/j.issn:1000-1522.2005.01.016 |
An Y, Shen Y B, Wu L J, et al. 2006. A change of phenolic acids content in poplar leaves induced by methyl salicylate and methyl jasmonate[J]. Journal of Forestry Research, 17: 107-110. DOI:10.1007/s11676-006-0025-1 |
Arimura G, Ozawa R, Horiuchi J, et al. 2001. Plant-plant interactions mediated by volatiles emitted from plant infested by spider mites[J]. Biochem Syst Ecol, 29: 1049-1061. DOI:10.1016/S0305-1978(01)00049-7 |
Arimura G, Ozawa R, Shimoda T, et al. 2000. Herbivory-induced volatiles elicit defence genes in lima bean leaves[J]. Nature, 406: 512-515. DOI:10.1038/35020072 |
Avdiushko S A, Brown G C, Dahlman D L, et al. 1997. Methyl jasmonate exposure induces insect resistance in cabbage and tobacco[J]. Physiol Chem Ecol, 26: 642-654. |
Bate N J, Rothstein S J. 1998. C6-volatiles derived from the lipoxygenase path way induce a subset of defense-related genes[J]. Plant Journal, 16: 561-569. DOI:10.1046/j.1365-313x.1998.00324.x |
Constabel C P, Bergey D R, Ryan C A. 1995. Systemin activates synthesis of wound-inducible tomatoleaf polyphenol oxidase via the octadecanoid defense signaling pathway[J]. Proc Nat Acad Sci USA, 92: 371407-371411. |
Engelberth J, Alborn H T, Schmelz E A, et al. 2004. Airborne signals prime plants against insect herbivore attack[J]. Proc Natl Acad Sci USA, 101: 1781-1785. DOI:10.1073/pnas.0308037100 |
Farmer E E, Ryan C A. 1990. Interplant communication: airborne methyl jasmonate induces synthesis of proteinase inhibitors in plant leaves[J]. Proc Natl Acad Sci USA, 87: 7713-7716. DOI:10.1073/pnas.87.19.7713 |
Hu Z H, Yany D, Shen Y B. 2004. Difference in volatiles of poplar induced by various damage[J]. Journal of Forestry Research, 15: 280-282. DOI:10.1007/BF02844952 |
Karban R, Maron J, Felton G W, et al. 2003. Herbivore damage to sagebrush induces resistance in wild tobacco: evidence for eavesdropping between plants[J]. Oikos, 100: 325-332. DOI:10.1034/j.1600-0706.2003.12075.x |
Kishimoto K, Matsui K, Ozawa R, et al. 2005. Volatile C6-aldehydes and allo-ocimene activate defense genes and induce resistance against Botrytis cinerea in Arabidopsis thaliana[J]. Plant Cell Physiology, 46: 1093-1102. DOI:10.1093/pcp/pci122 |
Peñuelas J, Llusià J. 2004. Plant VOC emissions: making use of the unavoidable[J]. Trends in Ecology and Evolution, 19: 402-403. DOI:10.1016/j.tree.2004.06.002 |
Ping L Y, Shen Y B, Jin Y J, et al. 2001. Leaf volatiles induced by mechanical damage from diverse taxonomic tree species[J]. Acta Botanica Sinica, 43: 261-266. |
Shulaev V, Silverman P, Raskin I. 1997. Airborne signaling by methyl salicylate in plant pathogen resistance[J]. Nature, 385: 718-721. DOI:10.1038/385718a0 |
Walters D, Cowley T, Mitchell A. 2002. Methyl jasmonate alters polyamine metabolism and induces systemic protection against powdery mildew infection in barley seedlings[J]. Journal of Experimental Botany, 53: 747-756. DOI:10.1093/jexbot/53.369.747 |
Zeringue H J. 1992. Effect of C6-C10 alkenals and alkanals on eliciting a defence responsible in the developing cotton boll[J]. Phytochemistry, 31: 2305-2308. DOI:10.1016/0031-9422(92)83269-5 |
 2009, Vol. 45
2009, Vol. 45

