文章信息
- 谢寅峰, 姚晓华, 王林, 杨阳, 张春霞.
- Xie Yinfeng, Yao Xiaohua, Wang Lin, Yang Yang, Zhang Chunxia
- 外源一氧化氮对鹅毛竹离体叶片衰老的影响
- Influence of Exogenous Nitric Oxide on Senescence in Detached Leaves of Shibataea chinensis
- 林业科学, 2009, 45(10): 39-43.
- Scientia Silvae Sinicae, 2009, 45(10): 39-43.
-
文章历史
- 收稿日期:2008-09-01
-
作者相关文章
一氧化氮(nitric oxide, NO)是广泛存在于生物体内的一种气体分子,作为重要的信号分子参与植物抗逆等生理反应(Lamattina et al., 2003),如调节盐胁迫(Zhao et al., 2007)、热胁迫(Akio et al., 2002)、干旱胁迫(刘鹏程等,2004)、酸胁迫(谢寅峰等,2007)、病原体反应(胡向阳等,2005)、细胞程序化死亡(Pedroso et al., 2000);但NO对植物叶片衰老调节作用的研究较少。屠洁等(2002)利用外源NO对小麦(Triticum aestivum)离体叶片过氧化氢代谢的影响进行研究,结果表明:外源NO可通过对POD和CAT的不同抑制作用来调节小麦叶片内源H2O2含量;Kuo等(2003;2004)研究表明NO能够延缓ABA、茉莉酸甲酯所诱导的水稻(Oryza)离体叶片的衰老,认为NO的作用可能与调节氧化胁迫有关。但NO对衰老的具体作用机制不明确,其对叶片衰老的调节效应及其机制研究尚少。
竹类植物是重要的经济植物,具有独特的衰老生物学特性,大多数竹种为一生一次性开花植物,并随着开花结实,叶片及植株逐渐进入衰老死亡(杜凡等,2000),竹林的大面积开花衰老会导致严重的经济损失和生态环境的破坏(袁晓亮等,2007)。因此,对竹类植物叶片衰老调控的研究具有重要的理论和现实意义。本文以园林观赏竹种鹅毛竹(Shibataea chinensis)为试验材料,以硝普钠(SNP)为NO供体,研究外源NO对开花鹅毛竹离体叶片衰老的生理影响,探讨NO对植物叶片衰老的生理机制,为NO调控竹类植物叶片衰老的研究与应用提供参考。
1 材料与方法 1.1 试验材料以栽植于南京林业大学竹类植物园的花后鹅毛竹为试验材料,采集不同植株当年生第3分枝(由上往下)充分伸展、大小均一、无病虫害的叶片用于以下各试验。
1.2 材料处理叶片衰老采用离体暗诱导方法(Fang et al., 2002),将所采叶片洗净、吸干,用直径1 cm打孔器沿叶片中脉两侧打取小叶盘,按每10 mL清水中10个叶圆片置于直径为15 cm的培养皿中,于30 ℃培养箱中进行暗诱导处理,处理时间为5天,每日更换清水,以未处理鲜样作为对照(CK)。
衰老调节在离体暗诱导之前通过预处理方式进行,以SNP作为NO供体,处理浓度分别为0,10,30,50 mg·L-1(分别用S0,S10,S30,S50表示),另设与S30等摩尔浓度氮的NaNO3溶液(以N表示)作为与S30处理的对比,叶片处理方式及条件同离体暗诱导处理,预处理时间为24 h。
所有处理(包括预处理)至少3个重复,处理后定时取样用于下列生理生化指标测定并对叶色变化进行观察。
1.3 测定指标及方法叶绿素含量采用丙酮乙醇混合(1:1)浸提法(张宪政等,1994)测定,蛋白质含量采用考马斯亮蓝G-250染色法(中国科学院上海植物生理研究所等,1999)测定,SOD活性采用NBT光化还原法(龚富生等,1995)测定,POD活性采用愈创木酚法(张志良,1995)测定,叶绿素荧光参数利用美国LI-6400R型便携式荧光-光合作用测量系统的6400-40荧光叶室按操作规程要求进行测定。饱和强闪光强7 000 μmol·m-2s-1,脉冲时间0.8 s。经过充分暗适应的叶片先测定初始荧光(F0),随后加1个饱和强闪光(7 000 μmol·m-2s-1,脉冲时间0.8 s),测定最大荧光(Fm)。其他荧光参数按以下公式计算:PSⅡ潜在量子效率(Fv/Fm)=(Fm-F0)/Fm;PSⅡ潜在活性(Fv/F0)=(Fm-F0)/F0。
荧光测定每个处理9次重复,其他指标3个重复。
1.4 统计分析利用Excel及stst统计分析软件对数据进行统计分析。
2 结果与分析 2.1 外源NO对花后鹅毛竹离体叶片叶绿素含量的影响处理5天后,叶绿素含量明显下降,与CK相比,S0的Chl,Chla,Chlb分别下降21.1%,19.8%,26.2%,差异显著(P<0.05);而经过NO预处理后,离体叶片Chl,Chla,Chlb含量的下降均有不同程度的缓解,与S0相比,S10,S30,S50的Chl含量分别为S0的111.0%,120.1%和109.1%,Chla分别为109.4%,117.4%,107.7%,Chlb分别为112.0%,123.0%和110.9%,S30缓解效果最明显,其含量基本接近于CK水平,并且与S0差异显著(P<0.05)(图 1)。外观观察也表明,S0处理叶片失绿程度最重、面积最大、出现时间最早,而S30叶色变化程度和范围最小。表明外源适当浓度NO预处理可明显抑制开花鹅毛竹叶片离体衰老过程中叶绿素含量的下降。
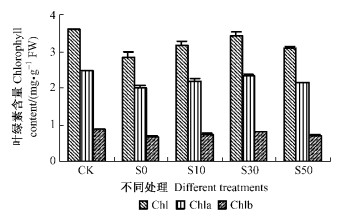
|
图 1 不同处理对花后鹅毛竹离体叶片叶绿素含量的影响 Figure 1 Effect of different treatments on chlorophyll content ofdetached leaves in S. chinensis after anthesis |
由图 2可知:离体处理过程中鹅毛竹叶片蛋白质含量逐渐降低,处理3天后蛋白质含量急剧下降,处理5天后,S0仅为CK的14.7%。NO预处理均不同程度地延缓了鹅毛竹离体叶片蛋白质含量的下降,处理3天后,S10,S30,S50蛋白质含量分别为S0的103%,115%,104%;处理5天后,S10,S30,S50叶片蛋白质含量分别为S0的229%,289%,216%。不同浓度的NO预处理对叶片衰老过程中蛋白质含量的下降均有明显抑制效果,尤以S30处理效果最为明显(P<0.01)。
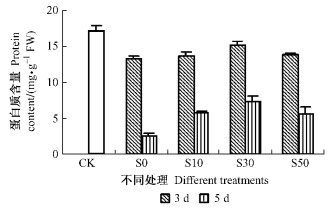
|
图 2 不同处理对花后鹅毛竹离体叶片蛋白质含量的影响 Figure 2 Effect of different treatments on protein content of detached leaves in S. chinensis after anthesis |
蛋白质、叶绿素含量测定及外部观察结果表明:不同浓度的SNP处理对缓解鹅毛竹离体叶片衰老均有不同程度的作用,以S30处理效果最显著。为排除氮作为营养元素对叶片衰老可能的缓解作用,采用相同摩尔浓度含氮量的NaNO3预处理(N)作比较对SNP的作用进行了进一步的验证。
由图 3可知:处理3天后,与S0相比,N处理的叶片蛋白质、Chla、Chlb和叶绿素总含量分别下降了33.1%,5.8%,4.6%和6.2%;而S30预处理却使上述生理指标分别升高12.5%,5.1%,5.8%和6.1%,各处理间蛋白质、叶绿素a、叶绿素总含量差异显著(P<0.05),叶绿素b含量差异不显著。表明SNP延缓开花鹅毛竹离体叶片衰老的作用并非提供氮素营养引起,应与叶片吸收SNP后释放NO信号分子有关。
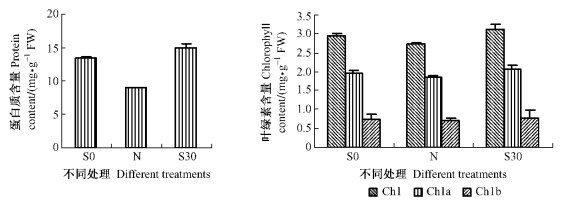
|
图 3 S0,S30及N处理对花后鹅毛竹离体叶片蛋白质和叶绿素含量的影响 Figure 3 Effects of S0, S30 and N treatments on protein and chlorophyll content of detached leaves in S. chinensis after anthesis |
为进一步探讨NO缓解鹅毛竹离体叶片衰老作用机制,对缓解效果最佳的以S30及无SNP处理的S0在保护酶(POD,SOD)活性以及叶绿素荧光参数的动态变化进行了比较(图 4)。
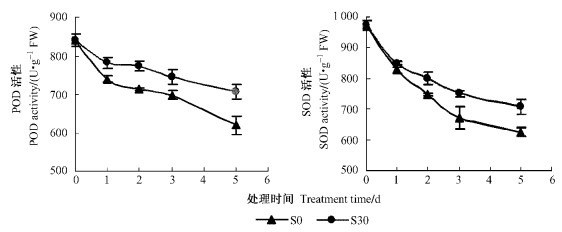
|
图 4 不同处理对花后鹅毛竹离体叶片POD和SOD活性的影响 Figure 4 Effects of different treatments on POD and SOD activity of detached leaves in S. chinensis detached leaves after anthesis |
由图 4可知:S0和S30的POD,SOD活性均随叶片的衰老而逐渐降低,但S30的POD,SOD活性下降幅度明显低于S0。至处理第5天,S0处理的POD,SOD活性分别降低了26.2%和35.6%,而S30仅分别降低了15.9%和27.0%,S30的POD,SOD活性比S0分别提高14.0%,13.3%,二者差异均显著(P<0.05)。
2.5 外源NO对花后鹅毛竹离体叶片荧光参数的影响 2.5.1 外源NO对花后鹅毛竹离体叶片暗适应叶绿素荧光产额的影响F0是由激发的叶绿素在将激发能传递到反应中心之前发射出去的,它与光合活性无关,F0增加通常被看作是PSⅡ反应中心不可逆破坏或可逆失活的结果;Fm的大小则反映了通过PSⅡ的电子传递情况。由图 5可知:在开花鹅毛竹离体叶片衰老过程中,F0逐渐上升而Fm逐渐下降,至第5天,S0的F0上升了89.5%,Fm则下降了42.1%。与S0相比,S30处理明显缓解了F0上升和Fm的下降趋势,处理间差异显著。可见适当浓度NO处理对叶片离体衰老过程中F0的上升和Fm的下降具有显著抑制作用。
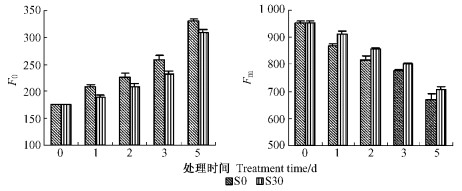
|
图 5 不同处理对花后鹅毛竹离体叶片暗适应下最小荧光(F0)、最大荧光(Fm)的影响 Figure 5 Effects of different treatments on the minimum fluorescence (F0), and the maximum fluorescence (Fm) of dark adapt of detached leaves in S. chinensis after anthesis |
Fv/Fm是PSⅡ最大光化学效率,反映的是PSⅡ原初光能转化效率,而Fv/F0反映的是PSⅡ的潜在活性(Maxwel et al., 2000)。由图 6可知:在花后鹅毛竹离体叶片衰老过程中,Fv/F0和Fv/Fm均明显降低,至第5天,S0的Fv/Fm和Fv/F0分别下降了38.2%和77.0%。与S0相比,S30处理明显抑制了Fv/Fm和Fv/F0的下降趋势,2个处理间差异显著。

|
图 6 不同处理对花后鹅毛竹离体叶片PSⅡ最大光化学效率(Fv/Fm)与PSⅡ潜在活性(Fv/F0)的影响 Figure 6 Effects of different treatments on PSⅡ maximal photochemical efficiency (Fv/Fm), and PSⅡ potential activity (Fv/F0) of detached leaves in S. chinensisafter anthesis |
高等植物叶片衰老最明显的外部特征是叶片失绿,同时在内部生理上表现出叶绿素、蛋白质等大分子物质降解加快、光合能力降低,并伴随着叶绿体等细胞器结构的破坏(杨淑慎等, 2001)。本试验结果表明:外源10~50 mg·L-1 SNP预处理对花后鹅毛竹叶片离体衰老均有不同程度的缓解作用,尤以30 mg·L-1浓度处理效果最佳。为验证SNP作为NO供体所起的调节作用,敬岩等(2007)利用SNP的分解产物NaNO2,K4Fe(CN)6和K3Fe(CN)6验证了SNP的作用不是由这些剩余残基引起的,而是由其释放的NO作用的结果;Fang等(2002)利用NO拮抗剂c-PTIO验证了SNP可以作为NO的供体;Delledonne等(1998)证明0.5 mol·L-1的SNP能产生2.0μmol·L-1的NO。本试验通过NaNO3作为对比验证了SNP延缓衰老并非提供氮素营养的作用结果,可见适当浓度的外源NO对花后鹅毛竹叶片离体衰老具有明显缓解效果。
叶片衰老与活性氧代谢有关,衰老的自由基理论认为活性氧代谢平衡失调造成体内自由基的积累是引起器官伤害和衰老的原因(叶维杨,2007),SOD,CAT,POD等是活性氧清除酶系统的重要保护酶(杨淑慎等,2001)。本研究显示:鹅毛竹离体叶片在衰老过程中保护酶POD,SOD活性显著下降,NO预处理可以明显抑制POD,SOD活性的下降趋势,表明抗氧化胁迫能力的增强是NO缓解鹅毛竹叶片离体暗诱导衰老的一种机制,与Kuo等(2003;2004)用SNP作为NO供体调节ABA和JA诱导的水稻离体叶片衰老的研究结果相吻合。
光合器官及其机能的衰退是叶片衰老的主要特征之一,而叶绿素荧光分析技术常用于检测植物光合机构对环境胁迫及衰老的响应(吴楚等,2005;俞慧娜等,2007;Wang et al., 2006)。本试验显示暗诱导使鹅毛竹叶片的Fm,Fv/Fm,Fv/F0下降而F0增加,说明鹅毛竹叶绿体的PSⅡ反应中心受到伤害,光合活性下降,光化学效率降低;经过外源NO的预处理后,上述叶绿素荧光参数的变化均得到了显著抑制,进一步证明NO可以有效减缓衰老过程中PSⅡ反应中心的破坏及PSⅡ光化学活性的下降。NO的这种缓解机制可能与增强衰老过程中的抗氧化能力有关,NO作为信号分子通过刺激保护酶系统活力、增强活性氧的清除能力,从而保护光合器官所遭受的伤害,其具体机制尚待进一步研究。
NO对植物胁迫的调节具有双重性:低浓度NO对植物具有保护作用;高浓度NO会诱发超氧自由基(O2-)和过氧化氢(H2O2)大量产生,从而对组织有破坏性(张艳艳等,2004)。本研究结果可知:NO对离体叶片衰老的缓解作用也具有两重性,在预试验中发现当SNP处理浓度大于70 mg·L-1时,明显促进离体叶片的衰老进程。本研究初步表明:适当浓度的外源SNP对花后鹅毛竹离体叶片的衰老具有明显缓解作用,然而本研究是通过离体试验系统进行的,对于联体条件下叶片的衰老是否也有缓解效应尚需进一步验证。本研究为NO与植物叶片衰老关系的研究提供理论依据,同时,也为NO调控竹子花后叶片衰老的研究提供参考。
杜凡, 薛嘉榕, 杨宇明, 等. 2000. 15年来云南竹子的开花现象及其类型研究[J]. 林业科学, 36(6): 57-68. DOI:10.3321/j.issn:1001-7488.2000.06.009 |
龚富生, 张嘉宝. 1995. 植物生理学实验[M]. 北京: 气象出版社.
|
胡向阳, 蔡伟明. 2005. 一氧化氮与激发子诱导的植物抗病防卫反应[J]. 生命科学, 17(2): 176-182. DOI:10.3969/j.issn.1004-0374.2005.02.014 |
敬岩, 孙宝腾, 符建荣, 等. 2007. 一氧化氮改善铁胁迫玉米光合组织结构及其活性[J]. 植物营养与肥料学报, 13(5): 809-815. DOI:10.3321/j.issn:1008-505x.2007.05.008 |
刘鹏程, 王辉, 程佳强, 等. 2004. NO对小麦叶片干旱诱导膜脂过氧化的调节效应[J]. 西北植物学报, 24(1): 141-145. DOI:10.3321/j.issn:1000-4025.2004.01.024 |
屠洁, 沈文飚, 叶茂炳, 等. 2002. 外源NO供体对小麦离体叶片过氧化氢代谢的影响[J]. 植物学通报, 19(3): 336-341. DOI:10.3969/j.issn.1674-3466.2002.03.012 |
吴楚, 王政权, 孙海龙, 等. 2005. 氮磷供给对长白落叶松叶绿素合成、叶绿素荧光和光合速率的影响[J]. 林业科学, 41(4): 31-36. DOI:10.3321/j.issn:1001-7488.2005.04.006 |
谢寅峰, 杨万红, 杨阳, 等. 2007. 外源一氧化氮对模拟酸雨胁迫下箬竹光合特性的影响[J]. 生态学报, 27(12): 5193-5201. DOI:10.3321/j.issn:1000-0933.2007.12.029 |
杨淑慎, 高俊凤, 李学俊. 2001. 高等植物叶片的衰老[J]. 西北植物学报, 21(6): 1271-1277. DOI:10.3321/j.issn:1000-4025.2001.06.037 |
叶维杨. 2007. 中水处理对植物保护酶活性的影响[J]. 安徽农学通报, 13(21): 23-26. DOI:10.3969/j.issn.1007-7731.2007.21.010 |
俞慧娜, 刘鹏, 徐根娣, 等. 2007. 大豆生长及叶绿素荧光特性对铝胁迫的反应[J]. 中国油料作物学报, 29(3): 257-265. DOI:10.3321/j.issn:1007-9084.2007.03.007 |
袁晓亮, 林新春, 林绕, 等. 2007. 竹子成花研究进展[J]. 竹子研究汇刊, 26(1): 6-14. DOI:10.3969/j.issn.1000-6567.2007.01.002 |
张宪政, 陈凤玉, 王荣富. 1994. 植物生理学实验技术[M]. 沈阳: 辽宁科学技术出版社.
|
张艳艳, 刘友良. 2004. 一氧化氮在植物体内的来源和功能[J]. 西北植物学报, 24(5): 921-929. DOI:10.3321/j.issn:1000-4025.2004.05.032 |
张志良. 1995. 植物生理学实验指导[M]. 2版. 北京: 高等教育出版社.
|
中国科学院上海植物生理研究所, 上海植物生理学会. 1999. 现代植物生理学实验指南[M]. 北京: 科学出版社.
|
Akio U, Andre T J, Takashi H, et al. 2002. Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice[J]. Plant Science, 163: 515-523. DOI:10.1016/S0168-9452(02)00159-0 |
Delledonne M, Xia Y J, Dixon R A, et al. 1998. Nitric oxide functions as a signal in plant disease resistance[J]. Nature, 934: 585-588. |
Fang Y C, Shih Y H, Ching H K, et al. 2002. Nitric oxide counter acts the senescence of detached rice leaves induced by dehydration and polyethylene glycol but not by sorbitol[J]. Plant Growth Regulation, 38: 265-272. DOI:10.1023/A:1021529204978 |
Kuo T H, Ching H K. 2004. Nitric oxide acts as an antioxidant and delays methyl jasmonate induced senescence of rice leaves[J]. Plant Physiology, 161: 43-52. DOI:10.1078/0176-1617-01178 |
Kuo T H, Ching H K. 2003. Nitric oxide counteracts the senescence of rice leave s induced by abscisic acid[J]. Plant Physiology, 160: 871-879. DOI:10.1078/0176-1617-01118 |
Lamattina L, Gatcia-Mata C, Gtaziano M, et al. 2003. Nitric oxide: The versatility of an extensive signal molecule[J]. Annu Rev Plant Biol, 54: 109-136. DOI:10.1146/annurev.arplant.54.031902.134752 |
Maxwel K, Johnson G N. 2000. Chlorophyll fluorescence—a practical guide[J]. Journal of Experimental Botany, 51(345): 659-668. DOI:10.1093/jexbot/51.345.659 |
Pedroso M C, Durzan D J. 2000. Effect of different gravity environments on DNA fragmentation and cell death in Kalanchoë leaves[J]. Ann Bot, 86: 983-994. DOI:10.1006/anbo.2000.1260 |
Wang P, Duan W, Takabayashi A, et al. 2006. Chloroplastic NAD(P)H dehydrogenase in tobacco leaves functions in alleviation of oxidative damage caused by temperature stress[J]. Plant Physiology, 141(2): 465-474. DOI:10.1104/pp.105.070490 |
Zhao M G, Tian Q Y, Zhang W H. 2007. Nitric oxide synthase-dependent nitric oxide: Production is associated with salt tolerance in arabidopsis[J]. Plant Physiology, 144(1): 206-217. DOI:10.1104/pp.107.096842 |
 2009, Vol. 45
2009, Vol. 45
