文章信息
- 王宝辉, 郑建伟, 黄大庄, 王达, 马向超, 韩小勇.
- Wang Baohui, Zheng Jianwei, Huang Dazhuang, Wang Da, Ma Xiangchao, Han Xiaoyong
- 绿僵菌MS01菌株的生物学特性及在不同温湿度下对光肩星天牛幼虫的致病力
- Biological Characteristics of Metarhizium and effects of temperature and humidity on the pathogenicity against Anoplophora glabripennis larvae
- 林业科学, 2009, 45(9): 158-162.
- Scientia Silvae Sinicae, 2009, 45(9): 158-162.
-
文章历史
- 收稿日期:2008-06-25
-
作者相关文章
2. 浙江大学昆虫科学研究所 杭州 310029
2. Institute of Insect Sciences of Zhejiang University Hangzhou 310029
光肩星天牛(Anoplophora glabripennis)是我国重要的多食性蛀干害虫,已造成经济、生态、社会效益的重大损失(张星耀等,2003; 萧刚柔,1992),长期以来,我国投入了大量的人力物力用于防治光肩星天牛(孙福在等,1997;张波等,1999;张永安等,2003),但对光肩星天牛等害虫的有效生物防治方法并不多。而绿僵菌(Metarhizium)是最常用的广谱性虫生真菌,目前绿僵菌已广泛用于多种农林害虫的防治,特别在蝗虫、金龟子、白蚁等害虫研究工作做得比较深入(程美真等,1995;王四宝等,2003;赵文琴等,2005;何学友等,2008;陈祝安等,1995;Ihara et al., 2003;Shimizu et al., 2003),并取得良好效果,但关于利用绿僵菌防治光肩星天牛方面并无系统研究。绿僵菌虽能寄生多种昆虫,但不同来源的菌株不仅具有一定的寄主专化性,其生物学特性及致病力也存在一些差异(蒲蛰龙,1994;宋漳,2001;Jenkins et al., 1994;Amritha De Croos et al., 1999),其致病力主要取决于菌株、害虫虫态以及环境条件等多种因素,温度、湿度是影响其毒力的2个最重要的环境因子。因此,在具体工作中,研究目的菌株的生物学特性及其寄主范围,对生产和应用该菌株进行生物防治具有重要意义。为此,本试验选择了一株对光肩星天牛具有高致病力的绿僵菌MS01菌株,主要研究了不同培养基、温度、湿度条件对菌落生长、产孢以及孢子萌发的影响,并在不同温湿度条件下测定了该菌株对光肩星天牛幼虫的致病力,为开发和应用该菌株提供理论依据。
1 材料与方法 1.1 材料供试菌株:从分离纯化的9个绿僵菌菌株中筛选出对光肩星天牛幼虫具有高毒力的绿僵菌MS01。供试昆虫:室内饲养成虫,其产卵孵化后的70天龄幼虫用于致病性测定。
1.2 培养基选用5种培养基配方,Cazpek:NaNO33 g·L-1,K2HPO41 g·L-1,MgSO4·7H2O 0.5 g·L-1,KCl 0.5 g·L-1,FeSO4·7H2O 0.01 g·L-1,蔗糖30 g·L-1,琼脂15 g·L-1;PDA:马铃薯200 g·L-1,葡萄糖20 g·L-1琼脂15~20 g·L-1;PPDA:PDA添加10 g蛋白胨;SDAY:10 g·L-1,葡萄糖40 g·L-1,酵母膏2 g·L-1,琼脂15~20 g·L-1;SMAY:SDAY中用麦芽糖代替葡萄糖。
1.3 绿僵菌MS01菌株孢子悬浮液配制烧杯中放入营养液后再加入吐温-80使其终质量浓度为1 g·L-1,再用接种环蘸取培养好的绿僵菌MS01菌株的孢子,用磁力搅拌器搅拌20 min,把悬浮液中的孢子搅拌均匀,孢子悬浮液浓度为108个·mL-1。
1.4 绿僵菌MS01菌株生物学测定1)菌落的营养生长 用直径为5 mm的打孔器在培养相同时间的菌落边缘取新鲜菌落块,接移到平板培养基上,并置于不同温度、湿度、光照和紫外线下培养,用十字交叉法每2天测量1次菌落直径,每处理设5个重复,共观测14天。根据最终菌落的大小考察不同培养基、温度和湿度对菌落生长快慢的影响,对生长曲线进行回归分析,用SPSS软件做差异显著性分析。
2)菌落的产孢量 在培养基上培养14天的菌落,用直径为5 mm的打孔器在距离培养皿中心相同的位置取菌块,然后放入小烧杯中,加0.1%吐温-80的无菌水20 mL,经磁力搅拌器搅拌均匀,用血球计数板测定孢子数,计算产孢量。产孢量差异采用单因素方差分析,根据菌株的生长速度及产孢能力综合评价该菌株的性能。
3)温度对孢子萌发的影响 采用悬滴法,取40 μL配好的孢子悬浮液到凹玻片上,加盖玻片在培养皿中用无菌水浸透脱脂棉保湿(RH=100%),置于不同温度(15,20,22,25,26,28,30,35 ℃)下恒温培养,培养8 h后镜检,此后每隔5 h镜检1次,镜检统计孢子萌发情况。试验中的每个处理均设3个重复,每个重复检查5个视野,每个视野不少于80个孢子。
4)湿度对孢子萌发的影响 利用各种饱和盐溶液在密闭条件下控制湿度。不同饱和盐的相对湿度为:蒸馏水100%,K2SO495%,FeSO4·7H2O 90%,KCl 85%,NaNO375%。取40 μL配好的孢子悬浮液到凹玻片上,加盖玻片在培养皿中,用浸有不同盐溶液的脱脂棉代替无菌水脱脂保湿,培养皿用封口膜密封,在28 ℃恒温培养。观察统计方法同上。
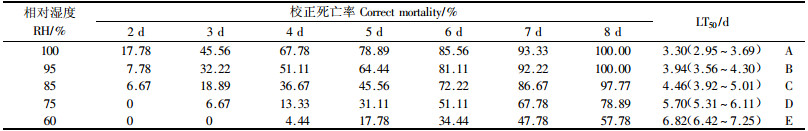
1.5 不同温、湿度下绿僵菌MS01菌株对光肩星天牛幼虫的致病力选择饲养时间相同虫体大小一致的光肩星天牛幼虫,采用浸渍法,将幼虫在108个·mL-1的绿僵菌孢子悬浮液中浸蘸30 s左右,使孢子附着在虫体表面,将接菌的幼虫接到柳树枝条的人工刻槽中,重复3次,同时设一组只用吐温-80无菌水的处理作为对照,每处理30头虫,在不同温度、湿度下培养枝条,每天观察记录光肩星天牛幼虫死亡情况,并捡出死虫。以开始大量取食木材并产生新的蛀道为正常存活。试验完成后将各处理总虫量,死亡量等数据输入POLO机率分析系统(Russell et al., 1977),计算致死时间。

|
校正最终的死亡率,以剔除其他因素造成的死亡对试验结果的影响,对照未死亡及其死亡率低于5%的不进行校正。以校正死亡率和致死时间考察温度、湿度对该菌株致病力的影响。
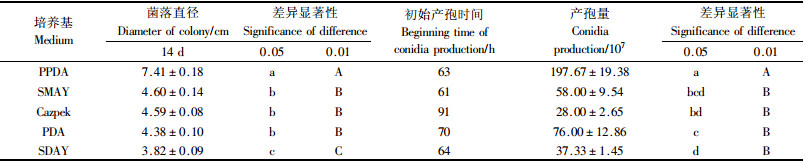
2 结果与分析 2.1 不同培养基和温、湿度对绿僵菌MS01菌株营养生长和产孢的影响1)培养基对菌株营养生长和产孢的影响 将MS01菌株在5种虫生真菌培养基上培养,测定其菌落生长直径,14天后测定产孢量,结果见表 1。从表 1可以看出,MS01菌株在PPDA培养基上菌落生长最快,14天时菌落直径为(7.41±0.18)cm,极显著大于其他4种培养基上的菌落直径,该菌株在PPDA培养基上初始产孢时间也较早,产孢量最高,极显著高于其他4种培养基上的产孢量,且在本试验中也观察到该菌株在PPDA培养基上生长时菌落非常厚、密,所以认为该培养基对MS01菌株的营养生长和产孢均是最有利的,因此以下环境因素对菌株营养生长和产孢量的影响均采用PPDA培养基进行测定。其次是在SMAY、Cazpek和PDA培养基上,MS01菌株在这3种培养基上的生长量无显著性差异,但在PDA培养基上的产孢量要显著高于Cazpek培养基。MS01菌株最不适宜在SDAY上生长,菌落直径极显著低于其他处理,产孢量也较少。
|
|
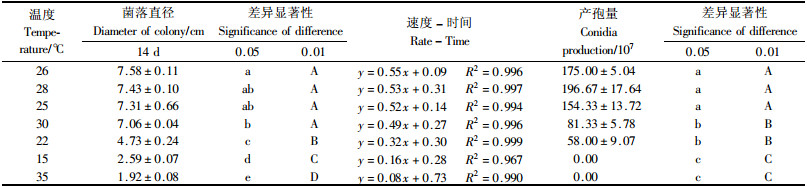
2)温度对菌株营养生长和产孢的影响 温度对绿僵菌MS01菌株营养生长和产孢的影响结果见表 2。从表中可以看出,该试验菌株具有较宽的温度生长范围,在测试的温度范围内(15~35 ℃)均可生长,但不同温度下该菌株营养生长量和产孢情况明显不同。绿僵菌MS01菌株在26 ℃条件下营养生长量最大,生长速度与时间呈较好的线性关系(R2>0.90),该温度下菌株的斜率最大,说明生长速度最快。从表中可以看出:此温度下产孢量也较高,其次为28和25 ℃条件下,三者之间营养生长和产孢量差异均不显著,但显著高于30 ℃条件下的生长量、生长速率和产孢量,极显著高于22,15和35 ℃条件下的生长量,在15和35 ℃条件下,菌落生长都很缓慢,几乎不产孢,其生长量存在极显著差异。试验中还可观察到26 ℃下菌落的菌丝浓密、粗壮,所以绿僵菌MS01菌株营养生长的最适温度为26 ℃,产孢最适温度为25~28 ℃,温度过高或过低均不利于产孢。
|
|
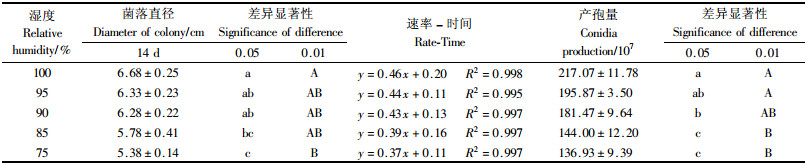
3)湿度对菌株营养生长和产孢的影响 湿度对MS01菌株营养生长和产孢的影响结果见表 3。从表中可以看出,相对湿度为100%和95%条件下,该菌株的生长量、生长速率和产孢量均较大,且在试验中可见在此湿度下得菌丝生长也优于其他处理,相对湿度为90%条件下与以上2个处理间的菌落生长量和生长速率均无显著差异,但产孢量显著低于100%条件下的产孢量,在相对湿度为75%条件下的菌落生长量、生长速率和产孢量均小于其他处理,由此认为,绿僵菌MS01菌株营养生长和产孢的最适相对湿度为95%~100%。
|
|
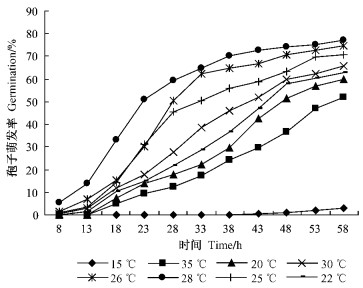
1)温度的影响 从图 1可以看出,温度对孢子萌发有明显影响。从最终萌发率看,28,26,25 ℃条件下,该菌株孢子萌发率均在70%以上,明显高于其他温度下孢子萌发率,30,22,20,35 ℃条件下,孢子萌发率约为50%~65%,15 ℃条件下萌发率最低,仅为3%,即随着温度的升高孢子的萌发速度和萌发率均随之增高,28 ℃时达到峰值,当温度超过28 ℃后又开始降低。从起始萌发时间看,MS01菌株在28 ℃下早于8 h即可萌发,25,26,30 ℃条件下,该菌株孢子起始萌发时间约在8 h左右,22 ℃条件下孢子在13 h左右萌发,20和35 ℃下,该菌株起始萌发时间在13~18 h之间,15 ℃下孢子则在43 h左右才开始萌发。28 ℃处理的孢子不仅萌发时间早,萌发速度和萌发率高,而且在试验中还可以观察到该温度条件下孢子萌发后的菌丝长且粗壮,明显比其他处理生长好。因此,绿僵菌MS01菌株孢子萌发的最适温度为28 ℃。
|
图 1 温度对MS01菌株孢子萌发的影响 Figure 1 The effect of temperature on germination of spores of strain MS01 |
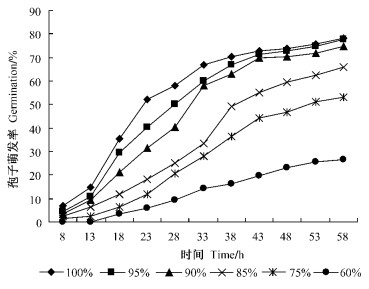
2)湿度的影响 从图 2可以看出,湿度对孢子萌发的影响较大,该菌株在100%相对湿度条件下萌发率最高,为78.33%,95%和90%的湿度下孢子萌发率略低于100%条件下。随着湿度的降低,萌发速度减慢,萌发率也降低。85%和75%湿度下,孢子萌发率分别比饱和湿度下降低了12.66%和25%,相对湿度60%时,仅有26.67%的孢子萌发。因此,绿僵菌MS01菌株孢子萌发的最佳相对湿度应在90%以上,最适湿度为100%,75%以下的湿度不适宜孢子萌发。
|
图 2 湿度对MS01菌株孢子萌发的影响 Figure 2 The effect of RH on germination of spores of strain MS01 |
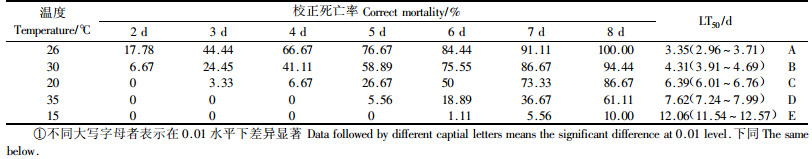
1)温度的影响 从表 4可以看出,光肩星天牛幼虫接种菌株2天后,26 ℃处理和30 ℃处理最先出现死亡,但26 ℃处理死亡率要高于30 ℃处理。随着时间的延长,20,35 ℃处理相继出现死亡,死亡率随着时间的延长也相应升高,第8天时26 ℃处理的光肩星天牛幼虫全部死亡,第10天和11天时30,20 ℃处理达到全部死亡,15 ℃处理的幼虫死亡最慢,19天时才全部死亡,校正后死亡率有所不同。另外,不同温度下致死中时LT50值差异均极显著,26 ℃时LT50值仅为3.35天,极显著短于其他温度下的致死中时。从光肩星天牛幼虫的最终死亡率和致死速度LT50可以看出,绿僵菌MS01菌株在26 ℃时对光肩星天牛幼虫致病力最强,这与该菌在此温度下的营养生长最大、产孢量最多、萌发速度快且萌发率高是一致的。
|
|
2)湿度的影响 从表 5可以看出:随着湿度的降低,染菌的光肩星天牛幼虫死亡率也随之降低,致死中时相应增大。相对湿度100%的处理致死速度最快,8天时即达到全部死亡,经培养虫尸上均有绿僵菌菌丝及分生孢子出现,LT50值为3.30天,极显著低于其他湿度下的致死中时,其次为相对湿度95%的处理,8天时光肩星天牛幼虫也全部死亡,LT50值为3.94天,而其余3个处理的幼虫已开始大量取食并已产生新的蛀道。经校正各处理的最终死亡率存在极显著差异。从致死时间和死亡率可以看出相对湿度为100%的条件下绿僵菌MS01菌株的致病力最强。
|
|
营养对昆虫病原真菌菌株生长和产孢有很大影响,本试验结果表明绿僵菌MSO1菌株在PPDA培养基上营养生长最好,产孢量也最高,这与有关文献(詹儒林等,2007)记载是一致的。本文结果表明:该菌株在26 ℃下营养生长最好,28 ℃下产孢量最高,孢子萌发速度最快,萌发率最高。绿僵菌分生孢子的萌发和菌丝的生长,均要求较高的湿度,该菌株在相对湿度95%~100%的条下生长最好,在100%湿度下孢子萌发速度最快、萌发率最高。当湿度低于90%时,孢子萌发速度慢,萌发率也大大降低。本试验结果对于培养该菌株获得大量的孢子,广泛应用于生产有一定的指导意义。
温、湿度对菌株的致病力的影响,由于光肩星天牛幼虫的体温有一定的自我调节能力,本试验选取了具有环境代表的5个温度梯度。光肩星天牛是在枝条内培养,在控制其环境湿度的时候要比孢子萌发试验中湿度的控制难度大,且误差也比较大,因此设置了5个湿度水平。结果表明:在26 ℃时光肩星天牛幼虫死亡率能达到全部死亡,所用时间比较短,LT50值为3.35 d,这与26 ℃时该菌的萌发速度快、萌发率高是相一致的。而湿度对致病力的影响与湿度对孢子萌发的影响不太一致,在较低的湿度条件下,绿僵菌MSO1菌株也表现为较高的致病力,一方面是由于,水培的枝条生长吸收水分,运输的水分使其内部小环境比实际环境中的湿度要高,从而有助于孢子萌发;另一方面,正如文献(蒲蛰龙,1994)所述,绿僵菌分生孢子萌发和菌丝生长,均需要较高的相对湿度。但侵入昆虫和引发疾病的相对湿度范围则较宽,即使在低于75%的条件下也能有较好的致病力。值得一提的是绿僵菌接种方法采用的是浸渍法,使光肩星天牛幼虫体表在短时间内保持较高湿度,而孢子发芽后,一旦侵入昆虫体腔,即可利用体液中的水分和养料,进行生长繁殖,因此,只要能人为的创造短期的高湿条件,或利用自然环境中的短期高湿条件,如田间全面灌水或抓住雨后,或连续的阴雨天期间使用绿僵菌都可达到理想的效果。对光肩星天牛幼虫来说,其生活环境为较高湿度条件,一般都能满足绿僵菌孢子萌发的要求。在应用绿僵菌控制光肩星天牛幼虫的实践中,施用方法或剂型多种多样,如喷施分生孢子悬浮液于树冠、伐倒原木上、树皮下、产卵刻槽周围以及土壤中,释放带菌的传媒昆虫主动接触侵染天牛,被害树干打孔植入具绿僵菌的麦麸颗粒菌丸,绿僵菌与其他微生物的联合使用、绿僵菌粘膏剂以及带菌无纺布制剂的应用,在孔道内适时注射绿僵菌菌液或菌膏,可以使进入树体的幼虫能接触到菌的孢子或菌丝体,以达到防治该害虫的目的。
本试验测定的结果,指出了适合光肩星天牛高致病性绿僵菌MS01菌株生长以及侵染的培养基和温、湿度条件,为今后的防治工作奠定了一定的基础,但还需要对其他影响因子、田间试验效果作进一步的研究,以便更合理有效的应用该菌株。
陈祝安, 张玉琢, 谢佩华, 等. 1995. 绿僵菌对暗黑金龟蛴螬的室内致病力测定[J]. 中国生物防治, 11(2): 54-55. |
程美真, 张玉琢, 陈祝安, 等. 1995. 绿僵菌防治豆田蛴螬小区试验[J]. 中国生物防治, 11(4): 165-167. |
何学友, 蔡守平, 余培旺, 等. 2008. 金龟子绿僵菌MaYTTR-04菌株对松墨天牛成虫的致病力[J]. 昆虫学报, 51(1): 102-107. DOI:10.3321/j.issn:0454-6296.2008.01.016 |
蒲蛰龙. 1994. 昆虫病理学[M]. 广州: 广东科技出版社, 360-366.
|
宋漳. 2001. 液体深层培养绿僵菌分生孢子的研究[J]. 林业科学, 37(5): 134-139. DOI:10.3321/j.issn:1001-7488.2001.05.023 |
孙福在, 邢炜, 张永祥, 等. 1997. 冰核细菌对光肩星天牛幼虫促冻杀虫的初步研究[J]. 林业科学研究, 10(1): 96-99. DOI:10.3321/j.issn:1001-1498.1997.01.019 |
王四宝, 樊美珍, 李增智, 等. 2003. 松褐天牛天敌微生物的研究进展[J]. 昆虫知识, 40(4): 303-307. DOI:10.3969/j.issn.0452-8255.2003.04.004 |
萧刚柔. 1992. 中国森林昆虫[M]. 北京: 中国林业出版社, 455-457.
|
詹儒林, 覃伟权, 宋妍, 等. 2007. 海南椰心叶甲病原菌金龟子绿僵菌的分离、鉴定及其生防潜力[J]. 生态学报, 27(4): 1558-1562. DOI:10.3321/j.issn:1000-0933.2007.04.036 |
张波, 刘益宁, 岛津光明. 1999. 宁夏天牛病原真菌的种类和致病力研究[J]. 北京林业大学学报, 21(4): 67-72. DOI:10.3321/j.issn:1000-1522.1999.04.014 |
张永安, 王玉珠, 张龙, 等. 2003. 光肩星天牛的新病原—天牛微粒子虫初步研究[J]. 林业科学, 39(2): 171-173. |
张星耀, 骆有庆. 2003. 中国森林重大生物灾害[M]. 北京: 中国林业出版社, 32-33.
|
赵文琴, 樊美珍, 蔡守平, 等. 2005. 不同绿僵菌、白僵菌菌株对铜绿丽金龟幼虫的毒力生物测定[J]. 生物学杂志, 22(5): 43-45. |
Amritha De Croos J N, Bidochka M J. 1999. Effects of low temperature on growth parameters in the entomopathogenic fungus Metarhizium anisopliae Bidochka[J]. CanJMicrobiol, 45: 1055-1061. |
Ihara Fumio, Toyama Masatoshi, Sato Takeru. 2003. Pathogenicity of Metarhizium anisopliae to the chestnut weevil larvae under laboratory and field conditions[J]. Appl Entomol Zool, 38(4): 461-465. DOI:10.1303/aez.2003.461 |
Jenkins N E, Prior C. 1994. Growth and formation of true conidia by Metarhizium flavoviride in a simple liquid medium[J]. Myclogical Resarch, 97(12): 1489-1494. |
Shimizu Susumu, Yamaji Motoko. 2003. Effect of density of the termite, Reticulitermes speratus Kolbe (Isoptera:Rhinotermitidae), on the susceptibilities to Metarhizium anisopliae[J]. Appl Entomol Zool, 38(1): 125-130. DOI:10.1303/aez.2003.125 |
Russell R M, Robertson J L, Savin N E. 1977. POLO: a new computer program for probitanalysis[J]. Bull Entomol Soc Am, (23): 209-213. |
 2009, Vol. 45
2009, Vol. 45