文章信息
- 林同, 张宇宏, 常润磊, 张琪, 温秀军.
- Lin Tong, Zhang Yuhong, Chang Runlei, Zhang Qi, Wen Xiujun
- 松褐天牛泛素基因的克隆及表达
- Cloning and Expression of the Ubiquitin Gene of Monochamus alternatus
- 林业科学, 2009, 45(9): 101-105.
- Scientia Silvae Sinicae, 2009, 45(9): 101-105.
-
文章历史
- 收稿日期:2008-06-24
-
作者相关文章
2. 华南农业大学经济林研究中心 广州 510642
2. Non-Timber Forestry Research Centre, South China Agricultural University Guangzhou 510642
泛素(ubiqutin)是一种由76个氨基酸组成的小分子球状蛋白(Schlesinger et al., 1975; Vijay-Kumar et al., 1987a),1975年由Goldstein等(1975)从兔胸腺中分离得到,后来发现其广泛存在于各种真核生物中(Vierstra, 1993)。由于不同种属来源的这种蛋白质有极其相似的结构,所以命名为泛素。由泛素介导的泛素-蛋白水解酶复合体通路(ubiquitin-proteasome pathway,UPP)是细胞质和细胞核内依赖于ATP的非溶酶体途径的蛋白质降解通路(Glickman et al., 2002),该通路高效并高度选择性地对细胞内的蛋白,尤其是短命的功能蛋白、癌基因产物及变性结构蛋白等进行降解(Li et al., 2003; Wilkinson, 2000)。就目前所知,泛素通过控制这些蛋白的完全或部分降解,有时仅对某些蛋白进行修饰,参与多种生理生化过程,表现出复杂的功能多样性(Von Kampen et al., 1996)。研究表明,泛素体系在生物的细胞周期控制、胁迫反应、细胞内的信号转导和某些器官生长发育和衰老过程中均起着重要作用(Von Kampen et al., 1995; Fujinami et al., 1994),另外还参与细胞转录催化、离子通道、免疫应答以及抗原呈递等多种生命过程(Ciechanover, 2003)。
松褐天牛(Monochamus alternatus)又名松墨天牛、松天牛,属于鞘翅目(Coleoptera)、天牛科(Cerambycidae),是重大森林植物检疫性病害——松材线虫(Bursaphelenchus xylophilus)病的主要媒介昆虫(杨宝君等,2003)。对松褐天牛泛素基因的克隆,将有助于研究其细胞内的各种生理生化反应及其原理和细胞在病理条件下的免疫应答与泛素的相互关系。本研究应用RT-PCR技术,从松褐天牛幼虫克隆了泛素基因,运用生物信息学软件对该基因序列进行序列分析,并实现了原核表达,拟为研究泛素在松褐天牛体内的生理功能奠定基础。
1 材料与方法 1.1 材料 1.1.1 昆虫来源松褐天牛由广东省林业科学研究院提供。
1.1.2 菌株与质粒感受态细胞DH5α购自Tiangen公司,克隆载体pUCm-T和pET-32a(+)分别购自Sangon公司和Novagen公司。
1.1.3 主要试剂核酸分子质量标准、蛋白分子量标准、Taq DNA聚合酶和Universal通用型DNA纯化回收试剂盒、Anti-His Antibody、羊抗鼠IgG-HRP、HRP-DAB底物显色试剂盒为Tiangen公司产品,EZ Spin Column Total RNA Isolation Kit、cDNA第一链合成试剂盒购自Sangon公司。其他试剂均为国产分析纯。
1.2 方法 1.2.1 简并引物设计与合成根据已知的人、果蝇、牛及昆虫等泛素蛋白氨基酸序列的高度保守性,并参考考于航等(2004)、金小宝等(2007)的引物序列,设计一对简并引物。正向引物:5′-ATGCA(AG)AT(CT)TT(CT)GTIAA-3′,氨基酸序列:MQIFVK;反向引物:5′-(AG)CCACCICG(CGA)AGIC(TG)(CGA)A(GA)(CG)AC-3′,氨基酸序列:VLRLRGG。引物由上海生工公司合成,用TE缓冲液稀释至10 μmol·L-1,-20 ℃保存备用。
1.2.2 松褐天牛总RNA的提取取1头松褐天牛,在液氮冷冻条件下将其充分研磨,转入1.5 mL Eppendorf管中,具体操作按EZ Spin Column Total RNA Isolation Kit说明书进行。提取的总RNA置于-70 ℃保存备用。
1.2.3 第一链cDNA的合成在新的0.2 mL Eppendorf管中,加入1.5 μL总RNA(约2 μg),操作按照cDNA第一链合成试剂盒说明书进行。得到的cDNA第一链-20 ℃保存备用。
1.2.4 泛素基因RT-PCR扩增利用简并引物扩增松褐天牛泛素基因,反应体系:25 μL反应体系中含2.5 μL 10×PCR buffer,0.01 μmol each dNTP,10 pmol each primer,1.5 units Taq-Polymerase,约2 ng cDNA。样品先94 ℃预变性3 min,按下述条件进行PCR:94 ℃ 1 min,50 ℃ 1 min,72 ℃ 1 min,30个循环后72 ℃ 10 min,扩增完毕后4 ℃终止反应。
1.2.5 PCR产物的克隆与测序PCR产物经1.2%琼脂糖凝胶电泳后回收、纯化,具体步骤参照DNA纯化回收试剂盒说明书进行。纯化的PCR产物与pUCm-T载体连接,重组子pUCm-T-Ub转化DH 5α大肠杆菌;挑取单个白色菌落于37 ℃过夜培养后抽提质粒,PCR鉴定,由上海Sangon公司测序。
1.2.6 泛素的序列分析与同源模建应用DNAtools软件将所得DNA序列翻译成蛋白质序列,从GenBank数据库中检索并下载昆虫泛素核苷酸及氨基酸序列,用GENEDOC软件比较松褐天牛与其他昆虫泛素的相似性。应用ClustalX和MEGA4软件进行比对并建立泛素的系统发育树;通过SWISS-MODEL(http://swissmodel.expasy.org)进行同源模建,用SWISS-PDBViewer软件观察蛋白三维结构。
1.2.7 原核表达载体的构建根据测序结果设计一对特异引物:含BamHⅠ位点的正向引物:5′-CGGGATCCATGCAGATTTTCGTG-3′,含Hind Ⅲ位点的反向引物:5′-CCCAAGCTTACCACCGCGGAGGCT-3′,以重组质粒pUCm-T-Ub为模板进行PCR扩增,扩增产物经BamHⅠ、HindⅢ双酶切后,与经同样双酶切的表达载体pET-32a(+)连接,构建重组表达质粒pET-32a-ub。
1.2.8 泛素融合蛋白的原核表达及Western blotting检测转化pET-32a-ub到大肠杆菌BL21(DE3)感受态细胞中。在LB/Amp培养基,37 ℃培养至OD600=0.5左右时,加入IPTG至终浓度1 mmol·L-1诱导目的蛋白表达。在37 ℃下分别诱导0,0.5,2,4,8 h后取样,用15% SDS-PAGE电泳检测。将SDS-PAGE电泳的目的蛋白条带转移到硝酸纤维素膜上,封闭液封闭后,以Anti-His Antibody为一抗,羊抗鼠IgG-HRP为二抗与之反应,最后用HRP-DAB底物显色试剂盒显色。
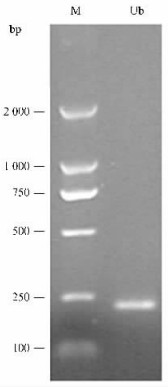
2 结果与分析 2.1 RT-PCR扩增及重组质粒鉴定根据真核生物泛素蛋白N-端和C-端高度保守的氨基酸序列MQIFVK和VLRLRGG,设计一对简并引物,通过RT-PCR方法扩增松褐天牛泛素基因编码区。RT-PCR产物经1.2%琼脂糖凝胶电泳检测,发现获得了大小约为230 bp的片段(图 1)。回收该片段,将其与克隆载体pUCm-T连接。挑选阳性克隆,提取质粒DNA,PCR鉴定,1.2%琼脂糖凝胶电泳检测,所得片段长度位置与预测一致。
|
图 1 RT-PCR产物 Figure 1 RT-PCR product M: D2000分子质量标准D2000 marker; Ub: RT-PCR产物RT-PCR product. |
将PCR鉴定正确的重组质粒送交上海Sangon公司测序,测序结果表明,松褐天牛泛素基因开放阅读框长度为228 bp,编码76个氨基酸(图 2),预计编码蛋白的分子质量8.49 ku,等电点为5.83 (GenBank登录号为EU433567)。

|
图 2 松褐天牛泛素基因核苷酸序列及推导的氨基酸序列 Figure 2 Nucleotide and deduced amino acid sequence of the coding sequence of M.alternatus ubiquitin gene |
运用GENEDOC软件对松褐天牛泛素与其他昆虫泛素的氨基酸序列进行比较的结果见图 3。可以看出,松褐天牛泛素与其他昆虫泛素的氨基酸序列极其相似,仅有1~4个氨基酸不同,它与甜菜夜蛾(Spodoptera exigua)、野桑蚕(Bombyx mandarina)相似性94%,与草地贪夜蛾(Spodoptera frugiperda)相似性96%,与美洲大蠊(P.americana)、家蚕(B.mori)相似性97%,与黑腹果蝇(D.melanogaster)、斜纹夜蛾(S.litura)、德国小蠊(B.germanica)、棉铃虫(H.armigera)、烟草天蛾(T.hawkmouth)相似性98%。所有已知与泛素功能相关的位点在松褐天牛泛素蛋白序列中均存在。11种昆虫的泛素基因基于核苷酸的系统进化树见图 4。

|
图 3 松褐天牛与其他昆虫泛素蛋白氨基酸序列比较 Figure 3 Alignment of the amino acid sequence of insect ubiquitin proteins M.a:松褐天牛M. alternatus; S.f:草地贪夜蛾Spodoptera frugiperda (GenBank Accession No. M30306); D.m:黑腹果蝇D. melanogaster(No. X59943); S.l:斜纹夜蛾S. litura (No. AF436066); B.g:德国小蠊B. germanica (No. AY501003): P.a:美洲大蠊P.americana (No. EF101563); S.e:甜菜夜蛾Spodoptera exigua (No.AY149883); T.h:烟草天蛾T. hawkmoth (No. X53524); B.ma:野桑蚕Bombyx mandarina (No. DQ839401): H.a:棉铃虫H. armigera (No.AY456195); B.m:家蚕B. mori (No. AF308163).下同The same below. |

|
图 4 松褐天牛与其他10种昆虫泛素的进化树示意图 Figure 4 The cladogram of M. alternatus ubiquitin and insect ubiquitin genes |
11种昆虫泛素基因基于核苷酸序列的NJ(Neighbor-Joining)无根系统发育树(500次抽样)见图 4。其中,松褐天牛与斜纹夜蛾、草地贪夜蛾遗传距离较近、关系密切,与棉铃虫、美洲大蠊、德国小蠊在同一分支下,与其他5种昆虫的遗传距离较远。
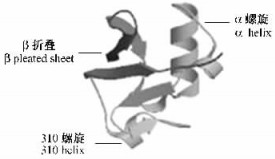
2.4 松褐天牛泛素的同源模建利用SWISS-MODEL服务器进行同源模建,以人的泛素基因为模版,获得松褐天牛泛素的理论三维结构,与目标结构一致性达到99%。松褐天牛泛素含有1个3圈半的α螺旋、1个310-螺旋、5个β折叠和7个反向转角(图 5)。
|
图 5 松褐天牛泛素蛋白理论三维结构 Figure 5 The theoretical three-dimensional structure of M. alternatus ubiquitin protein |
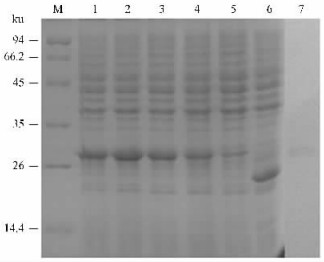
将所克隆的泛素基因重组入pET-32a(+),构建原核表达质粒pET-32a-ub,经PCR鉴定正确后,将重组质粒转化入BL21(DE3)菌株。经IPTG诱导表达蛋白,取0,0.5,2,4,8 h时间段的菌液进行15% SDS-PAGE电泳,表达的融合蛋白在28.5 ku左右有明显的特异条带产生,其积分光密度(IOD)百分比分别为:11.6%,24.8%,29.8%,36.4%,36.5%。而未插入泛素基因的pET-32a(+)表达的蛋白在约20 ku处有特异性条带出现,其积分光密度百分比为32.2%(图 6),与预测的分子质量大小吻合,Western blotting分析验证了重组蛋白可以被6个组氨酸标签的特异抗体识别,表明松褐天牛泛素融合蛋白得到了有效表达。
|
图 6 IPTG诱导表达蛋白的SDS-PAGE电泳分析 Figure 6 SDS-PAGE analysis of M. alternatus ubiquitin expressed in E.coli M:蛋白分子质量标准Protein molecular standard maker; 泳道1~5 Lane 1~5:分别为IPTG诱导下8, 4, 2, 0.5, 0 h的表达产物Expression of pET-32a-ub by IPTG induction for 8, 4, 2, 0.5 and 0 hours respectively; 泳道6 Lane 6:在IPTG诱导下pET-32a (+)的表达Expression of pET-32a (+) by IPTG induction; 泳道7 Lane 7:免疫印迹Western blotting. |
自20世纪80年代初以来,泛素及泛素-蛋白水解酶复合体通路一直是生物学领域研究的一个热点(涂洪涛等,2006)。目前,泛素基因的研究不仅在高等动物和植物中,昆虫泛素基因的研究也越来越受到关注。已报道的有草地贪夜蛾(Guarino, 1990)、烟草天蛾(Bishoff et al., 1990)、甜菜夜蛾(牛国栋等, 2004)、棉铃虫(李朝飞等,2005)、野桑蚕(陈正凯等, 2007)等,但有关松褐天牛泛素基因的克隆仍未见报道。
对植物、酵母、动物的泛素分析表明,他们的一级结构仅有1~3个氨基酸残基不同(Vietstra et al., 1985),三维构象也基本相似,N-末端为较紧密的球状结构域,而C-末端则是松散的伸展结构(Vijay-Kumar et al., 1987b),具有高度的保守性。
本研究中克隆的松褐天牛与已知的其他昆虫泛素基因的氨基酸序列有1~4个氨基酸的不同,在氨基酸水平上具有94%以上的相似性。系统进化树显示,松褐天牛与斜纹夜蛾、草地贪夜蛾遗传距离较近、关系密切。通过对松褐天牛泛素蛋白结构的同源建模,发现其蛋白结构非常保守,少量氨基酸的变异并没有引起三维结构的大规模改变,与人的泛素蛋白三维结构几乎相同。
本试验选用的pET-32a(+)是由T7启动子启动的高效融合表达载体,其N端含有109个氨基酸的硫氧还蛋白和6个组氨酸标签,当没有外源基因插入时,可自行表达相对分子质量约为20 ku的蛋白;天牛泛素蛋白的预测分子质量为8.49 ku,本试验在SDS-PAGE电泳的28.5 ku处有一增粗条带,因此为本实验的目的蛋白。而且,积分光密度结果显示,37 ℃下IPTG诱导蛋白表达量呈递增趋势,且表达速度很快,4,8 h时间段所表达的蛋白量相当,较0.5,2 h时间段有明显提高,这说明载体在4 h时表达量最高,对泛素基因的表达具有高效性。笔者正在通过免疫家兔制备松褐天牛泛素的抗血清,接下来将研究泛素基因在该昆虫体内不同组织或器官、以及在不同发育阶段的表达情况及其免疫学特性。
陈正凯, 周君, 包立军, 等. 2007. 野桑蚕泛素基因的克隆及原核表达[J]. 蚕业科学, 33(2): 297-231. DOI:10.3969/j.issn.0257-4799.2007.02.026 |
金小宝, 刘雷山, 朱家勇, 等. 2007. 美洲大蠊泛素基因的克隆及生物信息学分析[J]. 中国病原生物学杂志, 2(5): 371-373. |
李朝飞, 于航, 潘丽晶, 等. 2005. 棉铃虫泛素基因的克隆及序列分析[J]. 中山大学学报:自然科学版, 44(1): 61-64. |
牛国栋, 张海元, 张忠信. 2004. 甜菜夜蛾泛素延伸蛋白基因cDNA的3′ RACE-PCR扩增及其克隆和表达[J]. 昆虫学报, 47(2): 166-170. DOI:10.3321/j.issn:0454-6296.2004.02.005 |
涂洪涛, 安世恒, 郭线茹, 等. 2006. 烟夜蛾泛素延伸蛋白基因的克隆与表达[J]. 农业生物技术学报, 14(6): 884-888. DOI:10.3969/j.issn.1674-7968.2006.06.012 |
杨宝君, 潘宏阳, 汤坚, 等. 2003. 松材线虫病[M]. 北京: 中国林业出版社, 1-263.
|
于航, 金丰良, 许小霞, 等. 2004. 德国小蠊泛素基因的克隆及序列分析[J]. 昆虫学报, 47(4): 522-525. DOI:10.3321/j.issn:0454-6296.2004.04.018 |
Bishoff S T, Schwartz L M. 1990. Characterization of a ubiquitin-fusion gene from the tobacco hawkmoth, Manduca sexta[J]. Nucleic Acids Res, 18(20): 6039-6043. DOI:10.1093/nar/18.20.6039 |
Ciechanover A. 2003. The ubiquitin proteolytic system and pathogenesis of human diseases: A novel planform for mechanism-based drug targeting[J]. Biochemical Society Transactions, 31(2): 474-481. DOI:10.1042/bst0310474 |
Fujinami K, Tanahashi N, Tanaka K, et al. 1994. Purification and characterization of the 26S proteasome from spinach leaves[J]. J Biol Chem, 296: 25905-25910. |
Goldstein G, Scheid M, Hammerling U, et al. 1975. Isolation of a polypeptide that has lymphocyte-differentiating properties and is probably represented universally in living cells[J]. Proc Natl Acad Sci USA, 72(1): 11-15. DOI:10.1073/pnas.72.1.11 |
Guarino L A. 1990. Identification of a viral gene encoding a ubiqutin-like protein[J]. Proc Natl Acad Sci USA, 87(1): 409-413. DOI:10.1073/pnas.87.1.409 |
Li Z, Gong Y, Yin C, et al. 2003. Characterization of anovel ubiquitin fusion gene Uba256 from Spodoptera litura nucleopolyhe-drovirus[J]. Gene, 303: 111-119. DOI:10.1016/S0378-1119(02)01140-X |
Schlesinger D H, Goldstein G. 1975. Molecular conservation of 74 amino acid sequence of ubiquitin between cattle and man[J]. Nature, 255: 423-424. DOI:10.1038/255423a0 |
Vierstra B D. 1993. Protein degradation in plants[J]. Annu Rev Plant Physiol Plant Mol Biol, 44: 385-410. DOI:10.1146/annurev.pp.44.060193.002125 |
Vierstra B D, Langan S M, Hass A L, et al. 1985. Purification and initial characterization of ubiquitin from higher plant Avena sativa[J]. J Biol Chem, 260: 12015-12021. |
Vijay-Kumar S, Bugg C E, Cook W J. 1987a. Structure of ubiquitin refined at 1.8 A resolution[J]. Journal of Molecular Biology, 194: 531-544. DOI:10.1016/0022-2836(87)90679-6 |
Vijay-Kumar S, Buggs C E, Wilkinson K D, et al. 1987b. Comparison of the three-dimensional structures of yeast and oat ubiquitin with human ubiquitin[J]. J Biol Chem, 262: 6396-6399. |
Von Kampen J, Nielander U, Wettern M. 1995. Expression of ubiquitin genes in Chlamydomonas reinhardtii: involvement in stress response and cell cycle[J]. Planta, 197: 528-534. DOI:10.1007/BF00196675 |
Von Kampen J, Wettern M, Schulz M. 1996. The ubiquitin system in plants[J]. Physiol Plant, 97: 618-624. DOI:10.1111/ppl.1996.97.issue-3 |
Wilkinson K D. 2000. Ubiquitination and deubiquitination: targeting of proteins for degradation by the proteasome[J]. Semin Cell Dev Biol, 11: 141-148. DOI:10.1006/scdb.2000.0164 |
 2009, Vol. 45
2009, Vol. 45

