文章信息
- 孙一荣, 朱教君, 于立忠, 王凯.
- Sun Yirong, Zhu Jiaojun, Yu Lizhong, Wang Kai
- 不同光强下核桃楸、水曲柳和黄菠萝的光合生理特征
- Photosynthetic Characteristics of Juglans mandshurica, Fraxinus mandshurica and Phellodendron amurense under Different Light Regimes
- 林业科学, 2009, 45(9): 29-35.
- Scientia Silvae Sinicae, 2009, 45(9): 29-35.
-
文章历史
- 收稿日期:2008-08-05
-
作者相关文章
2. 中国科学院研究生院 北京 100039
2. Graduate School of Chinese Academy of Sciences Beijing 100039
光是影响植物生存、生长、生殖和分布最重要的环境因子之一,光对植物的直接影响体现在光合生理方面。随着生长光环境的变化,植物比叶重(LMA)、光合特性和叶绿素荧光特性均发生变化(冯玉龙等,2002;2003;Han et al., 1999;Kitao et al., 2000;Lusk et al., 2000;Pearcy et al., 1994;Schloles et al., 1997;Valladares et al., 2000)。生长在低光强下的植物具有低的核酮糖-1,5-二磷酸羧化酶(Rubisco)活性、低的净光合速率(Pn)和低的LMA(Anderson,1986;Kremer et al., 1999;Stitt et al., 1994);相反,生长在高光强下的植物由于具有多层的栅栏组织,因而LMA升高(Vats et al., 2002)。长时间生长在高光强下,植物光合机构会受到破坏(Zhang et al., 2003)。研究植物对光强响应的光合生理有助于理解植物对光环境的适应机制。
光环境是决定森林群落演替过程与速度的重要因子之一(张进忠等,2005),尤其在次生林演替过程中,光环境直接影响植物种间的相互替代(Bazzaz,1979;杨小波等,1999)。20世纪80年代初,美国植物生理生态学家Bazzaz在总结前人研究的基础上,通过对从演替先锋群落到顶级群落一些主要物种的生理生态特性的比较解释植物群落演替的机制(Bazzaz,1979;1980; Bazzaz et al., 1987),认为研究植物生理生态特性是研究植物群落演替的本质,是解释植物群落演替机制的新途径。
群落演替的不同阶段不仅物种组成不同,而且物种的生理生态特性及其对环境的适应性有很大差别。Ellsworth等(1996)通过对亚马逊河流域热带雨林次生演替过程的研究,认为植物演替过程中先锋群落和顶级群落代表性植物叶片的结构性状和功能性状有较大差异。赵平等(2003)通过设计模拟环境试验阐明了植物群落演替阶段代表性植物对光环境的适应性存在明显差异。
核桃楸(Juglans mandshurica)、水曲柳(Fraxinus mandshurica)和黄菠萝(Phellodendron amurense)是东北东部山区顶级群落(阔叶红松林)的主要阔叶树种,核桃楸和黄菠萝属于喜光树种,水曲柳在某种程度上属于“喜湿耐荫”树种,幼年尤其如此。但是,在郁闭林分中,这些树种的幼苗、幼树都生活在一种光照不足的逆境之中,影响其生长发育的主要因子是光环境。本文以东北东部山区森林演替过程中的主要树种核桃楸、水曲柳和黄菠萝(2年生幼苗)为材料,对其叶片气体参数和叶绿素含量进行系统观测,研究其对光强的适应机制,从光合生理角度出发,旨在探讨3个树种幼苗对不同光环境响应的机制,同时为进一步研究不同光强对植物幼苗光合生理的控制机制提供科学依据。
1 研究地区概况试验在中国科学院沈阳应用生态研究所清原森林生态实验站(清原站)进行。该站位于辽宁省东部山区清原满族自治县南部(41°51′N,124°54′E,海拔252~1 116 m),该区的气候属于受季风影响的温带大陆性气候,具有冬季寒冷而漫长、夏季温暖多雨而短暂的特点。年平均气温3.9~5.4℃,大于10 ℃的年活动积温2 800~3 100℃,最冷月为1月,最热月为7月,极端最高气温为36.5℃,最低为-37.6℃,无霜期120~139天,平均年日照2 433 h,年降水量700~850 mm。降雨量集中在6,7和8月份,植物生长季在4—9月。该站主要以长白植物区系为主,地带性植被类型为阔叶红松林,建群种主要有红松(Pinus koraiensis)、沙松(Abies holophylla)、鱼鳞松(Picea jezoensis)、蒙古栎(Quercus mongolica)、紫椴(Tilia amurensis)、色木槭(Acer mono)、黄菠萝、核桃楸、水曲柳和枫桦(Betula costata)等。
2 材料与方法 2.1 试验材料与处理核桃楸、水曲柳和黄菠萝幼苗均来自大苏河林场2年的同生群。2007年4月30日,分别选取生长良好、大小一致的40株幼苗,将苗木随机分成4组,每组10株,分别植入4个处理区中,各苗木间保持一定的株行距,确保彼此不相互遮荫。各个处理区的底层装入20 cm厚大田土,上层装入30 cm厚的森林土,森林土取自附近山上表层10 cm的土。在4个处理中,3个处理区设在由高2.5 m铁架搭设的遮荫网内,通过黑色遮荫尼龙网,使得3个遮荫棚内的相对光强(RI)分别为60%(intermedium irradiance,Ⅱ)、30%(low irradiance,LI)、15%(weak irradiance,WI)。在幼苗发芽后(2007年5月11日)遮网,四周通风,以保证其他气象因子与对照一致。另外1个处理为全光(full irradiance,FI),作为对照。
试验期间,在辽东山区的非雨季进行浇水,每周浇水到田间持水量,每处理浇水量相同。雨季不进行浇水。同时进行精细管理,并经常除草和防治病虫害。在6月份3个典型的晴天用Li-Cor Li-190量子传感器测定4个处理区内光合有效辐射,在试验进行时,用HOBO温湿度记录仪测定各处理区内的气温、相对湿度,用时域反射仪(TDR)测定土壤体积含水量。幼苗在4个处理区生长60天后开始测量,光合测定在2007年生长季(8月)进行。
测定时选取不同处理区的3~5株长势基本一致、无病虫害的植株,作为3个重复,选择顶端向下的第5片完全展开叶片测定。所有光合曲线的测定和取样均在3个连续的晴天上午8:30—11:30进行。
2.2 光合日进程的测定采用Li-6400P便携式光合系统(Li-Cor,Inc,USA),采用活体测定,空气流速为500 μmol·s-1,CO2浓度采用外界大气的CO2浓度,约为(350±5)μmol·mol-1。在连续3个晴天7:00—17:00测定,每隔2 h测定1次,全天共测6次,每次测定记录2个稳定数值,全天的光合速率平均值即为日均净光合速率(Pn)。
2.3 光响应曲线的测定使用开放气路,空气流速为500 μmol·s-1,温度为(28±3) ℃,CO2浓度为(350±5) μmol·mol-1,湿度为测定时的外界值;利用Li-6400P的自动测量程序,采用Li-6400P自带的LED光源,光量子通量密度依次设为2 000,500,1 000,800,600,400,200,100,50和0 μmol·m-2s-1。最大光合速率(Pmax)、光补偿点(LCP)、光饱和点(LSP)和暗呼吸速率(Rd)等参数的拟合采用非直角双曲线法(Herrick et al., 1999)。
2.4 CO2响应曲线的测定CO2的响应曲线(Pn-Pi)采用Li-6400P自带的CO2注入系统测定,4个处理的光强设定采用光响应曲线计算的各个树种在4个处理的饱和光强,叶室CO2浓度梯度依次为400,300,200,100,50,400,600,900,1 200,1 500 μL·L-1。在测定过程中,每个CO2浓度下稳定200 s后开始采集数据。羧化效率(CE)采用低CO2浓度下直线回归计算获得(Lambers et al., 1998);Rubisco最大羧化速率(Vcmax)和最大电子传递速率(Jmax)的计算是根据Farquhar生物化学模型(Farquhar et al., 1980)进行拟合。
2.5 叶绿素(Chl)含量和比叶重(LMA)的测定用面积为3.63 cm2的打孔器在成熟叶片上,避开主叶脉,打下10个圆叶片,采用丙酮提取法(Lichtenhaler,1987; 李合生,2000)测定叶绿素a(Chla)、叶绿素b(Chlb)以及类胡萝卜素含量(Car)。用上述同样的方法取得圆叶片,称鲜质量,然后在120℃处理30 min,再在80℃烘干24 h后用电子天平称重,计算单位叶面积的叶干质量(LMA)和单位叶面积的叶鲜质量(LFA)。
2.6 生理生态指标的可塑性计算根据Bazzaz等(1994)和Valladares等(2000)的方法来计算3个树种生理生态指标的可塑性指数PI(plasticity index)=(最大值-最小值)/最大值×100%。
2.7 数据分析采用SPSS 13.0对数据进行描述性统计和正态性检验,然后做相关分析与单因素方差分析(One-way ANOVA),并用LSD法进行多重比较。
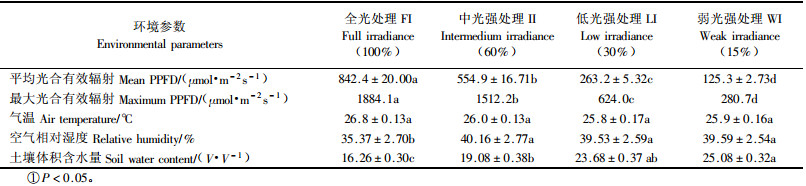
3 结果与分析 3.1 不同光环境处理下的环境参数在6月典型的晴天,经过遮光处理后,4个处理区的光合有效辐射(PPFD)发生了明显的变化,4个处理间的平均和最大PPFD差异显著(P < 0.05),并且处理区之间的PPFD形成一定的梯度层次,FI,II,LI和WI处理区的最大PPFD分别为1 884.1,1 512.2,624.0和280.7 μmol·m-2s-1(表 1)。由于本试验设计为四周透风,每周施水到田间持水量,因此,4个处理区间的气温差异显著(P < 0.05),4个处理区间的相对湿度和土壤含水量十分接近。
|
|
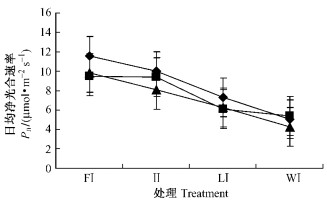
随着光强的减弱,3个树种的日均净光合速率(Pn)总体呈下降趋势(图 1);核桃楸和黄菠萝的Pn呈逐步下降趋势,而水曲柳FI和II处理间的Pn基本一致,在LI处理时急剧下降。
|
图 1 不同生长光强下核桃楸、水曲柳和黄菠萝叶片的日均净光合速率 Figure 1 Mean net photosynthetic rate (Pn) of Juglans mandshurica, Fraxinus mandshurica and Phellodendron amurense under four light intensity treatments —◆—核桃楸Juglans mandshurica, —■—水曲柳Fraxinus mandshuria, —▲— Phelledendron anurense.下同The same below. |
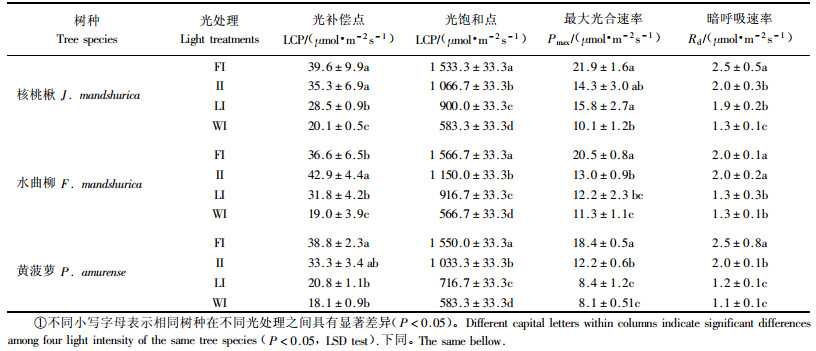
植物光合作用的光饱和点(LSP)和补偿点(LCP)显示植物叶片对强光和弱光的利用能力,代表植物的需光特性和需光量(张旺锋等,2005)。测定结果表明(表 2),随着光强的减弱,核桃楸和黄菠萝的LCP和LSP均呈现下降趋势,水曲柳在II处理的LCP明显高于其他3个处理;3个树种的LSP呈逐步下降趋势,下降幅度基本一致。全光下,水曲柳的LCP(36.6 μmol·m-2s-1)低于核桃楸的(39.6 μmol·m-2s-1)和黄菠萝的(38.8 μmol·m-2s-1),说明水曲柳较2者更能利用弱光,在幼苗时期对弱光的利用能力强。
|
|
最大光合速率(Pmax)也称为光合能力,随着光强的减弱,3个树种的Pmax基本呈下降趋势,在WI处理下,水曲柳的Pmax高于核桃楸和黄菠萝的,亦能说明水曲柳在弱光环境下利用光强的能力;核桃楸的Pmax先在II处理下明显下降,后在LI处理下略微上升,然后再明显下降;水曲柳和黄菠萝的Pmax变化趋势一致,下降幅度亦基本一致。
随着光强的减弱,暗呼吸速率(Rd)均呈现下降趋势,Rd值越大说明植物的呼吸速率越大。全光处理下,水曲柳的Rd低于核桃楸和黄菠萝;并且,水曲柳FI与II处理间的Rd一致。
3.4 不同生长光环境下叶片Rubisco最大羧化速率Vcmax和最大电子传递速率Jmax的变化植物在光强未达到饱和前,叶片净光合速率(Pn)的提高与光强的升高呈线性关系,这时光响应曲线的直线斜率为表观量子产率(AQY)。由表 3可见,3树种弱光处理下的AQY高于全光处理的;核桃楸和黄菠萝的AQY在4个处理间的差异不显著(P>0.05),水曲柳WI处理的AQY与其他3个处理的差异显著(P < 0.05)。
|
|
最大羧化速率Vcmax是指核酮糖二磷酸羧化酶(RuBP)饱和下的最大羧化速率,其与叶片Rubisco的数量和活性成正比(Farquhar et al., 1982)。随着光强的减弱,3树种的Vcmax呈下降趋势;核桃楸和水曲柳在II,LI和WI处理下的Vcmax值为全光处理的70%~80%;黄菠萝WI处理下的Vcmax值为全光处理的40%,下降幅度最大。
最大电子传递速率Jmax能反映RuBP再生的能力,随着光强的减弱,3个树种的Jmax均呈下降趋势;核桃楸和水曲柳WI处理下的值分别为全光处理的72%和64%,黄菠萝的为51%,降低幅度最大。
在环境CO2低分压(Pi < 20Pa)条件下,胞间CO2分压的提高与植物光合速率的上升呈线性关系,此时的直线斜率为羧化效率(CE),CE反映了Rubisco活性的大小(张旺锋等,2005)。随着光强的减弱,3个树种的CE均呈现下降趋势;水曲柳的下降幅度最小,黄菠萝的下降幅度最大。
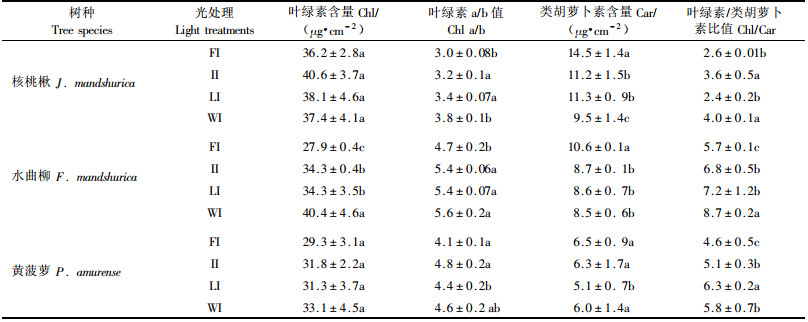
3.5 不同生长光环境下叶片叶绿素Chl和类胡萝卜素Car的变化试验结果表明(表 4),3个树种在全光处理下单位叶面积Chl含量均低于WI的,处理间的差异均未达到显著水平(P>0.05)。随着光强的减弱,3个树种的Car随之下降,核桃楸的下降幅度最大,水曲柳和黄菠萝的下降幅度较小。Chl/Car值随着光强减弱呈升高趋势,说明植物通过调节单位叶面积的Chl和Car含量来积极的适应变化的光环境。
|
|
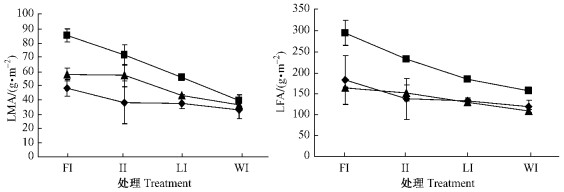
由图 2可以见,随着光强的减弱,3个树种的LMA均呈逐步降低趋势,黄菠萝和核桃楸的降低幅度较小,而水曲柳的降低幅度较大,且水曲柳的LMA均大于核桃楸和黄菠萝的。随着光强的降低,3个树种的单位叶面积鲜质量(LFA)也呈逐步降低趋势,也是以水曲柳的降低幅度最大。全光下,LMA和LFA较大,这意味着相同的叶生物量在全光下形成的叶面积小,叶片厚,这也是植物减少光能捕获,避免光合机构遭受强光破坏的策略之一;弱光下则相反。
|
图 2 不同生长光环境下3个树种叶片LMA和LFA的变化 Figure 2 Changes in leaf dry mass per unit leaf area (LMA) and leaf fresh mass per unit leaf area (LFA) under different light intensity treatments |
根据Bazzaz等(1994)和Valladares等(2000)的方法,计算3个树种生理生态指标的可塑性,结果表明:3个树种生理生态指标的可塑性指数大小顺序为黄菠萝>水曲柳>核桃楸(分别为51.09,41.05和40.97)。3个树种间的PI差异不显著(P>0.05)。
4 讨论本研究中,随着光强的减弱,3树种的Pmax呈现下降的趋势;在全光FI下,核桃楸的Pmax最大;另外,核桃楸的Rd也最小,水曲柳最大(表 2);植物叶片的光合特征对不同光强水平表现出显著的适应性(Evans,1989; Field et al., 1986),本研究结果表明核桃楸表现出强阳性树种的光合特征,全光下具有高的Pmax和低的Rd在WI处理下,水曲柳的Pmax要大于核桃楸和黄菠萝,说明水曲柳能利用较低的光强,具有一定的耐荫性。通常阳性植物都表现出较高的Vcmax(Farquhar et al., 1982),全光处理下,核桃楸的Vcmax最高,水曲柳最低;当光强为全光15%(WI处理)时,核桃楸的Vcmax仍高于其他2个树种;也能说明核桃楸具强阳性树种的特点。
植物对光能的利用主要包括光化学反应转化光能和非光化学热能耗散(Warre,2004),前者主要是叶绿素吸收光能,后者是对过剩光能的耗散。植物对过剩光能的耗散有2种途径:一是Car保护光系统耗散过剩光能。本研究中,全光FI处理下叶片单位叶面积的叶绿素Chl含量均低于WI处理,3个树种的Car随着光强的减弱而下降;Chl/Car比值随着光强减弱呈升高趋势(表 4)。有研究表明:遮光下的叶片具有高的Chl/Car比值(Baig et al., 2005; Feng et al., 2004),原因是Car起着保护光系统耗散过剩光能的作用,在强光环境中,Car的含量相对低光环境中的叶片高,这对防御强光下的光抑制、光破坏可能起到一定的作用;Chl起着吸收光能的作用,叶片在低光环境中要充分的吸收光能,因此含量相对较高(Bertamini et al., 2006)。二是单位叶面积上叶片生物量的分配也是一种适应光环境的策略。本研究中,随着光强的减弱,3个树种的LMA均呈逐步降低趋势(图 2);全光下LMA和LFA较高,具有较厚的叶片,减缓了光在叶片内部的传导等,这样利于叶片避免强光对光合机构的破坏;弱光环境下,LMA和LFA较低,植物通过扩展叶片来获取不足的光强。
本文研究结果支持水曲柳在幼苗时期具有一定耐荫性的观点。核桃楸和黄菠萝同属于强阳性树种,但是,黄菠萝生理生态指标的PI均值大于核桃楸的,说明黄菠萝能适应更宽的光强幅度;由表 2,3,4可以看出,以全光下的生理生态指标为参照,在II,LI和WI处理下下降的顺序:黄菠萝大于核桃楸,由此说明2者的需光性顺序:黄菠萝>核桃楸。本文研究结果亦能证明,生理生态学上的适应在3个树种光适应策略方面起到了重要的作用。
本研究对东北次生林主要树种生理生态指标在不同光环境下变化特征进行了系统的比较分析,初步探讨了该研究区树种幼苗对光环境的响应,以期为该区树种演替规律提供全面的生理生态学解释。
冯玉龙, 曹坤芳, 冯志立. 2002. 生长光强对4种热带雨林树苗光合机构的影响[J]. 植物生理与分子生物学报, 28(2): 153-160. |
冯玉龙, 张亚杰, 朱春全. 2003. 根系渗透胁迫时杨树光合作用光抑制与活性氧的关系[J]. 应用生态学报, 14(8): 1213-1217. DOI:10.3321/j.issn:1001-9332.2003.08.002 |
李合生. 2000. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社.
|
杨小波, 王伯荪. 1999. 森林次生演替优势种苗木的光可塑性比较研究[J]. 植物学通报, 16(3): 304-309. DOI:10.3969/j.issn.1674-3466.1999.03.019 |
张进忠, 林桂珠, 林植芳, 等. 2005. 几种南亚热带木本植物光合作用对生长光强的响应[J]. 热带亚热带植物学报, 13(5): 413-418. DOI:10.3969/j.issn.1005-3395.2005.05.009 |
张旺锋, 樊大勇, 谢宗强, 等. 2005. 濒危植物银杉幼树对生长光强的季节性光合响应[J]. 生物多样性, 13(5): 387-397. DOI:10.3321/j.issn:1005-0094.2005.05.003 |
赵平, 曾小平, 彭少麟. 2003. 植被恢复树种在不同实验光环境下叶片气体交换的生态适应特点[J]. 生态学杂志, 22(3): 1-8. DOI:10.3321/j.issn:1000-4890.2003.03.001 |
Anderson J M. 1986. Photoregulation of the composition, function and structure of thylakoid membranes[J]. Annual Review of Plant Physiol, 37: 93-136. DOI:10.1146/annurev.pp.37.060186.000521 |
Baig M J, Anand A, Mandal P K, et al. 2005. Irradiance influences contents of photosynthetic pigments and proteins in tropical grasses and legumes[J]. Photosynthetica, 43(1): 47-53. DOI:10.1007/s11099-005-7053-5 |
Bazzaz F A. 1979. The physiological ecology of plant succession[J]. Annual Review Ecology and Systematics, 10: 351-371. DOI:10.1146/annurev.es.10.110179.002031 |
Bazzaz F A. 1980. Physiological ecology of tropical succession: A Comparative Review[J]. Annual Review Ecology and Systematics, 11: 287-310. DOI:10.1146/annurev.es.11.110180.001443 |
Bazzaz F A, Carlson R G. 1982. Photosynthetic Acclimation to variability in the environment of early and late successional plants[J]. Oecologia, 54: 313-316. DOI:10.1007/BF00379999 |
Bazzaz F A, Wayne P M. 1994. Coping with environmental heterogeneity: the physiological ecology of tree seedling regeneration across the gap-understory continuum//Caldwell M M, Pearcy R W. Exploitation of environmental heterogeneity by plants, ecophysiological processes above-and below-ground. New York: Academic Press, 349-390. http://www.sciencedirect.com/science/article/pii/B9780121550707500184
|
Bertamini M, Muthuchelian K, Nedunchezhian N. 2006. Shade effect alters leaf pigments and photosynthetic responses in Norway spruce (Picea abies L.) grown under field conditions[J]. Photosynthetica, 44(2): 227-234. DOI:10.1007/s11099-006-0011-z |
Ellsworth D S, Reich P B. 1996. Photosynthesis and leaf nitrogen in five Amazonian tree species during early secondary succession[J]. Ecology, 77(2): 581-594. DOI:10.2307/2265632 |
Evans J R. 1989. Partitioning of nitrogen between and within leaves grown under different irradiances[J]. Australian Journal of Plant Physiology, 16(6): 533-548. DOI:10.1071/PP9890533 |
Farquhar G D, Caemmerer S V, Berry J A. 1980. A biochemical model of photosynthetic CO2 assimilation in leaves of C3 species[J]. Planta, 149(1): 78-79. DOI:10.1007/BF00386231 |
Farquhar G D, Caemmerer S V. 1982. Modeling of photosynthetic response to environmental conditions//Lange O L, Nobel P S, Osmond C B, et al. Physiological Plant Ecology, Vol. Ⅱ. Encyclop edia of Plant Physiology 12B. Berlin: Springer-Verlag, 549-587. http://ci.nii.ac.jp/naid/10006440491
|
Feng Y L, Cao K F, Zhang J L. 2004. Photosynthetic characteristics, dark respiration, and leaf mass per unit area in seedlings of four tropical tree species grown under three irradiances[J]. Photosynthetica, 42(3): 431-437. DOI:10.1023/B:PHOT.0000046163.83729.e5 |
Field C, Mooney H. 1986. The photosynthesis-nitrogen relationship in wild plants//Givnish T J. On the economy of Form and Function. Cambridge: Cambridge University Press, 25-55. http://ci.nii.ac.jp/naid/10026527417
|
Han Q, Yamaguchi E, Odaka N, et al. 1999. Photosynthetic induction response to variable light under field conditions in species grown in the gap and understory of a Fagus crenata forest[J]. Tree Physiology, 19(10): 625-634. DOI:10.1093/treephys/19.10.625 |
Herrick J D, Thomas R B. 1999. Effects of CO2 enrichment on the photosynthetic light response of sun and shade leaves of canopy sweetgum trees (Liquidambar styraciflua) in a forest ecosystem[J]. Tree Physiology, 19: 779-786. DOI:10.1093/treephys/19.12.779 |
Kitao M, Lei T T, Koike T, et al. 2000. Susceptibility to photoinhibition of three deciduous broad-leaf tree species with difierent successional traits raised under various light regimes[J]. Plant Cell Environment, 23(1): 81-89. DOI:10.1046/j.1365-3040.2000.00528.x |
Kremer E, Kropff MJ. 1999. Comparative growth of triazine-susceptible and-resistant biotypes of Solanum nigrum at different light levels[J]. Annals of Botany, 83: 637-644. DOI:10.1006/anbo.1999.0870 |
Lambers H, Chapin F S, Pons T L. 1998. Plant physiological ecology[M]. New York: Springer.
|
Lichtenhaler H K. 1987. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes[J]. Methods Enzymol, 148: 349-382. |
Lusk C H, Reich P B. 2000. Relationships of leaf dark respiration with light environment and tissue nitrogen content in juveniles of 11 cold-temperate tree species[J]. Oecologia, 123(2): 318-329. |
Pearcy R W, Sims D A. 1994. Photosynthetic acclimation to changing light environments: sealing from the leaf to the whole plant//Caldwe U M M, Pearcy R W. Exploitation of environmental heterogeneity by plant: Ecophysiological processes above and below-ground San Diego, CA: Academic Press, San Diego.
|
Schloles J D, Press M C, Zipperlen S W. 1997. Difference in light energy utilisation and dissipation between dipterocarp rain forest tree seedlings[J]. Oecologia, 109(1): 1-48. DOI:10.1007/s004420050051 |
Stitt M, Schulze D. 1994. Does Rubisco control the rate of photosynthesis and plant growth? An exercise in molecular ecophysiology[J]. Plant Cell and Environment, 17(5): 465-487. DOI:10.1111/pce.1994.17.issue-5 |
Valladares F, Right S J, Lasso E, et al. 2000. Plastic phenotypic response to light of 16 congeneric shrubs from a Panamanian rainforest[J]. Ecology, 81(7): 1925-1936. DOI:10.1890/0012-9658(2000)081[1925:PPRTLO]2.0.CO;2 |
Vats S K, Pandey S, Nagar P K. 2002. Photosynthetic response to irradiance in Valeriana jatamansiJones, a threatened understorey medicinal herb of Werstern Himalaya[J]. Photosynthetica, 40: 625-628. DOI:10.1023/A:1024372623650 |
Warre C R. 2004. The photosynthetic limitation posed by internal conductance to CO2 movement is increased by nutrient supply[J]. Journal of Experimental Botany, 55(406): 2313-2321. DOI:10.1093/jxb/erh239 |
Zhang S, Ma K, Chen L. 2003. Response of photosynthetic plasticity of Paeonia suffruticosa to changed light environments[J]. Environmental and Experimental Botan, 49(2): 121-133. DOI:10.1016/S0098-8472(02)00063-1 |
 2009, Vol. 45
2009, Vol. 45