文章信息
- 丁易, 臧润国, 杨世彬, 蔡笃磊, 王进强, 周照骊.
- Ding Yi, Zang Runguo, Yang Shibin, Cai Dulei, Wang Jinqiang, Zhou Zhaoli
- 海南霸王岭棕榈植物对热带低地雨林树木更新的影响
- Effects of Palms on Trees Regeneration in the Tropical Lowland Rain Forest of Bawangling, Hainan Island
- 林业科学, 2009, 45(9): 18-23.
- Scientia Silvae Sinicae, 2009, 45(9): 18-23.
-
文章历史
- 收稿日期:2007-08-07
-
作者相关文章
2. 海南霸王岭国家级自然保护区 昌江 572722
2. Hainan Bawangling National Nature Reserve Changjiang 572722
许多研究表明热带地区林下棕榈科(Arecaceae)植物能够减少种子补充和抑制树木幼苗更新,从而在景观尺度上影响热带林的物种多样性(Denslow et al., 1991; 2000; Farris-Lopez et al., 2004; Harms et al., 2004; Wang et al., 2004;2006)。棕榈植物巨大的叶片增加了种子散布限制性,同时通过降低林下光照而提高了生境限制性(Wang et al., 2004),而且这些叶片的脱落也提高了对林下幼苗的机械损害程度(Aide,1987; Peters et al., 2004)。另外棕榈植物叶片存在较多的纤维组织而分解速度缓慢,因而凋落物层厚度的增加使得种子无法进入土壤而引起种子死亡和幼苗建立困难,同时也提高了种子被捕食的概率(Wang et al., 2004)。与乔木型棕榈植物相比,丛生灌木状棕榈对于种子散布和幼苗更新的限制性表现更加明显,而且对木本植物更新的影响要显著大于非木本植物(Wang et al., 2004; 2006)。
海南岛是我国主要的热带雨林分布区(胡玉佳等,1992; 臧润国等,2004),与其他热带地区相比,海南岛热带雨林中的棕榈植物种类较少。目前对于海南岛棕榈植物的研究仅限于植物分类和资源调查,而对它们在热带雨林中生态学的效应了解较少。在海南岛某些热带低地雨林中,由于某些生境特征或者少量人为干扰使得棕榈植物集聚成为林下层的优势种。这些林下集聚的丛生棕榈植物个体是否能够影响木本植物幼苗更新?棕榈植物个体是否对其冠幅下的幼苗具有选择性?本研究分析丛生棕榈植物对其他木本植物幼苗补充的生态学效应,为深入了解热带低地雨林的生物多样性维持机制提供科学依据。
1 研究区概况研究区位于海南省西南部昌江县和白沙县境内的霸王岭林区(108°58′—109°53′E,18°53′—19°20′N)总面积7.1万hm2,地形复杂,以山地为主,海拔100~1 654 m。该地区属热带季风气候,干湿季明显。年均气温24.2℃,年平均降水量1 677.1 mm,5—11月为雨季,12月至次年4月为旱季。土壤以砖红壤为代表类型,随海拔的增加逐渐过渡为山地红壤、山地黄壤和山地草甸土。低地雨林、山地雨林、山地常绿林和高山矮林为其地带性优势植被类型(陆阳等,1986; 臧润国等,2004)。低地雨林和山地雨林是该地区分布最广的2个主要植被类型。低地雨林是以青梅(Vatica mangachapoi)、荔枝(Litchi chinensis)和白茶(Koilodepas hainanense)等为优势种的植被类型(胡玉佳等,1992)。
2 研究方法在霸王岭林区的五里桥选择以青梅为优势种,而且林下分布大量棕榈植物的老龄林为研究对象。该群落为典型的海南岛低地雨林群落,优势种为青梅、盘壳栎(Cyclobalanopsis patelliformis)、荔枝和白茶等。样地海拔700 m,坡度15°,坡向南偏东12°。土壤母岩为霸王岭地区广泛分布的花岗岩。在该低地雨林中,选择1 hm2的群落样地,并将其划分为400个5 m × 5 m的连续小样方,调查每个小样方内所有高度大于0.1 m的个体(排除木质藤本和草木)的物种名称、胸径(DBH)和高度(H)。
根据群落中树木个体的高度和胸径,将群落内所有个体划分为5个径级:小幼苗(0.1 m≤H < 0.5 m)、大幼苗(0.5 m≤H < 1.5 m)、幼树(H≥1.5 m且DBH < 5 cm)、小树(5 cm≤DBH < 10 cm)和大树(DBH≥10 cm)。统计每个小样方内出现的棕榈植物个体(H≥1.5 m)种类和数量,调查每个丛生棕榈冠幅,记录每个更新幼苗(包括小幼苗和大幼苗)是否位于棕榈冠幅之内。根据每个物种在群落演替中的位置,将幼苗物种划分为3个功能群:短寿命先锋种、长寿命先锋种和后期种。棕榈物种冠幅面积秩和(rank cases)转换后利用ANOVA分析和多重比较(Games-Howell multiple comparisons)。利用Kruskal-Wallis Test非参数检验比较不同棕榈密度小样方中各径级树木的密度和物种数量。利用Pearson相关性分析探讨小样方中棕榈个体密度与各径级树木密度或物种丰富度的变化趋势。数据分析采用SPSS 13.0统计分析软件。
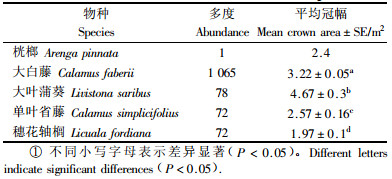
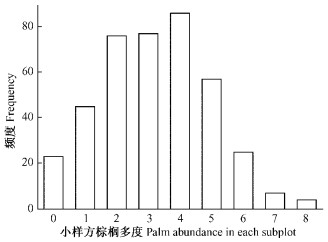
3 结果与分析 3.1 低地雨林中的棕榈植物多样性在1 hm2的低地雨林样地中,共记录5种棕榈科植物:桄榔(Arenga pinnata)、大白藤(Calamus faberii)、大叶蒲葵(Livistona saribus)、单叶省藤(Calamus simplicifolius)和穗花轴榈(Licuala fordiana)(表 1),他们在400个5 m×5 m小样方中的分布频度分别为1, 361, 65, 51和59。大白藤是个体数量最高的棕榈植物,占总个体数的82.7%,且分布于90.3%的小样方中。不同棕榈物种的冠幅面积存在显著差异(Nonparametric one-way ANOVA,F=32.269,P < 0.001),大叶蒲葵的个体冠幅显著高于其他物种(P < 0.05)。小样方棕榈多度在群落中呈显著的正态分布(Kolmogorov-Smirnov Test,P=0.939),拥有4个棕榈植物个体的小样方数量最多,拥有8个棕榈植物个体的小样方数量最小。在400个小样方中,仅有23个小样方无棕榈植物分布(图 1)。
|
|
|
图 1 不同棕榈多度小样方(5 m×5 m)的分布频度 Figure 1 Distribution frequency of subplots (5 m×5 m) with different palms abundance |
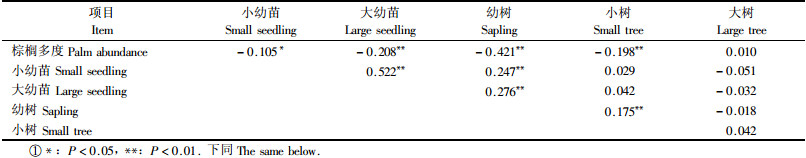
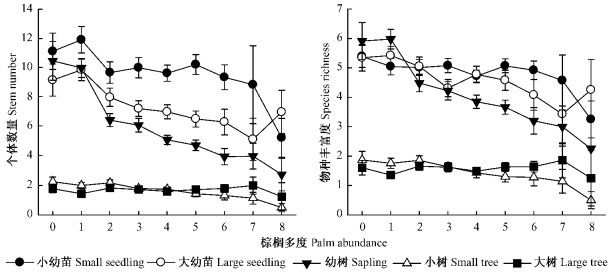
不同棕榈多度小样方中的大幼苗(Kruskal-Wallis Test,χ2=20.41,P < 0.01)、幼树(χ2=71.879,P < 0.001)和小树(χ2=20.118,P < 0.05)的数量存在显著差异,但是小幼苗(χ2=10.481,P=0.233)和大树(χ2=4.939,P=0.764)的数量无显著差异。小样方中的棕榈多度显著地影响了群落内胸径 < 10 cm个体数量:小幼苗、大幼苗、幼树和小树数量均和棕榈个体多度呈显著负相关,但大树数量却没有表现出与棕榈多度的相关性(图 2,表 2)。不同棕榈多度小样方中的小幼苗(χ2=6.867,P=0.551)、大幼苗(χ2=15.109,P=0.057)和大树(χ2=3.248,P=0.918)的物种丰富度没有显著差异,但幼树(χ2=46.418,P < 0.001)和小树(χ2=17.888,P < 0.05)的物种丰富度有差异。小幼苗和大树物种数与小样方内的棕榈多度无相关性,但大幼苗、幼树和小树间物种丰富度呈显著负相关(图 2,表 3)。
|
图 2 小样方中棕榈多度与各径级树木个体数量和物种丰富度的关系 Figure 2 Correlation between tree mumber to species richness of various size classes and palm abundance in subplots |
|
|
|
|
棕榈植物覆盖减少了更新幼苗的个体数量和物种丰富度,其中18.3%幼苗分布于棕榈树冠下。样地中小幼苗数量比大幼苗高33.5%,但棕榈覆盖生境中的小幼苗个体数量比例(11.2%)低于大幼苗(27.8%)。棕榈覆盖生境中包含53.3%的物种,然而几乎所有的物种(97.4%)能够在无棕榈覆盖生境中更新。37.5%的小幼苗物种和59.8%的大幼苗物种分布在棕榈覆盖生境中。
不同功能群物种对于棕榈覆盖表现出不同的适应性(表 4)。短寿命先锋种个体数量较低,但主要都分布在无棕榈覆盖生境中。分别有11.6%和19.8%的长寿命先锋种和后期种分布在棕榈覆盖生境中。幼苗更新过程中,长寿命先锋种和后期种在棕榈覆盖生境中的比例分别从小幼苗阶段的5.3%和10.3%增加到大幼苗阶段的20.8%和29.4%。
|
|
棕榈植物是热带低地雨林的重要组成部分,在群落下层具有较高的个体密度和盖度(Kahn et al., 1992; Vormisto et al., 2004),因而在幼苗补充和物种多样性维持方面扮演着重要作用(Denslow et al., 2000; Harms et al., 2004; Wang et al.,2006)。本研究群落中棕榈植物的密度明显低于其他热带雨林中的棕榈密度。虽然简单的棕榈个体盖度之和可能高估它们在群落中的覆盖率(41.4%),但是本研究样地中的棕榈个体高度差异较小,因而棕榈盖度仍然表现出较高比例。然而与其他区域不同的是,没有形成主茎的棕榈植物个体在群落下层占据绝对优势,而乔木状棕榈植物在该群落中极少出现。其他热带植被恢复生态学研究表明,热带林演替后期和原始林中的棕榈植物个体多度和物种丰富度最高(Guariguata et al., 1997; Svenning,1998)。因此棕榈植物的个体多度和物种丰富度具有重要的指示作用,可以作为热带林植被恢复后期阶段或原始林的重要标志。
野外控制试验研究表明,热带林内分布的棕榈植物能够显著抑制群落内繁殖体补充和幼苗建立过程(Denslow et al., 1991; Farris-Lopez et al., 2004; LaFrankie et al.,2004; Wang et al., 2004; 2006)。不同的棕榈物种、构筑型以及空间分布对于树木幼苗更新具有不同的生态效应,例如矮生棕榈抑制强度显著大于乔木状棕榈个体(Wang et al., 2004)。本研究发现不同生长阶段的幼苗对棕榈覆盖引起的光照减少存在不同的响应特征:小幼苗密度和物种数量对棕榈个体密度反应敏感性较差,而大幼苗与棕榈密度存在较大的负相关,其他热带地区同样存在类似的规律。例如在哥斯达尼加雨林中,Wang等(2004)通过野外控制试验发现矮生棕榈的遮盖对初生幼苗存活和生长的影响要显著低于较老的幼苗。这种响应差异可能与幼苗不同生长阶段中主要养分供给来源有关。例如不同生长阶段的幼苗常常采用不同的非结构碳水化合物(例如可溶性糖和淀粉)分配策略来应对林下较弱的光照环境(Lusk et al., 2007)。由于种子萌发和早期幼苗生长更多的依靠于种子所储存的营养物质(Fenner et al., 1999),因而早期生长阶段过程中的光照变化对幼苗生长影响小。而经过幼苗养分供给来源变化后,幼苗的生长所需营养则来源于叶片光合作用(Fenner et al., 1999),因而大幼苗对于棕榈个体密度引起的光照条件变化(Harms et al., 2004; Wang et al., 2004)表现更加敏感。
本研究中发现丛生棕榈对幼苗更新有一定的抑制作用,然而相关系数较低。其主要原因包括:1)接近山脊的研究样地通常下层光照条件相对较好(Kahn et al., 1985)。因而尽管棕榈植物的存在能够降低光照强度(Wang et al., 2004),由于入射角的不同,靠近山脊处的丛生棕榈对林下光照的阻挡强度要低于沟谷或者平地。因而透过丛生棕榈冠幅下的光照仍可能达到部分幼苗的光补偿点。2)不同棕榈植物的叶片形态差异也可能导致棕榈对幼苗更新的影响减弱。除山蒲葵具有致密叶片外,样地中出现的其他棕榈植物叶片的各小叶之间均存在一定的空隙,因此可能提高棕榈树冠下的光照强度,从而增加幼苗更新的成功率。3)通常植物个体的地下根系竞争能够显著降低树木幼苗存活率和生长率(Coomes et al., 2000), 但是Denslow等(1991)通过野外试验没有发现棕榈与幼苗个体存在地下根系竞争。因此小样方中棕榈多度的增加仅仅是减少了光照而没有提高幼苗地下根系竞争强度。毫无疑问,除棕榈植物个体外,另外群落中其他植物个体的空间分布和个体大小引起的地下竞争、种子散布格局、个体对光照的影响、种子库构成、物种个体差异以及环境异质性也影响幼苗补充限制性(Clark et al., 1998; Hubbell et al.,1999; Svenning,2001; Dalling et al., 2002; Wang et al., 2004),可能这些因素的综合作用也能够导致棕榈个体与幼苗更新较低的相关系数。
棕榈植物覆盖对于不同功能群物种更新具有不同的影响。与先锋种相比较,后期种幼苗在棕榈覆盖下具有更高的更新比例。后期种通常种子质量较大而具有更多的养分储存(Moles et al.,2005),因而后期种具有更强的种子萌发和幼苗存活能力(Farris-Lopez et al., 2004)。这种不同功能群之间的更新生态位差异使得后期种在棕榈覆盖下更具有优势。热带林群落生态学研究表明,局域尺度下棕榈植物的存在减少了幼苗更新密度和物种数量,但是在不同尺度上,棕榈植物盖度对于物种多样性具有不同的生态学效应(Wang et al.,2006),因而也对植物补充限制性产生不同的结果。虽然本研究样地中的棕榈密度和盖度具有较高水平,但是在景观尺度上,海南岛热带林下棕榈植物盖度较小。因此棕榈植物导致的局域尺度下的补充限制性对于大尺度的海南岛物种多样性及其树木分布格局作用还有待做更全面的研究。
胡玉佳, 李玉杏. 1992. 海南岛热带雨林[M]. 广州: 广东高等教育出版社.
|
陆阳, 李鸣光, 黄雅文, 等. 1986. 海南岛霸王岭长臂猿自然保护区植被[J]. 植物生态与地植物学报, 2: 106-114. |
臧润国, 安树青, 陶建平, 等. 2004. 海南岛热带林多样性及其维持机制[M]. 北京: 科学出版社.
|
Aide T M. 1987. Limbfalls:a major cause of sapling mortality for tropical forest plants[J]. Biotropica, 19: 284-285. DOI:10.2307/2388350 |
Clark J S, Macklin E, Wood L. 1998. Stages and spatial scales of recruitment limitation in southern Appalachian forests[J]. Ecological Monographs, 68: 213-235. DOI:10.1890/0012-9615(1998)068[0213:SASSOR]2.0.CO;2 |
Coomes D A, Grubb P J. 2000. Impacts of root competition in forests and woodlands:a theoretical framework and review of experiments[J]. Ecological Monographs, 70: 171-207. DOI:10.1890/0012-9615(2000)070[0171:IORCIF]2.0.CO;2 |
Dalling J W, Muller-Landau H C, Wright S J, et al. 2002. Role of dispersal in the recruitment limitation of neotropical pioneer species[J]. Journal of Ecology, 90: 714-727. DOI:10.1046/j.1365-2745.2002.00706.x |
Denslow J S, Guzman G. 1991. The effect of understory palms and cyclanths on the growth and survival of Inga seedlings[J]. Biotropica, 23: 225-234. DOI:10.2307/2388199 |
Denslow J S, Guzman G. 2000. Variation in stand structure, light, and seedling abundance across a tropical moist forest chronosequence, Panama[J]. Journal of Vegetation Science, 11: 201-212. DOI:10.2307/3236800 |
Farris-Lopez K, Denslow J S, Moser B, et al. 2004. Influence of a commonpalm, Oenocarpus mapora, on seedling establishment in a tropicalmoist forest in Panama[J]. Journal of Tropical Ecology, 20: 429-438. DOI:10.1017/S0266467404001531 |
Fenner M, Kitajima K. 1999. Seed and Seedling Ecology//Pugnaire F I, Valladares F. Handbook of functional plant ecology. New York: Marcel Dekker, Inc, 589-621.
|
Guariguata M R, Chazdon R L, Denslow J S, et al. 1997. Structure and floristics of secondary and old-growth forest stands in lowland Costa Rica[J]. Plant Ecology, 132: 107-120. DOI:10.1023/A:1009726421352 |
Harms K E, Powers J S, Montgomery R A. 2004. Variation in small sapling density, understory cover, and resource availability in four Neotropical forests[J]. Biotropica, 36: 40-51. |
Hubbell S P, Foster R B, O'Brien S T, et al. 1999. Light gap disturbances, recruitment limitation, and tree diversity in a neotropical forest[J]. Science, 283: 554-557. DOI:10.1126/science.283.5401.554 |
Kahn F, de Castro A. 1985. The palm community in a forest of Central Amazonia, Brazil[J]. Biotropica, 17: 210-216. DOI:10.2307/2388221 |
Kahn F, de Granville J J. 1992. Palms in forest ecosystems of amazonia[M]. Berlin: Springer-Verlag.
|
LaFrankie J V, Saw L G. 2005. The understorey palm Licuala (Arecaceae) suppresses tree regeneration in a lowland forest in Asia[J]. Journal of Tropical Ecology, 21: 703-706. DOI:10.1017/S0266467405002737 |
Lusk C H, Piper F I. 2007. Seedling size influences relationships of shade tolerance with carbohydrate-storage patterns in a temperate rainforest[J]. Functional Ecology, 21: 78-86. |
Moles A T, Ackerly D D, Webb C O, et al. 2005. A brief history of seed size[J]. Science, 307: 576-580. DOI:10.1126/science.1104863 |
Peters H, Pauw A A, Silman M R, et al. 2004. Falling palm fronds structure sapling communities[J]. Philosophical Transactions of the Royal Society of London, Series B, 271(Sup): S367-S369. |
Svenning J C. 1998. The effect of land-use on the local distribution of palm species in an Andean rain forest fragment in northwestern Ecuador[J]. Biodiversity andConservation, 7: 1529-1537. DOI:10.1023/A:1008831600795 |
Svenning J C. 2001. Environmental heterogeneity, recruitment limitation and themesoscale distribution of palms in a tropical montane rain forest (Maquipucuna, Ecuador)[J]. Journal of Tropical Ecology, 17: 97-113. DOI:10.1017/S0266467401001067 |
Vormisto J, Svenning J C, Hall P, et al. 2004. Diversity and dominance inpalm (Arecaceae) communities in terra firme forests in the western Amazon basin[J]. Journal of Ecology, 92: 577-588. DOI:10.1111/j.0022-0477.2004.00904.x |
Wang Y H, Augspurger C. 2004. Dwarf palms and cyclanths strongly reduce Neotropical seedling recruitment[J]. Oikos, 107: 619-633. DOI:10.1111/oik.2004.107.issue-3 |
Wang Y H, Augspurger C. 2006. Comparison of seedling recruitment under arborescent palms in two Neotropical forests[J]. Oecologia, 147: 533-545. DOI:10.1007/s00442-005-0279-x |
 2009, Vol. 45
2009, Vol. 45