文章信息
- 李会平, 黄大庄, 苏筱雨, 黄秋娴.
- Li Huiping, Huang Dazhuang, Su Xiaoyu, Huang Qiuxian
- 白僵菌侵染对桑天牛幼虫酚氧化酶活性和血细胞的影响
- Change of Activity of Phenoloxidase and Hemocytes in Apriona germari Larvae Infected by Beauveria bassiana
- 林业科学, 2009, 45(8): 175-178.
- Scientia Silvae Sinicae, 2009, 45(8): 175-178.
-
文章历史
- 收稿日期:2008-02-21
-
作者相关文章
桑天牛(Apriona germari)是多种林木、果树、花卉的重要蛀干害虫,也是我国危害最严重、最难防治的害虫之一。近年来,其猖獗危害已成为我国养蚕业、林业及果树种植业等经济发展的严重障碍。白僵菌(Beauveria bassiana)是重要的昆虫病原微生物,李会平等(2006)从诱集自土壤中的9株白僵菌中初步筛选出了对桑天牛幼虫具有较高致病性的Bb00菌株。
昆虫的致病过程实际上是病原微生物的侵染与昆虫的自身防御的矛盾斗争过程。病原微生物在侵染昆虫的过程中必须突破昆虫的机体防御体系才能致病。昆虫硬厚的表皮和前后肠的内膜,是抵御外物侵入体内的一种屏障。病原微生物进入虫体以后,昆虫体内的某些成分开展抗御活动,企图消灭这些外来有害物体,这种抗御作用即为免疫。外物侵入虫体以后,血淋巴随即显现抗御反应。根据性质的不同,可分为细胞抗御和体液抗御。细胞抗御反应表现在吞噬作用、团囊作用和结节形成等。体液抗御是体液中能钝化或杀死入侵病原体的某些化学物质,如酚氧化酶等(蒲蛰龙,1992;李娟,2004;李季生,2006)。目前关于白僵菌杀虫机理的研究,国内外已有较多的报道(牛宇等,2005;宋入梅等,2006;王光锋等,2003;薛皎亮等,2006),但关于白僵菌侵染过程中桑天牛幼虫的一系列防御反应尚未见报道。为明确桑天牛幼虫对白僵菌入侵的免疫机理,笔者以筛选出的Bb00菌株为材料,研究桑天牛幼虫血细胞对白僵菌分生孢子的吞噬、囊包作用,以及桑天牛幼虫受到白僵菌侵染过程中酚氧化酶活力的变化,以探讨昆虫的血细胞以及血淋巴中酚氧化酶对白僵菌入侵的抗御作用。
1 材料与方法 1.1 试验材料1)供试昆虫 野外捕捉桑天牛成虫并利用1~2年生幼嫩桑枝进行室内饲养,产卵后10天左右,剖取已孵化的桑天牛幼虫,人工接种到河北农业大学标本园内的毛白杨(Populus tomentosa)枝条中,以见蛀屑和虫粪排出确认成活,2个月后用于试验。
2)供试菌株及孢子悬浮液制备 供试菌株为球孢白僵菌Bb00菌株,8×108mL-1的孢子悬液处理20天龄桑天牛幼虫后,侵染率为86.3%,LT50为4.13天(李会平等,2006)。察氏培养基中培养的白僵菌完全产孢后,刮下分生孢子,用含0.1%吐温80的无菌水润湿,磁力搅拌器搅拌均匀,经血球计数板计数后,配成1×108mL-1的孢子悬浮液。
1.2 试验方法1)接种方法 采用“孢子浴”法对桑天牛幼虫进行接种,具体方法为,同龄桑天牛幼虫浸入孢子悬浮液中30 s后,接入毛白杨的人工刻槽中,0.1%吐温80无菌水处理作对照,随后将接入桑天牛幼虫的毛白杨枝条室温下插入湿沙中,每个枝条接入5头幼虫,共10个枝条。
2)酚氧化酶活性测定 桑天牛幼虫经白僵菌接种后,分别于0.5,1,1.5,2,2.5,3,3.5,4,4.5和5天提取血淋巴,4℃下800 g离心3 min,取上清液。将收集的上清液在4 ℃下10 mmoL·L-1二甲砷酸钠缓冲液中透析1 h。用Bradford检测法测定血淋巴蛋白的浓度,即以考马斯亮蓝G250染色后在紫外分光光度计上测定样品的OD595,并以结晶牛血清蛋白作为标准而制定标准曲线(Bradford,1976)。
在3 g·L-1多巴溶液300 μL中加入血淋巴100 μL,于室温下反应10 min,490 nm下测定OD值,并以多巴溶液为对照。每个样品重复3次。酶活性以每分钟每毫克蛋白OD490的变化(OD490·min-1 mg-1 pro)来表示(Bidochka,1994)。
3)血细胞总数的变化 分别在接种后0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5和5.0天在虫体稍前部用昆虫针扎小口,血淋巴从伤口溢出成小水珠状,用微量进样器吸取收集血淋巴,将幼虫血淋巴移入适当倍数的血细胞稀释液[2%(体积分数)醋酸与10 g·L-1次甲基蓝的体积比为100:1]中染色,尽快置光学显微镜下观察,用血球计数器计测血细胞的总数,每样品重复3次。
4)血细胞形态观察 桑天牛幼虫接种白僵菌分生孢子后,定时取血,在Olympus显微镜下观察血细胞吞噬囊包分生孢子的状况并照相。
2 结果与分析 2.1 桑天牛幼虫感染白僵菌后酚氧化酶活性变化接种白僵菌后桑天牛幼虫血淋巴酚氧化酶在不同时间的活性变化见表 1。
|
|
从表 1可以看出,桑天牛幼虫接种白僵菌后,不同时间段的血淋巴酚氧化酶活性差异显著,随着接种时间延长,酚氧化酶活性逐渐升高,至第2.5天达到高峰值,随后开始下降。
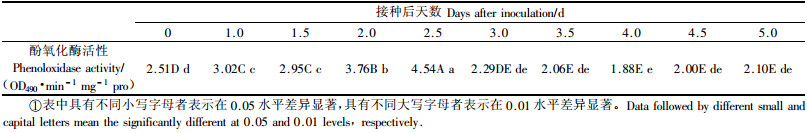
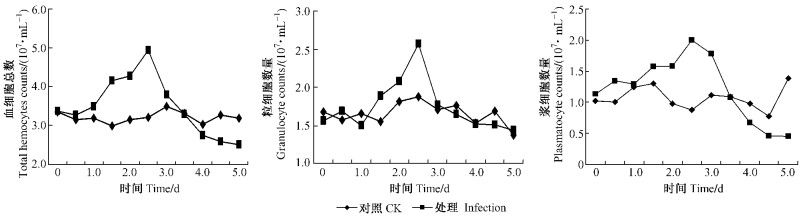
2.2 桑天牛幼虫感染白僵菌后血细胞数量与组成变化通过试验观察到,接种白僵菌分生孢子后对桑天牛幼虫血细胞数量有显著影响,正常不接种的桑天牛血细胞种类和数量基本上是稳定的。被白僵菌感染后的桑天牛幼虫血细胞种类和数量变化见图 1。
|
图 1 桑天牛幼虫感染白僵菌后血细胞种类和数量变化 Figure 1 Change of hemocytes variety and counts of A. germari larvae infected with B. bassiana |
由图 1可以看出,接种后0~1.0天,感染昆虫血细胞总数与对照差异不大,1.0天后,接种虫血细胞总数逐渐上升,显著高于对照,到第2.5天达最高值。接种第2.5天以后处理的血细胞总数开始下降,并持续降至较低水平。观察还发现,被感染虫体血淋巴中的浆细胞和粒细胞也表现出类似的规律,在第2.5天左右,其细胞数达到最大,之后缓慢下降。只是下降的速度变化有所不同,其中,粒细胞在2.5~3.0天之间下降迅速,之后较缓慢;而浆细胞在2.5~3.0天之间下降较缓,之后出现一迅速下降区,4.0天以后粒细胞和浆细胞均较稳定。
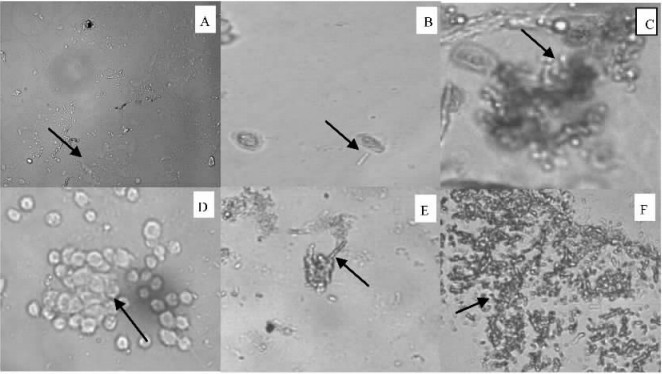
2.3 接种白僵菌后桑天牛幼虫血细胞的行为变化接种白僵菌后桑天牛幼虫血细胞的行为变化情况见图 2。
|
图 2 桑天牛幼虫血细胞对入侵白僵菌的防御反应 Figure 2 Defence response of hemocytes in A. germari larvae to B. bassiana A:血腔内出现少量细小菌丝段Small hyphal bodies in the hemocoele;B:血细胞表面黏附菌丝段Hemocytes adhering hyphal bodies;C:血细胞吞噬包被菌丝段Hyphal bodies phagocytosed by hemocytes;D:血细胞聚集Aggregated hemocytes;E:菌丝从结节中伸出Hypha growing from nodule;F:血腔内充满菌丝体Hemocoele full of hyphal bodies. |
接种白僵菌分生孢子后1天,可观察到血腔内出现少量细小的菌丝段,说明已有分生孢子侵入虫体,随后菌丝段数量有所增加,血细胞开始出现免疫反应,菌丝段粘附于血细胞表面,一个血细胞上粘附一个或多个菌丝段,有时许多血细胞聚集在一起形成大量细胞集结或结节。接种白僵菌分生孢子1.5天后,可观察到大量吞噬了虫菌体和菌丝段的血细胞。同时,粒细胞和浆细胞逐渐形成囊块,结构较致密,菌丝段被包被其中。被血细胞吞噬或聚集包围的虫菌体,在接种后2天开始突破包围向外生长。随着虫菌体的生长及菌丝体的不断断裂,血腔内菌丝体越来越多,最后血腔内充满菌丝体,虫体血液循环不畅,因生理饥饿而死亡。
3 结论与讨论在昆虫体内酚氧化酶是以无活性的酚氧化酶原形式存在的,这种无活性的酚氧化酶原只有在受到病原微生物等细胞壁成分如昆布多糖的诱导激活后才能转化为有活性的酚氧化酶,它们继而吸附于病原菌表面,与底物作用后产生黑化并限制其入侵(刘青娥,2004;Hung et al.,1996;Wiens et al., 1998;Albores et al., 2000;Silva et al., 2000)。因此菌株入侵寄主过程中酚氧化酶活力高低在一定程度上反映了它们逃避寄主免疫识别的能力。当白僵菌入侵时,酚氧化酶活性逐渐升高,至第2.5天达到高峰值,而后开始下降,表明寄主在遭受白僵菌入侵时受到一定的损伤,其免疫互作使酚氧化酶活性先迅速上升,但随后因菌株的适应性增强其活性开始下降。而电镜观察结果表明,该菌株侵染桑天牛幼虫12 h后,分生孢子吸水逐渐膨大,16 h后,孢子萌发伸出芽管,36 h时,可见芽管形成菌丝,在体表生长并寻找合适的侵入点侵入体内,48 h时大多数孢子已侵入体内,接种4天后,体内大量繁殖产生的菌丝开始突出体表(王晓红,2007)。可见,上述酚氧化酶活性的变化趋势正好反映了该菌株对桑天牛幼虫的侵染过程。
本研究采用“孢子浴”法对虫体进行接种,比以往多数文献(翟锦彬等,1996;王音,2005;黄冬如,2004;时连根等,2001;陆龙喜等,2001;梁子才等,1991;Hung et al., 1992;1993)中采用的向虫体注射分生孢子的方法更接近自然实际情况,从而更真实地反映血细胞对白僵菌的防御能力。试验中笔者发现,接种后血细胞数量变化规律与白僵菌对桑天牛幼虫的侵染进程是一致的,接种后1天前,是白僵菌向寄主表皮入侵的时期,进入到血腔内的菌体寥寥无几,因而血细胞尚未做出明显反应。1天后菌体开始进入血腔内,平时静息于各器官表面的血细胞在外来物的刺激下开始游离于血淋巴中,造成血细胞数量上升。2.5天以后,随着菌体在寄主体内的增殖,大量血细胞参与到对菌体的免疫反应中,出现血细胞凝聚、围歼、形成结节等一系列行为反应,消耗了大量的血细胞,使血细胞数量下降。同时,由感染后浆细胞和粒细胞的变化可以看出,血细胞总数变化主要由这两类细胞的数量变化引起,其他类型血细胞对血细胞总数变化影响不大。其中,在对白僵菌的免疫过程中,在早期的防御活动中浆细胞较粒细胞更活跃,而在后期主要是浆细胞和粒细胞的共同作用来抵御外物的侵入。
行为变化部分的研究也表明,桑天牛幼虫的血细胞对侵入体内的白僵菌的菌丝段具有吞噬和囊包作用,高峰期发生在接种后第2.0~2.5天,也即白僵菌对桑天牛的侵染高峰期。但由于菌丝段在血液中大量增殖,最终血细胞对白僵菌只起暂时的阻碍和抑制作用,不能从根本上消除白僵菌的发展。
桑天牛对白僵菌的免疫反应随着白僵菌的侵染过程呈现出一定的规律性变化,但是这种免疫反应应该是多个因子相互作用的结果,除酚氧化酶和血细胞的作用外,其他因素的防御影响还有待进一步研究。
黄冬如.2004.绿僵菌对东亚飞蝗致病机理的初步研究.长沙: 湖南农业大学硕士研究生学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10537-2004089477.htm
|
李会平, 黄大庄, 王晓红, 等. 2006. 用黄粉虫诱集法分离球孢白僵菌及对桑天牛幼虫高毒力菌株的筛选. 蚕业科学, 32(3): 320-323. DOI:10.3969/j.issn.0257-4799.2006.03.004 |
李季生, 夏爱华, 高绘菊, 等. 2006. 蝇蛆寄生对家蚕血细胞和酚氧化酶活性的影响. 蚕业科学, 32(2): 268-271. DOI:10.3969/j.issn.0257-4799.2006.02.025 |
李娟.2004.根虫瘟霉转寄主菌株侵染力增强的免疫及生化机制.杭州: 浙江大学硕士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10335-2004139397.htm
|
梁子才, 程振衡. 1991. 亚洲玉米螟幼虫血淋巴的免疫反应. 昆虫学报, 34(2): 141-145. |
刘青娥, 徐均焕, 冯明光. 2004. 根虫瘟霉不同菌株对小菜蛾幼虫血淋巴酚氧化酶原的激活作用. 昆虫学报, 47(4): 434-438. DOI:10.3321/j.issn:0454-6296.2004.04.004 |
陆龙喜, 时连根. 2001. 家蚕血细胞对病原白僵菌的防御反应研究. 浙江农业学报, 13(4): 201-204. DOI:10.3969/j.issn.1004-1524.2001.04.005 |
牛宇, 薛皎亮, 谢映平, 等. 2005. 油松毛虫感染白僵菌后超氧化物歧化酶和过氧化氢酶的变化. 应用与环境生物学报, 11(2): 182-186. DOI:10.3321/j.issn:1006-687X.2005.02.014 |
蒲蛰龙. 1992. 昆虫病理学. 广州: 广东科学技术出版社.
|
时连根, 钟伯雄, 徐俊良. 2001. 家蚕血淋巴对病原白僵菌的防御机理. 农业生物技术学报, 9(4): 383-386. DOI:10.3969/j.issn.1674-7968.2001.04.020 |
宋入梅, 王云滨, 李瑞军, 等. 2006. 甜菜夜蛾感染白僵菌、绿僵菌后的病症及组织病理学变化. 华北农学报, 21(增刊): 171-174. |
王光峰, 张友军, 柏连阳, 等. 2003. 多杀菌素对甜菜夜蛾多酚氧化酶和羧酸酯酶的影响. 农药学学报, 5(2): 40-46. DOI:10.3321/j.issn:1008-7303.2003.02.005 |
王晓红.2007.桑天牛幼虫高致病性白僵菌菌株筛选及感病幼虫组织病理变化的研究.保定: 河北农业大学硕士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-11920-2008074959.htm
|
王音.2005.绿僵菌LD65和LF68菌株生物学特性及对小菜蛾的致病机理.北京: 中国农业大学博士学位论文. http://cdmd.cnki.com.cn/article/cdmd-10019-2005062220.htm
|
薛皎亮, 牛宇, 谢映平. 2006. 油松毛虫感染白僵菌后体内蛋白质、酯酶和多酚氧化酶的变化. 应用与环境生物学报, 12(6): 814-818. DOI:10.3321/j.issn:1006-687X.2006.06.014 |
翟锦彬, 黄秀梨. 1996. 球孢白僵菌对棉铃虫细胞防御反应的影响. 北京师范大学学报:自然科学版, 32(4): 541-545. |
Albores F V, Plascencia G Y. 2000. Beta glucan binding protein and its role in shrimp immune response. Aquaculture, 191: 13-21. DOI:10.1016/S0044-8486(00)00416-6 |
Bidochka M J, Khachatourians G G. 1994. Protein hydrolysis in grasshopper cuticles by entomopathogenic fungal extracellular proteases. J Inverteb Pathol, 63: 7-13. DOI:10.1006/jipa.1994.1002 |
Bradford M. 1976. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle protein-dye binding. Anal Biochem, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Hung S Y, Boucias D G, Vey A J. 1993. Effect of Beauveria bassiana and Candida albicans on the cellular defense response of Spodoptera exigua. J of Inverteb Pathol, 61: 179-187. DOI:10.1006/jipa.1993.1032 |
Hung S Y, Boucias D G. 1992. Influence of Beauveria bassiana and Candida albicans on the cellular defense response of the beet armyworm, Spodoptera exigua. J of Invertebr Pathol, 60: 152-158. DOI:10.1016/0022-2011(92)90089-M |
Hung S Y, Boucias D G. 1996. Phenoloxidase activity in hemolymph of native and Beauveria bassiana-infected Spodoptera exigua larvae. J Inverteb Pathol, 67: 35-40, 234. DOI:10.1006/jipa.1996.0006 |
Silva C, Dunphy G B, Rau M E. 2000. Interaction of hemocytes and prophhenoloxidase system of fifth instar nymphs of Acheta domesticus with bacteria. Developmental and Comparative Immunology, 24: 367-379. DOI:10.1016/S0145-305X(99)00063-4 |
Wiens M, KoziolC, Batel R, et al. 1998. Phenylalanine hydroxylase from the sponge Geodia cydonium: Implication for allorecognition and evolution of aromatic amino acid hydroxylases. Dev Comp Immunol, 22: 469-478. DOI:10.1016/S0145-305X(98)00034-2 |
 2009, Vol. 45
2009, Vol. 45