文章信息
- 杜丽, 周索, 杨建伟, 喻亚丽, 谢艳华, 包满珠.
- Du Li, Zhou Suo, Yang Jianwei, Yu Yali, Xie Yanhua, Bao Manzhu
- 翠菊‘花束绯红’下胚轴体胚发生及植株再生
- Somatic Embryogenesis and Plantlet Regeneration of Hypocotyl Explants of Callistephus chinensis 'Bouquet Scarlet'
- 林业科学, 2009, 45(8): 166-169.
- Scientia Silvae Sinicae, 2009, 45(8): 166-169.
-
文章历史
- 收稿日期:2008-07-24
-
作者相关文章
2. 华中农业大学园艺林学学院教育部园艺植物生物学重点实验室 武汉 430070
2. Key Laboratory of Horticultural Plant Biology of Ministry of Education College of Horticulture and Forestry Sciences, Huazhong Agricultural University Wuhan 430070
翠菊(Callistephus chinensis)是当今世界主要一、二年生花卉之一、又是我国原产草花中之佼佼者。自1728年由我国传至欧洲然后遍栽世界各地后,至今风靡不衰(陈俊愉,2001)。然而,在翠菊的栽培过程中病虫害严重(穆红等,2004),不耐盐碱(刘淑贤,2002),鲜切花瓶插寿命短,不耐包装、运输、贮藏等问题一直影响着翠菊进一步的生产、应用和推广。通过植物转基因工程可以将外源基因导入花卉中,培育出抗虫、抗病新品种,而成功的基因转化首先要依赖于良好的植物受体系统的建立,因此利用组织培养技术进行翠菊植株再生体系的建立就成为一个值得研究的课题。
对翠菊的组织培养国内外研究比较少,滕年军等(2003)使用幼嫩茎段培养获得试管苗,但是该报道只涉及了翠菊的快速繁殖及器官再生途径的研究,未见对胚性愈伤组织、体胚的诱导及再生、体胚的发生发育过程进行深入的研究报道。通过器官发生途径由外植体分化不定芽然后再生植株,具有增殖系数高等优点,但由于不定芽常起源于多细胞,利用该体系充当遗传转化的受体系统时,会出现较多嵌合体而较难获得转基因植株。而相对于器官发生过程,体细胞胚胎发生途径是培养体细胞经历与合子胚发育相似的过程形成胚性结构,然后发育萌发为完整植株。不仅由于胚性细胞具有较强接收外源DNA能力使其具有较高转化效率,而且该系统遗传稳定性强,用于遗传转化时,可直接通过体胚发生途径获得转基因植株,因而被认为是最理想的基因转化受体系统(王关林等,2004;辛伟杰等,2006)。
本试验选用切花翠菊‘花束绯红’(C.chinensis ‘Bouquet Scarlet’)下胚轴作为试验材料,进行植株再生方面的研究,研究了翠菊体胚发生及植株再生体系,以期明确高效、稳定的体胚诱导、发育及成熟萌发条件,为提高种苗生产率、制作翠菊人工种子和通过遗传转化获得转基因植株奠定基础。
1 材料与方法 1.1 植物材料以切花翠菊‘花束绯红’(美国Bodger Seeds公司)的实生苗下胚轴作为研究对象。因翠菊种子比较难消毒,故采用先发芽后消毒的方法。取适量翠菊种子,凉水浸泡过夜,选取饱满种粒,自来水洗净后转到垫有滤纸的大培养皿中,于(24±2)℃的黑暗条件下催芽。间歇喷雾保持滤纸湿润。种子发芽后约7天,收集高约2~3 cm健壮幼苗,于超净工作台上以75%酒精浸泡40 s,然后用0.1%(W/V)的升汞溶液处理5~6 min,无菌水漂洗3~5次。取出消毒后的幼苗,切除根部及子叶,将下胚轴切成5 mm左右切段,充作外植体,接种于各种培养基上。
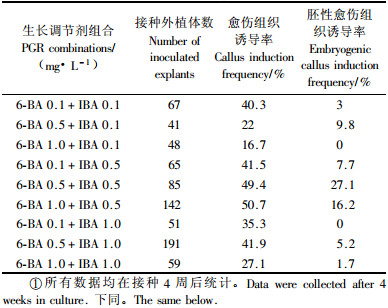
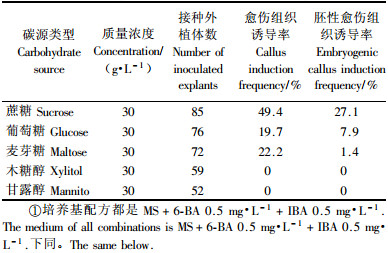
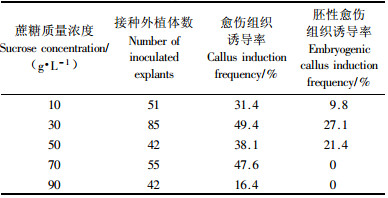
1.2 翠菊下胚轴胚性愈伤组织的诱导以MS作为基本培养基,附加3%蔗糖,8 g·L-1琼脂粉(如无特殊说明,下同),设计了不同浓度的植物生长调节剂完全随机组合(6-BA与IBA浓度梯度均为0.1,0.5,1.0 mg·L-1),不同碳源类型(蔗糖、葡萄糖、麦芽糖、木糖醇、甘露醇)(浓度为30 g·L-1),以及不同蔗糖浓度(10,30,50,70,90 g·L-1),探讨各因子对翠菊下胚轴愈伤组织及胚性愈伤组织诱导的影响。
培养基使用前,用1 mol·L-1 NaOH将pH值调至5.8~6.0,并在121 ℃、1.1 kg·cm-2压力下高温高压灭菌20 min。所有培养物均置于(24±2)℃下,暗培养。
试验中外植体数量不少于30个,在接种4周后,统计愈伤组织诱导率(形成愈伤组织外植体个数/接种外植体总数)及胚性愈伤组织诱导率(愈伤组织上形成了体胚的外植体个数/接种外植体总数)。本次试验中,将经过4周诱导培养后,能够在表面形成体胚的愈伤组织定义为胚性愈伤组织。
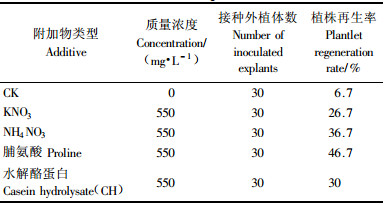
1.3 翠菊胚性愈伤组织植株再生的诱导将在MS+6-BA 0.5 mg·L-1 + IBA 0.5 mg·L-1培养基上诱导翠菊下胚轴获得的胚性愈伤组织,转入植株再生培养基上诱导植株再生。胚性愈伤组织接种于分别附加550 mg·L-1KNO3、NH4NO3、脯氨酸和CH(水解酪蛋白),以及不添加任何附加物(CK)的MS+6-BA 0.5 mg·L-1+IBA 0.5 mg·L-1培养基上进行植株再生诱导试验,接种外植体数不少于30团胚性愈伤组织,暗培养。处理4周后,统计体胚植株再生率,然后将处理物转入光照下进行光照培养,光照时数为每天14 h,温度为(24±2) ℃。
2 结果与分析 2.1 不同植物生长调节剂组合对下胚轴胚性愈伤组织诱导的影响翠菊‘花束绯红’下胚轴切段接种至不同植物生长调节剂组合培养基(表 1)上,1周之内外植体陆续从切口开始膨大,逐渐形成愈伤组织,2周后愈伤组织明显形成,4周后部分培养基上的外植体大量形成愈伤组织及黄色的体胚颗粒(图版Ⅰ-1)。在各种植物生长调节剂组合上,下胚轴都有不同程度愈伤组织的诱导(表 1),其中配方为6-BA 0.5 mg·L-1+IBA 0.5 mg·L-1组合,愈伤组织诱导率及体胚得率最高,胚性愈伤组织诱导率为27.1%,其他组合培养基上无论愈伤组织诱导率还是胚性愈伤组织诱导率都不及该配方。
|
|

|
图版Ⅰ Plate Ⅰ 1.诱导出体胚的下胚轴胚性愈伤组织;2.早期子叶胚;3.4.子叶胚:5.胚性愈伤组织上的体胚分化成芽(箭头指已经分化形成的幼芽);6.体胚分化芽丛;7.类似合子胚的萌发(箭头指胚根); 8.体胚萌发成苗;9.体胚畸形萌发。 1. Somatic embryos on embryogenic callus induced from hypocotyl cxplants of C. chinensis ' Biouquet Scarlet'; 2. Early cotyledonary stage; 3, 4. Cotyledonary stage; 5. Younger shoot derived from somatic embryo (Arrow marks a younger shoot); 6. Adventitious buds derived from somatic embryos; 7. Somatic embryo germination like zygotic embryo (Arrow marks a radicle); 8. Seedling derived from somatic embryo; 9. Malformed germination. |
将翠菊下胚轴接种于附加不同类型碳源的愈伤组织诱导培养基上,观察到不同类型碳源对翠菊下胚轴愈伤组织和胚性愈伤组织的诱导影响差异很大(表 2)。蔗糖对翠菊下胚轴的愈伤组织诱导最显著,愈伤组织诱导率为49.4%,胚性愈伤组织诱导率为27.1%;另外2种碳源(木糖醇和甘露醇)未见诱导出任何愈伤组织(表 2)。
|
|
测试了不同浓度的蔗糖对翠菊下胚轴愈伤组织诱导的影响。结果表明:浓度为30 g·L-1的蔗糖对翠菊下胚轴愈伤组织及胚性愈伤组织诱导最为有利,诱导率分别为49.4%,27.1%(表 3)。
|
|
将在MS+6-BA 0.5 mg·L-1+IBA 0.5 mg·L-1培养基上诱导获得的胚性愈伤组织接种于附加不同类型促进植株再生的附加物(KNO3、NH4NO3、脯氨酸、CH浓度均为550 mg·L-1)的培养基(CK:MS+0.5 mg·L-1 6-BA+0.5 mg·L-1 IBA)上(表 4),进行植株再生的诱导,4周暗培养结束之后,将培养物转入光下培养。结果表明添加550 mg·L-1脯氨酸的植株再生诱导培养基的植株再生率最高,为46.7%;不添加任何附加物的对照亦有低频体胚植株再生(表 4)。
|
|
使用各种配方诱导翠菊胚性愈伤组织的植株再生,陆续观察到最初得到的黄色颗粒(暗培养;图版Ⅰ-1),在经过植株再生诱导后,发育形成早期子叶胚(图版Ⅰ-2)和具有明显双子叶的子叶胚(图版Ⅰ-3,4)。这些培养物继续发育抽生叶片,形成丛生芽(图版Ⅰ-5,6),丛生芽分割后能够继续生长。同时观察到,体胚能够类似于合子胚萌发的方式再生植株,即直接分化出芽和根(图版Ⅰ-7,8),但是发生频率较低(< 5%),体胚再生植株的过程,也时有畸形萌发现象,即直接抽生出没有茎的肉质化叶片(图版Ⅰ-9),这种诱导产物不能最终形成完整植株。
3 结论与讨论 3.1 翠菊体细胞胚胎发生的影响因素根据试验研究,翠菊‘花束绯红’的下胚轴是能够诱导体胚发生的外植体材料。据报道,胶皮枫香树(Liquidambar styraciflua) (Sommer et al., 1980)实生幼苗下胚轴,棉属野生种克劳茨基棉(Gossypium klotzschianum)(Sun et al., 2003)的下胚轴,都可诱导获得胚性愈伤组织,并通过体胚发生方式再生植株。影响体胚发生的因素,除了物种基因型本身、诱导激素类型和浓度配比之外,外植体所处的发育时期也具有较为重要的作用。使用下胚轴这些脱离胚胎阶段不久或者正处于胚胎阶段(未成熟胚、成熟胚)(杜丽等,2006;Du et al., 2007;王海波等,1989;王海波,1991)的外植体,其细胞所处发育阶段的特点决定,其中的某些细胞容易被诱导,朝着类似于合子胚的发育方向发育,从而诱导体胚产生。
3.2 翠菊胚性愈伤组织植株再生在翠菊的体胚植株再生研究中,体胚没能完全按照合子胚萌发方式形成单个的再生植株,而是类似于体胚外植体的器官发生。在对香樟(Cinnamomum camphora)体细胞胚胎发生的研究中(杜丽等,2006;Du et al., 2007)也曾报道,诱导获得的香樟体胚大多不能以合子胚萌发方式再生植株,而是诱导体胚不定芽再生之后,再经生根诱导,最终获得完整植株。在长寿花(Kalanchoe blossfeldiana)(陈超等,2004)和花烛(Anthurium andraeanum)(辛伟杰等,2006)体胚植株再生的研究中,同样观察到上述相似体胚植株再生现象,即体胚并非直接形成完整小植株,而是在体胚的基础上形成丛生芽。这可能与组成体胚的各个细胞具有较强细胞全能性表达活力有关,在一个独立体胚的发育过程中,如果体胚组成部分的细胞同时在表达细胞全能性,这样就会使得体胚不能以单个独立类似合子胚的形态出现,而以紧密相连珊瑚状的形态出现,如果时机成熟,所有体胚一起萌发形成芽,就形成丛生芽;也可能与培养基中细胞分裂素的浓度过高有关,以体胚作为外植体诱导产生不定芽的分化,而非类似于合子胚的发育。有研究(王海波等,1989;王海波,1991)认为:体胚发生更像是器官发生的特例,或者说器官发生是体胚发生的一系列变态形式。正确、有效的人为调控,可使器官发生的方式转变成体胚发育。如何通过控制激素配比或者其他附加成分等影响因素,从而人为调控翠菊同一外植体在离体培养时的器官、体胚发生,尚待进一步研究。
陈超, 王桂兰, 田立民, 等. 2004. 长寿花胚性愈伤组织的诱导及胚状体再生. 园艺学报, 31(2): 249-252. DOI:10.3321/j.issn:0513-353X.2004.02.026 |
陈俊愉. 2001. 中国花卉品种分类学. 北京: 中国林业出版社.
|
杜丽, 叶要妹, 包满珠. 2006. 香樟未成熟合子胚体胚发生及影响因素的研究. 林业科学, 42(6): 37-39. |
刘淑贤. 2002. 几种露地花卉种子萌发期耐盐性研究. 内蒙古民族大学学报, 17(3): 228-230. DOI:10.3969/j.issn.1671-0185.2002.03.011 |
穆红, 王敏慧, 于殿成. 2004. 东北地区草本花卉常见病虫害防治. 中国林副特产, (2): 51-52. DOI:10.3969/j.issn.1001-6902.2004.02.034 |
滕年军, 陈发棣. 2003. 翠菊的组织培养. 植物生理学通讯, 39(3): 227. |
王关林, 方宏筠. 2004.植物基因转化受体系统的建立//王关林, 方宏筠.植物基因工程.北京: 科学出版社, 344-359.
|
王海波, 方仁, 王培, 等. 1989. 小麦胚性细胞系的建立及原生质体的培养. 作物杂志, (3): 26-28. |
王海波. 1991. 组织培养中细胞状态的调控. 作物杂志, (3): 3-6. |
辛伟杰, 徐彬, 王广东. 2006. 花烛体细胞胚胎发生及植株再生研究. 园艺学报, 33(6): 1281-1286. DOI:10.3321/j.issn:0513-353X.2006.06.020 |
Du Li, Zhou Suo, Bao Manzhu. 2007. Effect of plant growth regulators on direct somatic embryogenesis in camphor tree (Cinnamomum camphora L.) from immature zygotic embryos and induction embryogenic calli. Forestry Studies in China, 9(4): 267-271. DOI:10.1007/s11632-007-0042-y |
Sommer H E, Brown C L. 1980. Embryogenesis in tissue cultures of sweetgum. For Sci, 26: 257-260. |
Sun Yuqiang, Zhang Xianlong, Jin Shuangxia, et al. 2003. Somatic embryogenesis and plant regeneration in wild cotton (Gossypium klotzschianum). Plant Cell, Tissue and Organ Culture, 75: 247-253. DOI:10.1023/A:1025895631247 |
 2009, Vol. 45
2009, Vol. 45