文章信息
- 李娜, 李建, 刘海丰, 桑卫国.
- Li Na, Li Jian, Liu Haifeng, Sang Weiguo
- 东灵山3种落叶阔叶林的碳氮元素含量及比率
- Content and Ratio of Carbon and Nitrogen of Three Types of Warm Temperate Deciduous Broadleaf Forests in Dongling Mountain
- 林业科学, 2009, 45(8): 82-87.
- Scientia Silvae Sinicae, 2009, 45(8): 82-87.
-
文章历史
- 收稿日期:2009-04-20
-
作者相关文章
2. 中国科学院研究生院 北京 100049;
3. 北京市门头沟区绿化委员会 北京 102300
2. Graduate University of Chinese Academy of Sciences Beijing 100049;
3. Mentougor Afforestation Commission of Beijing Beijing 102300
生态化学计量学是一门新兴的学科(曾德慧等,2005),最早可以追溯到20世纪40年代(Lindeman,1942; Reiners,1986; Hecky et al., 1988)。目前,该学科的研究重点集中在海洋生态系统,诸如海洋生物的种群动态、共生寄生关系与营养物质循环等。Redfield(1958)发现在养分不受限制时浮游生物体内C:N:P比例近乎恒定,并通过试验确定C:N:P=106:16:1,这一比值被广泛接受,并称之为Redfield比值。Redfield比值的发现极大地促进了海洋生态系统生态化学计量学的研究,该比值现已成为海洋生态系统研究的重要定律之一(Redfield,1958; McGroddy et al., 2004)。Redfield比值已经在诸如海洋的氮磷循环(Codispoti,1995; Cooper et al., 1996; Field et al., 1998; Sarmiento et al., 1998; Lenton et al., 2000)、海洋大气CO2交换(Sigman et al., 2000)及净初级生产力的营养限制(Falkowski et al., 1997)等生物地球化学循环研究中起到了重要的指示和引导作用,它的出现推动了科学家在全球尺度上研究生物地球化学循环过程。
尽管生态化学计量学在海洋生态系统中得到了广泛研究(Dodds et al., 2004; Hessen et al., 2004; Sterner et al., 2002),但它在陆地生态系统中的研究还刚起步(Deevey,1970; Reiners,1986; Elser et al., 2000)。在陆地生态系统中各种元素耦合紧密,无法单独地去研究单个个体和种群的元素循环(Chapin et al., 1989; Vitousek,1982),而且由于土壤这种化学元素的主要载体是一种暗箱,空间异质性高,也不利于元素循环的研究(McGroddy et al., 2004),这些都是未来陆地生态系统生态化学计量学研究工作开展的难点。目前,相对于国际上生态化学计量学的研究,在国内相关研究尚未受到广泛关注(Zhang et al., 2003)。当前,国际上有关陆地生态系统生态化学计量学的研究主要集中在植物凋落物、植物叶片和动物食物等方面,与土壤和土壤微生物相关的研究报道较少(Ge et al., 2008; Cleveland et al., 2007)。尽管以前的研究表明微生物群体的C:N比率处于一个变动范围(8:1~12:1)之间(Paul et al., 1996; Wright et al., 2000; Cleveland et al., 2007),但对土壤微生物群体来说这个比率范围是否合适,土壤微生物群体是否也有一个受限制的C:N比率,未见相关报道。此外有关土壤微生物和土壤环境之间化学计量学关系的研究也很少。本研究分析东灵山暖温带落叶阔叶林3种典型林型乔木层、土壤微生物和土壤层的碳氮元素含量的变化规律,以及3种林型的乔木层、土壤微生物和土壤层的C:N比率是否存在受限制的化学计量学特征。
1 研究区概况研究区位于北京市门头沟东灵山中国科学院北京森林生态系统定位研究站(115°26′ E,39°58′ N)。东灵山海拔1 100 m,为温带半湿润季风气候,冬季气温低,年平均气温2~8 ℃,≥10 ℃年积温为3 600~3 800 ℃;全年降水集中在夏季,年均降水量约600 mm;6—8月降水量为300~400 mm;全年无霜期在160天以下。
东灵山森林植被保存良好,是暖温带落叶阔叶林地带性植被的代表类型。该区的原生植物群落基本上已被破坏殆尽,现存的多为天然次生林。定位站研究范围内分布有3种典型林型:白桦(Betula platyphylla)林、辽东栎(Quercus liaotungensis)+棘皮桦(Betula dahurica)林和辽东栎林(马克平等,1997; 江洪等,1994)。白桦林内主要乔木树种有白桦、山柳(Salix caprea)、棘皮桦、山杨(Populus davidiana)、辽东栎、色木槭(Acer mono)、□木(Cornus bretschneideri)和大叶白蜡(Fraxinus rhynchophylla),以白桦为优势种;辽东栎+棘皮桦林主要乔木树种有辽东栎、棘皮桦、糠椴(Tilia mandshurica)、色木槭、大叶白蜡、白桦、北京丁香(Syringa pekinensis)和山柳,以辽宁栎和棘皮桦为优势种;辽东栎林主要乔木树种有辽东栎、色木槭、棘皮桦、蒙椴(Tilia mongolica)和大叶白蜡,以辽东栎为优势种。
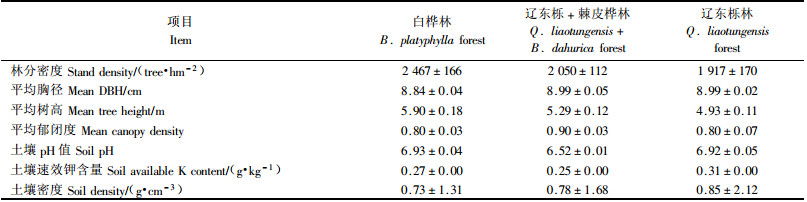
2 研究方法 2.1 样品采集试验于2006年7月进行。为了保证3种林型群落生态因子的相似性,选择样地时尽量保持地形因子一致(表 1),每个林型随机设置3个样地。样地林分状况见表 2。试验样地的土壤均为山地棕壤土,成土母质为花岗岩(江洪等,1994),土层厚度大于60 cm (孙世洲,1997),土壤理化性质见表 2。
|
|
|
|
每个样地按投影面积40 m × 30 m设置,并进一步划分成5 m × 5 m的48个小样方进行调查并取样。野外调查数据包括样地内每木胸径和高度,其中死树作为凋落物处理,树高低于1.3 cm的小树不做调查。植物样品采集:根据野外调查确定每个样地主要乔木树种标准木3株,取其树干、树枝、树冠外围叶片、树冠内侧叶片、根颈、粗根(直径>2 cm)和细根(直径≤2 cm);树干用树芯法钻取,树枝和叶片用高枝剪剪取,根部用10 cm根钻钻取(Clevel et al., 2006);所有采集好的样品于60 ℃烘箱内烘干,保存备用。土壤样品采集:土壤样品取自0~20 cm土层,同时收集覆盖在相应土壤表面的凋落物,包括部分枯木和枯枝;每个小样方采集1个土壤混合样,1个混合样由10钻土混合,采回的土壤混合样品充分混匀后过2 mm筛,然后平分成2份,1份在室温(20 ℃)下风干,另一份储藏在4 ℃冰箱用于土壤微生物碳氮含量的测定;收集的凋落物放在室温(20 ℃)下风干后,磨碎混匀,用于室内分析。
2.2 室内分析植物器官样品烘干至恒质量后,粉碎磨细混匀,用2400 Ⅱ CHNS/O元素分析仪测定全氮和全碳含量。风干的土壤样品过0.25 mm筛后加入其质量1/4的磨碎混匀的凋落物,分为2份,1份在105 ℃下测定土壤含水量,另1份测定土壤有机碳和全氮含量。有机碳含量采用浓硫酸-重铬酸钾外源加热法测定,全氮含量采用凯氏定氮法测定,土壤密度用环刀法测定,土壤pH值用pH计测定,速效钾用1 mol·L-1醋酸铵法测定(中国科学院南京土壤研究所,1978)。土壤微生物碳和氮含量用氯仿熏蒸抽提法测定(Vance et al., 1987; Brookes et al., 1985)。
2.3 数据处理通过已建立的植物各器官维量方程分别计算出各器官的生物量(江洪,1997; 黄建辉等,1997),然后结合相应器官室内分析的碳氮元素含量,计算出各器官的碳氮元素总量并相加作为单株树木的碳氮元素总量,最后计算碳氮元素总量与该株树木生物量总量的比值,即为该株树木的平均碳氮元素含量。以3株同种树木的碳氮元素含量的平均值作为相应样地内该物种的碳氮元素含量,与样地内由维量方程计算得到的该物种所有树木的生物量总量相乘即得到该样地内该物种碳氮元素的总量。以样地内所有乔木物种碳氮元素的总量与所有乔木物种生物量总量的比值作为该样地乔木层的碳氮元素含量。1个林型3个样地乔木层的碳氮元素含量的平均值作为该林型乔木层的碳氮元素含量。C:N比率为碳元素含量与氮元素含量的比值。
根据室内碳氮元素试验分析结果,分别计算了3种林型乔木层、土壤(0~20 cm)层和土壤微生物(0~20 cm土层)的碳含量、氮含量及C:N比率。在统计分析时,就不同林型的乔木层、土壤和土壤微生物的碳含量、氮含量和C:N比率分别用SPSS 13.0作了基于0.05水平的单因素方差分析,对差异显著的项目,进一步用Tukey’s HSD法做了比较。在各数据不能满足正态分布的情况下,进行了必要的对数转换以满足单因素方差分析的假定条件。
利用SMA法(standardized major axis method)以y=a+bx为模型分析每个林型土壤碳氮元素与土壤微生物碳氮元素之间的关系(Warton et al., 2006),分析了包括土壤碳与土壤氮、土壤微生物碳与土壤微生物氮、土壤碳与土壤微生物碳以及土壤氮与土壤微生物氮两两之间的关系。SMA法比最小二乘回归法能更好地拟和2个变量之间的最适线性模型(Cleveland et al., 2007),所有关系均用SMATR软件进行分析(Falster et al., 2006)。
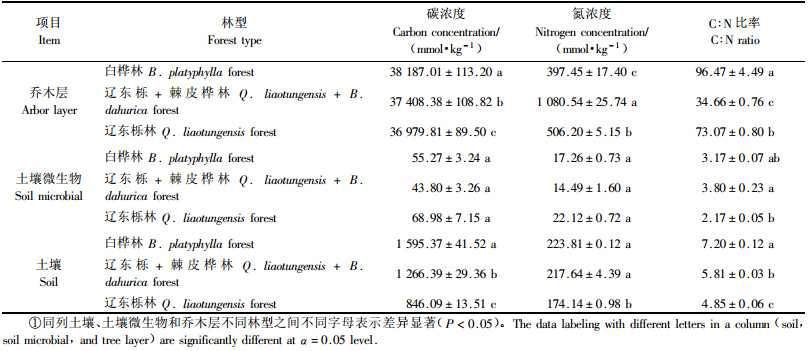
3 结果与分析 3.1 碳氮元素含量3种林型土壤、乔木层和土壤微生物的碳氮元素含量差别较大,每个林型都有各自的特点(表 3)。方差分析表明,3种林型的碳氮元素含量在土壤和乔木层中差异显著(P<0.05),而在土壤微生物中差异不显著(P>0.05)。进一步多重比较分析发现,土壤的碳氮元素含量表现为白桦林>辽东栎+棘皮桦林>辽东栎林;乔木层碳元素含量变化趋势与土壤相同,其氮元素含量在辽东栎+棘皮桦林最高,是其他2种林型的2倍(表 3)。综合表 3分析结果表明3种林型土壤与乔木层的碳氮元素含量变化较大,而土壤微生物碳氮元素含量变化相对较小。
|
|
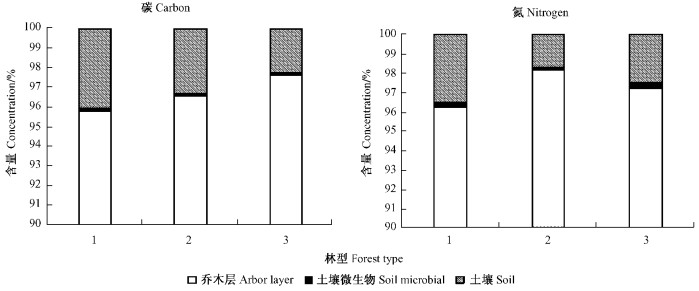
碳氮元素含量百分比组成分析表明,3种林型的碳元素含量所占比例变化主要发生在乔木层和土壤,土壤微生物中变化较小,而氮元素所占比例在3个层次中均有较大的变化(图 1)。在乔木层碳元素含量百分比表现为白桦树>辽东林+棘皮桦林>辽东栎林,氮元素含量百分比表现为辽东栎+棘皮桦林>辽东栎林>白桦林;而在土壤层碳元素含量百分比表现为白桦林>辽东栎+棘皮桦林>辽东栎林,氮元素含量百分比表现为白桦林>辽东栎林>辽东栎+棘皮桦林。
|
图 1 碳氮元素含量百分比 Figure 1 Percentage of C and N concentration 1:白桦林B. platyphylla forest; 2:辽东栎林+棘皮桦林Q. liaotungensis+B. dahurica forest; 3:辽东栎林Q. liaotungensis forest |
SMA分析结果显示,3种林型土壤的碳含量与氮含量之间有极强的正相关关系(r2=0.70,P < 0.000 1),土壤微生物的碳含量与氮含量之间也有极强的正相关关系(r2=0.71,P < 0.000 1),说明土壤和土壤微生物各自的碳氮元素含量之间有极强的线性关系。此外,土壤碳含量与土壤微生物碳含量、土壤氮含量与土壤微生物氮含量之间均没有出现相关性,这一结果表明土壤微生物的碳氮元素含量不受土壤碳氮元素含量变化的影响。
3.2 C:N比率3种林型乔木层的C:N比率远高于土壤和土壤微生物,表明乔木层的碳元素含量与氮元素含量差异最显著,乔木层的C:N比率在辽东栎+棘皮桦林最低(34.66),在白桦林中最高(96.47)。土壤的C:N比率表现为白桦林>辽东栎+棘皮桦林>辽东栎林。而土壤微生物的C:N比率变化较小,最高值出现在辽东栎+棘皮桦林(3.80),最低值出现在辽东栎林(2.17),总的来看变化幅度不明显(表 3)。
从整体来看,3种林型的土壤和土壤微生物的C:N比率是明显受限制的,3个林型之间变化不是很大,3种林型土壤和土壤微生物的C:N比率分别近似于6:1和3:1。而在乔木层C:N比率受限制的现象不明显,变化较大。
4 结论与讨论许多研究结果表明在大尺度上土壤层对于截获和储存氮来说比植被层更重要(Nadelhoffer et al., 1999; Johnson,1992; Fenn et al., 1998)。本研究表明,辽东栎+棘皮桦林的乔木层含氮量最高,具有比土壤层更强的氮元素固持能力。此外有关氮元素添加和示踪试验也已显示植物可以利用和储存添加的氮元素(Fenn et al., 1998),这一结果对如何解决当前全球氮沉降问题有重要的参考价值。辽东栎+棘皮桦林的高含氮量与该森林群落植物多样性高密不可分。由于植物多样性高,群落植物可以更充分地利用氮营养生态位;同时,植物群落对氮元素的需求与氮元素供给的同步性也影响氮元素的储存(Fenn et al., 1998);生态系统中外部环境复杂化影响植物响应氮沉降(Pamela et al., 2002)。
一般而言,生物有机体受自身生理结构的控制具有固定的元素组成比例(Redfield,1958; Reiners,1986; Sterner et al., 2002)。这一点,在海洋生态系统的浮游生物中最为明显。海洋浮游生物是一个自我稳定的动态平衡体,无论海水中元素含量如何变化,其自身的元素组成始终保持一个稳定的比例,具有受限制的特点(Redfield,1958)。本研究结果显示,东灵山暖温带落叶阔叶林3种典型林型下土壤微生物的C:N比率也具有受限制的化学计量特征,并且结果显示土壤微生物含量变化没有受土壤氮碳元素含量变化的影响,这不同于全球尺度发现的结果(Cleveland et al., 2007)。这是因为土壤微生物也是一类具有自我平衡功能的生物有机体,可以通过调控自身结构组成和种群动态来改变微生物群落组成,因此能够保持稳定的C:N比率(Griffiths et al., 1992; Timan et al., 1996; Hansen,1999; He et al., 2002)。
大尺度水平上地理环境具有极大的变异性,同时不同生境的植被类型也大不相同,这就使得土壤元素比率和植物元素比率在不同的环境下差异较大,一般不会出现有规律的化学计量学特征(Reich et al., 2004; McGroddy et al., 2004)。但是本研究表明土壤的C:N比率(变化范围4.5~7.5)在暖温带落叶阔叶林3个不同林型中具有受限制的特征。对于本研究中土壤的C:N比率为什么也会出现受限制的化学计量特征,需要更广泛更综合的试验研究。
黄建辉, 孔繁志, 江洪. 1997.东灵山地区落叶阔叶林乔木层营养元素积累量特征研究//陈灵芝.暖温带森林生态系统结构与功能的研究.北京: 科学出版社, 265-271.
|
江洪. 1997.东灵山典型落叶阔叶林生物量的研究//陈灵芝.暖温带森林生态系统结构与功能的研究.北京: 科学出版社, 104-115.
|
江洪, 黄建辉, 陈灵芝, 等. 1994. 东灵山植物群落的排序、数量分类与环境解释. 植物学报, 36(7): 539-551. |
马克平, 陈灵芝, 于顺利, 等. 1997.北京东灵山地区植物群落的基本类型//陈灵芝.暖温带森林生态系统结构与功能的研究.北京: 科学出版社, 56-75.
|
孙世洲.1997.东灵山地区的地质、地貌和土壤//陈灵芝.暖温带森林生态系统结构与功能的研究.北京: 科学出版社, 10-27.
|
曾德慧, 陈广生. 2005. 生态化学计量学:复杂生命系统奥秘的探索. 植物生态学报, 29(6): 1007-1019. DOI:10.3321/j.issn:1005-264X.2005.06.018 |
中国科学院南京土壤研究所. 1978. 土壤理化性质分析. 上海: 上海科学出版社.
|
Brookes P C, Landman A, Pruden G, et al. 1985. Chloroform fumigation and the release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen in the soil. Soil Biology & Biochemistry, 17: 837-842. |
Chapin F S Ⅲ, Shaver G R. 1989. Differences in growth and nutrient use among arctic plant growth forms. Functional Ecology, 3: 73-80. DOI:10.2307/2389677 |
Cleveland C C, Liptzin D. 2007. C:N:P stoichiometry in soil: is there a "Redfield ratio" for the microbial biomass. Biogeochemistry, 85: 235-252. DOI:10.1007/s10533-007-9132-0 |
Cleveland C C, Townsend A R. 2006. Nutrient additions to a tropical rain forest drive substantial soil carbon dioxide losses to the atmosphere. Proceedings of the National Academy of Sciences of the United States of America, 103: 10316-10321. DOI:10.1073/pnas.0600989103 |
Codispoti L A. 1995. Is the ocean losing nitrate. Nature, 376: 724. DOI:10.1038/376724a0 |
Cooper D J, Watson A J, Nightingale P D. 1996. Large decrease in ocean-surface CO2 fugacity in response to in situ iron fertilization. Nature, 383: 511-513. DOI:10.1038/383511a0 |
Deevey E S. 1970. Mineral cycles. Scientific American, 223: 149-158. |
Dodds W K, Marti E, Tank J L, et al. 2004. Carbon and nitrogen stoichiometry and nitrogen cycling rates in streams. Oecologia, 140: 458-467. DOI:10.1007/s00442-004-1599-y |
Elser J J, Fagan W F, Denno R F, et al. 2000. Nutritional constraints in terrestrial and freshwater food webs. Nature, 408: 578-580. DOI:10.1038/35046058 |
Falkowski P G, Raven J A. 1997. Aquatic photosynthesis. Oxford, UK: Blackwell Science, 200-206.
|
Falster D S, Warton D I, Wright I J. 2006. SMATR: standardized major axis tests and routines, ver 2.0. [EB/OL].[2008-03-19].http://www.bio.mq.edu.au/ecology/SMATR/. http://www.bio.mq.edu.au/ecology/SMATR/
|
Fenn M E, Poth M A, Aber J D, et al. 1998. Nitrogen excess in North American ecosystems: predisposing factors, ecosystems responses, and management strategies. Ecological Applications, 8: 706-733. DOI:10.1890/1051-0761(1998)008[0706:NEINAE]2.0.CO;2 |
Field C B, Behrenfeld M J, Randerson J T, et al. 1998. Primary production of the biosphere: integrating terrestrial and oceanic components. Science, 281: 237-240. DOI:10.1126/science.281.5374.237 |
Ge Y, He J Z, Zhu Y G, et al. 2008. Differences in soil bacterial diversity: driven by contemporary disturbances or historical contingencies. The ISME Journal, 2: 254-264. DOI:10.1038/ismej.2008.2 |
Griffiths B S, Welschen R, van Arendonk J J C M, et al. 1992. The effect of nitrate-nitrogen supply on bacteria and bacterial-feeding fauna in the rhizosphere of different grass species. Oecologia, 91: 253-259. DOI:10.1007/BF00317793 |
Hansen R A. 1999. Red oak litter promotes a microarthropod functional group that accelerates its decomposition. Plant and Soil, 209: 37-45. DOI:10.1023/A:1004506414711 |
He J S, Bazzaz F A, Schmid B. 2002. Interactive effects of diversity, nutrients and elevated CO2 on experimental plant communities. Oikos, 97: 337-348. DOI:10.1034/j.1600-0706.2002.970304.x |
Hecky R E, Kilham P. 1988. Nutrient limitation of phytoplankton in freshwater and marine environments: a review of recent evidence on the effects of enrichment. Limnology Oceanography, 33: 796-822. |
Hessen D O, Agren G I, Anderson T R, et al. 2004. Carbon, sequestration in ecosystems: the role of stoichiometry. Ecology, 85: 1179-1192. DOI:10.1890/02-0251 |
Johnson D W. 1992. Nitrogen retention in forest soils. Journal of Environmental Quality, 21: 1-12. |
Lenton T M, Watson A J. 2000. Redfield revisited: 1. Regulation of nitrate, phosphate, and oxygen in the ocean. Global Biogeochemical Cycles, 14: 225-248. DOI:10.1029/1999GB900065 |
Lindeman R L. 1942. The trophic-dynamic aspect of ecology. Ecology, 23: 399-418. DOI:10.2307/1930126 |
McGroddy M E, Daufresne T, Hedin L O. 2004. Scaling of C:N:P stoichiometry in forests worldwide: implications of terrestrial redfield-type ratios. Ecology, 85: 2390-2401. DOI:10.1890/03-0351 |
Nadelhoffer K, Downs M R, Fry B, et al. 1999. Controls on N retention and exports in a fertilized watershed. Environmental Monitoring and Assessment, 55: 187-210. DOI:10.1023/A:1006190222768 |
Pamela M, Kathleen A L, Sharon J H. 2002. The Globalization of nitrogen deposition: consequences for terrestrial ecosystems. Ambio, 31: 113-119. DOI:10.1579/0044-7447-31.2.113 |
Paul E A, Clark F E. 1996. Soil microbiology and biochemistry. San Diego: Academic Press, 5-10.
|
Redfield A. 1958. The biological control of chemical factors in the environment. American Scientist, 46: 205-221. |
Reich P B, Oleksyn J. 2004. Global patterns of plant leaf N and P in relation to temperature and latitude. Proceedings of the National Academy of Sciences of the United States of America, 101: 11001-11006. DOI:10.1073/pnas.0403588101 |
Reiners W A. 1986. Complementary models for ecosystems. American Naturalist, 127: 59-73. DOI:10.1086/284467 |
Sarmiento J L, Hughes T M C, Stouffer R J, et al. 1998. Simulated response of the ocean carbon cycle to anthropogenic climate warming. Nature, 393: 245-249. DOI:10.1038/30455 |
Sigman D M, Boyle E A. 2000. Glacial/interglacial variations in atmospheric carbon dioxide. Nature, 407: 859-869. DOI:10.1038/35038000 |
Sterner R W, Elser J J. 2002. Ecological stoichiometry: the biology of elements from molecules to the biosphere. New Jersey, USA: Princeton University Press, 103-106.
|
Timan D, Wedin D, Knops J. 1996. Productivity and sustainability influenced by biodiversity in grassland ecosystems. Nature, 379: 718-720. DOI:10.1038/379718a0 |
Vance E D, Brookes P C, Jenkinson D S. 1987. An extraction method for measuring soil microbial biomass C. Soil Biology & Biochemistry, 19: 703-707. |
Vitousek P M. 1982. Nutrient cycling and nutrient use efficiency. American Naturalist, 119: 553-572. DOI:10.1086/283931 |
Warton D I, Wright D S, Westoby M. 2006. Bivariate line-fitting methods for allometry. Biological Reviews, 81: 259-291. |
Wright C J, Coleman D C. 2000. Cross-site comparison of soil microbial biomass, soil nutrient status, and nematode trophic groups. Pedobiologia, 44: 2-23. DOI:10.1078/S0031-4056(04)70024-4 |
Zhang L X, Bai Y F, Han X G. 2003. Application of N:P stoichiometry to ecology studies. Acta Botanica Sinica, 45: 1009-1018. |
 2009, Vol. 45
2009, Vol. 45