文章信息
- 柯裕州, 周金星, 张旭东, 孙启祥, 左力.
- Ke Yuzhou, Zhou Jinxing, Zhang Xudong, Sun Qixiang, Zuo Li
- 盐胁迫对桑树幼苗光合生理生态特性的影响
- Effects of Salt Stress on Photosynthetic Characteristics of Mulberry Seedlings
- 林业科学, 2009, 45(8): 61-66.
- Scientia Silvae Sinicae, 2009, 45(8): 61-66.
-
文章历史
- 收稿日期:2008-06-16
-
作者相关文章
2. 西藏自治区林业局 拉萨 850000
2. The Forestry Bureau of Tibet Municipality Lasa 850000
土壤盐渍化是农林资源生产力下降的1个主要逆境因素.目前, 全世界的盐渍化土地约占陆地面积的1/3, 有100多个国家存在着不同类型的盐碱地(林栖凤等, 2000).我国的盐渍土总面积约130多万hm2, 且还不断增加(王继和等, 2001).如何利用和开发我国上亿亩盐渍化土壤, 已成为我国农、林业生产中十分迫切和重要的任务.目前, 生物措施是盐碱地综合治理中的主要方面, 发掘更多的耐盐植物是当前抗盐性研究的重要内容, 尤其是具有经济效益的耐盐植物材料.
桑树(Morus alba)是我国常见的1个乡土树种, 它品种多, 分布广, 适应性强, 应用广泛.除了原有的桑蚕业外, 在饲料、食品、医药保健等方面发展迅速(蔡文祥, 1996; 何雪梅等, 2005; 宋沁等, 2003), 荒山绿化、防沙治沙、治理水土流失等生态治理方面作用也日益突出(胡卫民, 2002; 宋宝林等, 2002).目前, 桑产业的发展正从东南经济发达地区向内陆干旱、盐渍化地区转移, 因此桑树的抗盐性研究是实现桑树在盐渍环境中大面积推广的主要前提.本试验采用盆栽加盐方式来人工模拟盐胁迫环境, 通过对其光合生理指标及其光响应和CO2响应曲线的测定, 来研究盐胁迫下桑树光合生理特性变化, 了解桑树对盐胁迫的适应机制, 为桑树能够在盐碱地综合治理应用提供理论依据.
1 材料与方法 1.1 试验设计与处理试验在中国林业科学研究院林业研究所良乡基地(北京市房山区良乡镇黄幸庄)日光温室内进行. 2006年采种于良乡基地内1株树龄15年野生桑树, 即采即播. 2007年4月上旬在桑苗未萌芽前将地径相似(约1 cm)的1年生实生桑苗装入30 cm×24 cm的塑料盆中, 保留30 cm短剪, 每盆干土8 kg(取自于基地土的表土, 剔除杂物晒干, 混合均匀后称质量装盆), 每盆1株.待新梢长至15~20 cm左右, 于5月底(5月29日)选择生长一致的盆栽苗木进行加盐处理, 盆下放置塑料托盘, 以防止盐分渗失.加盐前5天实行控水, 以利盐水在干燥土壤中扩散.加盐时, 盐溶入水中(1.5 L), 1次性缓慢渗入.处理期间, 盆面覆盖塑料薄膜, 每隔1天补水1次, 使盆土含水量保持在35%~50%左右.
盐分梯度的设置:采用盐分和土壤干质量之比(NaCl浓度=NaCl质量/盆土干质量×100)设置成5个梯度进行盐胁迫处理, 即0(CK), 0.1%(T0.1), 0.3%(T0.3), 0.5%(T0.5), 0.7%(T0.7).
1.2 光合生理指标测定于处理后的第1, 2, 3, 7天, 采用定株定叶的方式(最长枝条的第4片叶), 测量其光合生理生态指标, 并于第3天进行光响应曲线和CO2响应曲线测定.每个处理重复5次.
测定的光合生理生态参数:叶片净光合速率(net photosynthetic rate, Pn)、蒸腾速率(transpiration rate, Tr)、气孔导度(stomatal conductance, Gs)、胞间CO2浓度(intercellular CO2 concentrations, Ci)等, 并计算气孔限制值(stomatal limits, Ls)、水分利用效率(water use efficiency, WUE)、瞬时羧化速率(instant carboxyl use efficiency, CUE)和瞬时光能利用率(instant solar energy use efficiency, SUE), 换算公式分别为Ls=1-Ci/Ca, WUE=Pn/Tr, CUE=Pn/Ci, SUE=Pn/PAR.
1.2.1 同一光强、温度、CO2浓度条件下的光合生理指标测定采用美国Licor公司生产的Li-6400便携式光合测定系统进行光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等光合气体交换参数测定.测定时, 光合有效辐射(PAR)设定为1 000 μmol·m-2s-1、CO2浓度(Ca)为400μmol·mol-1、气孔速率为0.5流速为400μmol·s-1、温度设定为(28±1) ℃.
1.2.2 光响应曲线测定利用Li-6400便携式光合测定仪进行光响应曲线的测定.测定条件:光合有效辐射(PAR)设定为1 500, 1 200, 1 000, 800, 600, 400, 300, 200, 150, 50, 0 μmol·m-2s-1、CO2浓度(Ca)设为400 μmol·mol-1、气孔速率为0.5、流速为400 μmol·S-1、温度为(28±1) ℃.
1.2.3 CO2响应曲线测定利用Li-6400便携式光合测定仪进行CO2响应曲线的测定.测定条件:光合有效辐射(PAR)设定为1 000 μmol·m-2s-1, CO2浓度(Ca)设为0, 50, 100, 200, 300, 400和600 μmol·mol-1, 空气流量为400 μmol·s-1, 气孔速率为0.5, 温度为(28±1)℃.
1.3 数据统计分析数据处理在Exce2003中进行, 并通过SPSS13.1统计软件进行模型拟合及方差和多重比较(采用Duncan新复极差法进行多重比较). 0~200 μmol·m-2s-1光强范围内, 进行Pn-PAR线性拟合, 求得表观量子效率(apparent quantum yield, AQY)和光补偿点(light compensation point, LCP), 此外, 最大净光合速率(Pmax)和光饱和点(light saturation point, LSP)则采用Bassman等(1991)提出的经验方程来推算(周玉梅等, 2002):
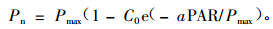
|
(1) |
式中:Pmax为最大净光合速率; ɑ为弱光下光量子利用效率(即表观量子效率AQY); C0为一度量弱光条下净光合速率趋近于零的指标.通过适合性检验, 若方程拟合效果良好, 则可用下式计算光饱和点(LSP):
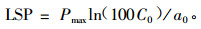
|
(2) |
0~200 μmol·m-2s-1胞间CO2浓度范围内, 进行Pn-Ci线性拟合, 求得表观羧化效率(apparent carboxyl efficiency, ACE)和CO2补偿点(CO2 compensation point, CCP); 由于在0~600 μmol·m-2s-1范围内, Pn没达到饱和, 难以计算其一定CO2浓度下的最大光合速率和CO2饱和点.
2 结果与分析 2.1 不同盐浓度下光合生理生态指标的比较不同NaCl处理的桑树幼苗各种生理生态指标见表 1.盐胁迫对桑树幼苗各种生理生态指标均具有显著影响.随着盐浓度的增大, 桑树幼苗的Pn, Gs, Tr, Ls, WUE, CUE和SUE逐渐下降, 而Ci逐渐升高.方差分析结果表明:T0.1的Pn, Gs, Ci, Tr, Ls, WUE, CUE和SUE和对照(CK)没有明显差异.
|
|
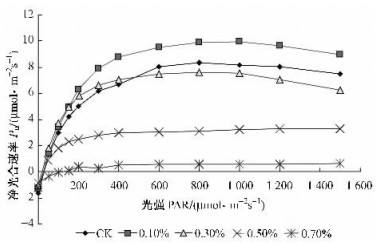
盐胁迫下, 各种盐浓度处理的净光合速率的光响应过程基本相似, 即在较低光强范围内(0~400 μmol·m-2s-1), Pn随PAR增大, 快速上升; 当PAR高于400μmol·m-2s-1, Pn随PAR增大, Pn上升幅度变小, 并逐渐趋于稳定.然而, 在光强达到一定强度时, CK, T0.1和T0.3等3个处理的Pn呈下降趋势, 而T0.5和T0.7处理则没有这种趋势.可能的原因是低盐浓度或正常情况下, 强光会引起光抑制现象, 导致Pn下降; 而高盐浓度下, 桑树伤害程度增大, 而强光作用下, 其光能增加反而能促进光电子的传递, 从而使Pn略为增大.
|
图 1 不同盐浓度处理的桑树Pn光响应曲线 Figure 1 Light response curve of Mulberry under different salt treatments |
在光响应过程中, 随光强增大, 处理之间Pn的差异逐渐显著, 当PAR高于400μmol·m-2s-1, 各个处理的桑树幼苗表现为T0.1>CK>T0.3>T0.5>T0.7, 适当的低盐浓度能促进桑树幼苗的光合作用, 而高盐浓度则抑制其光合作用.
最大净光合速率、表观量子效率、光补偿点和光饱和点是用以研究植物光合能力的重要指标, 反映了光辐射的变化对植物光合作用的影响.由表 2可看出:T0.1的Pmax, AQY和LSP均高于CK, 而LCP则低于CK; 而T0.3, T0.5, T0.7的Pmax, AQY和LSP均低于CK, 且NaCl浓度越高, 其相应的Pmax, AQY和LSP则越低.
|
|
由图 2可看出, 在外界CO2浓度为0~600 μmol·mol-1范围内, 各个处理的Pn均随胞间CO2浓度(Ci)的增大而增大, 但不同处理之间的变化具有明显的差异. T0.3、T0.5和T0.7的桑树幼苗叶片的Pn, 在Ci达到一定时, 都有一个快速上升的趋势.桑树的胞间CO2浓度与外界CO2浓度呈极显著正相关(R2=0.965, F=121.43, P<0.01), 可见, 高CO2浓度在一定程度上能缓解盐害对桑树光合作用所造成的不利影响.
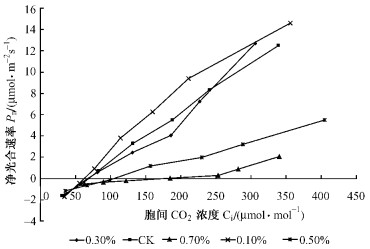
|
图 2 不同处理的桑树CO2响应曲线 Figure 2 CO2 response curve of mullberry under different salt treatments |
盐胁迫对桑树的表观羧化效率(ACE)和补偿点(CCP)的影响分别和AQY及LCP的表现相似(表 2).盐胁迫下, NaCl浓度越大, 其ACE越小, 而CCP越高.此外, 在外界CO2浓度为0~600 μmol·mol-1范围内, 各种处理的光合速率均未达到饱和, 故难以判断其各自的CO2饱和点和一定光强的最大净光合速率.
3 结论与讨论 3.1 盐胁迫对光合生理特性的影响Pn是反映植物对盐胁迫的响应以及植物抗盐能力鉴定的有效生理指标, 直接反映光合作用能力.一般认为, 盐胁迫能显著降低植物的净光合速率(冯立田等, 1999; 郭书奎等, 2001; Gibberd et al., 2002; 刘会超等, 2004).本试验结果表明:低盐(0.1%)能够促进桑树幼苗的光合作用; 当土壤盐分达到一定程度(≥0.3%)时, 盐浓度越高, 桑树净光合速率越低, T0.3, T0.5和T0.7等处理的Pn分别是对照的67.31%, 38.16%和26.09%.低盐浓度条件下, 桑树幼苗叶片的Pn增加可能是植物适应盐胁迫的一种表现.在盐胁迫条件下, 植物为了生存必须将部分应当用于生产、生长和竞争能力的同化物转向用于形成能量, 以提供细胞内离子运输和保持细胞内离子不平衡分布之所需.低盐胁迫下, 桑树幼苗叶片的Pn增加有利于同化物积累, 促进能量转化, 为离子吸收和主动运输提供能量, 从而在一定程度上, 抑制盐离子进入细胞内, 缓解盐离子对细胞的毒害, 维持细胞内离子稳态.随着盐胁迫程度增加, 大量盐离子进入细胞, 从而抑制桑树的光合作用, 其可能的原因是, 盐胁迫下过多的Na+进入类囊体膜中抑制光系统Ⅰ和光系统Ⅱ的活性(Allakaberdiev et al., 2000), 光合还原能力(NADH)的利用速率降低(Ott et al., 1999), 光系统活力下降(Neumann, 1997; Ott et al., 1999), 另外, 膜脂中不饱和脂肪酸发生过氧化作用(刘宛等, 1995), 导致叶绿体膜及质膜透性的增大(Wang et al., 1999), 引起酶的失活及蛋白质的降解, 从而抑制光合作用.
一般认为盐胁迫导致光合速率降低的因素包括气孔限制和非气孔限制, 但具体是气孔限制还是非气孔限制还难以明确(许大全, 1999).有的研究结果以气孔限制为主(Goldstein et al., 1996; Ouerghi, 2000), 有的以非气孔限制为主(江行玉, 2001), 有的则二者均起作用.本研究结果表明:CK, T0.1, T0.3和T0.5的Ci随NaCl处理浓度增加呈上升趋势, 但其之间没有明显差异, 而其Gs随NaCl处理浓度增加则下降趋势明显; 而当NaCl处理浓度为0.7%时, 其Ci明显增高, 而其Gs则和T0.5的Gs没有显著差异(表 1).根据Farqugar等(1982)的观点, 气孔因素引起的Pn降低表现为Gs和Ci降低而Ls升高; 而非气孔因素引起的Pn降低则伴随着Ci的提高.可见, NaCl造成桑树幼苗Pn降低是由2者均起作用的结果, 即NaCl≤0.5%时, 桑树幼苗Pn降低主要以气孔限制为主; 而NaCl为0.7%时, Pn降低则主要以非气孔限制为主.
盐胁迫还导致桑树幼苗叶片的蒸腾速率、瞬时水分利用率的下降.蒸腾作用下降是植物的一种自我保护反应.胁迫情况下, 植物会自动关闭叶片的气孔, 降低气孔导度, 增加气孔阻力, 以减少叶片水分蒸发, 保持叶片具有相对较高的水势, 从而减少根系对水分的吸收和盐离子的吸收(张俊莲等, 2003).水分利用率是反映植物对盐胁迫所造成的渗透胁迫的一种适应性的1个生理生态指标.根据Farquhar等(1982)的观点, 气孔在短时期内的行为总是以有限的水分丧失来换取最大的CO2同化量, 即气孔最优化理论.水分利用率高低反映植物对盐胁迫所造成的渗透胁迫的适应性强弱.盐胁迫下, 桑树幼苗叶片的净光合速率下降幅度大于蒸腾速率, 水分利用效率表现为随盐分胁迫程度的加深不断下降, 表明了桑树幼苗对盐胁迫所造成的渗透胁迫的适应性较弱.
试验结果还表明:盐胁迫下, 桑树幼苗的瞬时光能利用效率和瞬时羧化速率随NaCl处理浓度的增大而逐渐降低, 可能原因是盐胁迫下桑树幼苗叶片的净光合速率的快速下降是导致其瞬时光能利用效率和瞬时羧化速率下降的主要因素.
3.2 盐胁迫下桑树Pn的光响应光是进行光合作用的前提条件, 光响应曲线描述的正是光量子通量密度与植物净光合速率之间的关系.在0~1 500 μmol·m-2s-1范围内, 不同处理的桑树幼苗叶片净光合速率随光强的变化具有明显差异. CK, T0.1和T0.3的净光合速率起先随光强增大而增大, 而当光强超过800~1000 μmol·m-2s-1时, 其Pn逐渐下降, 可能的原因是强光导致光呼吸增强或发生光抑制现象. T0.5和T0.7桑树则表现出随光强的增大而增大的趋势, 可能的原因是盐害程度较大时植物光合机构受到破坏, 而强光作用可能促进光电子的传递, 提高光能转化效率.
试验结果表明:盐胁迫对桑树幼苗的表观量子效率、最大净光合速率、光补偿点和光饱和点具有明显影响.低盐浓度(NaCl为0.1%)时, 桑树幼苗的表观量子效率、最大净光合速率和光饱和点增大而光补偿点降低; 当NaCl≥0.3%时, 随着处理浓度的提高, 桑树幼苗的表观量子效率、最大净光合速率和光饱和点逐渐降低而光补偿点则逐渐升高.表观量子效率的降低可能与光合机构结构和功能的破坏程度息息相关. NaCl胁迫下, 光合还原力(NADPH)的利用速率降低, 光合电子传递速率超过消耗能力, 结果驱动Mehler反应, 产生活性氧(Ott et al., 1999), 活性氧通过使酶失活和膜受到伤害而抑制光合电子传递(Logan et al., 1999); 此外, 盐胁迫下, 过多的Na+进入类囊体膜中抑制光系统Ⅰ和光系统Ⅱ的活性(Allakaberdiev et al., 2000), 从而导致光合机构的结构和功能遭到破坏, 减小植物表观量子效率, 进而导致最大净光合速率和光饱和点逐渐降低, 而光补偿点则逐渐升高.
试验结果还表明:当NaCl浓度≤0.3%时, 弱光条件下, 适当增加光强有利于促进桑树幼苗的光合作用, 而当NaCl浓度≥0.5%时, 增加光强对桑树幼苗的净光合速率则没有明显影响.
3.3 盐胁迫下桑树Pn的CO2响应盐胁迫下, 外界CO2浓度的增加也能显著提高桑树幼苗的净光合速率, 且0~600 μmol·mol-1范围内, 随着外界CO2浓度升高, 各个处理的Pn呈线性递增.植物光合速率的增加主要有2个方面的原因, 即叶绿体内的CO2分压增加, 从而增加了CO2对Rubisco结合位点的竞争导致羧化效率的提高, 即所谓的底物浓度效应; 抑制植物的光呼吸(林伟宏, 1998).多项研究表明:高CO2浓度下, 植物的净光合速率并不总是上升, 有时可能出现不变, 或者甚至降低, 但其具体机制并不明确(Sage et al., 1989; Richard, 1994).
本研究结果还表明:高CO2浓度在一定程度上能够缓解盐害对桑树光合作用所造成的不利影响, 增强桑树的抗盐性. 张其德(2004)认为高浓度CO2有助于抑制盐胁迫导致光合色素含量的降低, 增强光能的捕获能力; 提高光合电子传递速率, 有利于形成更多的ATP和NADH, 从而保证光合作用对能量的需求.此外, CO2浓度升高, 植物体内的类胡萝卜素含量提高, 能更好地保护叶绿素不受破坏, 使植物的光合作用能在逆境中顺利进行(陈平平, 2002).
综上所述, 盐胁迫对桑树幼苗光合生理生态特性具有明显影响, 低盐浓度下, 桑树幼苗叶片净光合速率的增加, 而当盐浓度达到一定时, 桑树幼苗叶片净光合速率则明显下降.盐胁迫导致桑树幼苗叶片净光合速率下降的因素则随着NaCl处理浓度的增高表现出由气孔限制为主逐步向非气孔限制为主转变, 但其调控机理还不清楚, 有待进一步研究.桑树幼苗净光合速率的光响应和CO2响应的结果表明, 在一定的范围内, 适当增加光照或使用CO2肥料可缓解盐胁迫对桑树光合作用的不利影响, 增强桑树的耐盐能力.
蔡文祥. 1996. 开发桑枝造纸的前景. 纸和造纸, (6): 44. |
陈平平. 2002. 大气二氧化碳浓度升高对植物的影响. 生物学通报, 37(3): 20-22. |
何雪梅, 廖森泰, 刘吉平. 2005. 桑树资源综合利用进展及开发对策. 蚕业科学, 31(1): 4-7. DOI:10.3969/j.issn.0257-4799.2005.01.002 |
胡卫民. 2002. 果桑水土保持林的栽培技术. 林业科技开发, 16(4): 52-53. DOI:10.3969/j.issn.1000-8101.2002.04.023 |
冯立田, 赵可夫, 邓振旭. 1999. NaCl对菜豆叶片光合CO2和水分交换效应的研究. 山东师范大学学报, 14(2): 180-183. |
郭书奎, 赵可夫. 2001. NaCl胁迫抑制玉米光合作用的可能机理. 植物生理学报, 27(6): 461-466. DOI:10.3321/j.issn:1671-3877.2001.06.004 |
江行玉, 窦君霞, 王正秋. 2001. NaCl对玉米和棉花光合作用和渗透调节能力的调控. 植物生理学通讯, 37(4): 303-305. |
林伟宏. 1998. 植物光合作用对大气CO2浓度升高的反应. 生态学报, 18(5): 529-538. DOI:10.3321/j.issn:1000-0933.1998.05.013 |
林栖凤, 李冠一. 2000. 植物耐盐性研究进展. 生物工程进展, 20(2): 20-25. DOI:10.3969/j.issn.1671-8135.2000.02.005 |
刘会超, 孙振元, 彭镇华. 2004. NaCl胁迫对五叶地锦生长及某些生理特性的影响. 林业科学, 40(6): 63-67. DOI:10.3321/j.issn:1001-7488.2004.06.011 |
刘宛, 胡文玉, 谢甫缔, 等. 1995. NaCl胁迫对离体小麦叶片膜过氧化脂类物质的影响. 植物生理学通讯, 31(1): 26-29. |
宋宝林, 石慧芹, 张来生, 等. 2002. 防风固沙野生资源——蒙桑. 内蒙古农业科技, (4): 22. |
宋沁, 叶志毅. 2003. 桑叶的综合利用和开发. 蚕桑通报, 34(3): 1-4. DOI:10.3969/j.issn.0258-4069.2003.03.001 |
王继和, 杨自辉, 胡明贵, 等. 2001. 干旱区腌渍化土地综合治理技术研究. 中国生态农业学报, (9): 64-66. |
许大全. 1999.叶片表观光合量子效率的测定//中国科学院上海植物生理研究所, 上海市植物生理学会.现代植物生理学实验指南.北京: 科学出版社, 89-90.
|
张俊莲, 陈勇胜, 武季玲, 等. 2003. 向日葵对盐逆境伤害的生理反应及耐盐性研究. 中国油料作物学报, 25(1): 45-49. DOI:10.3321/j.issn:1007-9084.2003.01.012 |
张其德. 2004.盐胁迫对植物及其光合作用的影响.盐碱地绿化技术.北京: 中国林业出版社, 137-143.
|
周玉梅, 韩士杰, 张安辉, 等. 2002. 不同CO2浓度下长白山3种树木幼苗的光合特性. 应用生态学报, 13(1): 41-44. DOI:10.3321/j.issn:1001-9332.2002.01.009 |
Larcher W. 1997.植物生态生理学.翟志席, 译.北京: 中国农业大学出版社.305.
|
Allakaberdiev S I, Sakamoto A, Nishiyama Y. 2000. Ionic and osmotic effects of NaCl induced inactivation of photo-systems Ⅰ and Ⅱ in Synechococcus spp.. Plant Physiol, 123: 1047-1056. DOI:10.1104/pp.123.3.1047 |
Farquhar D G, Sharkey T D. 1982. Stomatal conductance and photosynthesis. Ann Rev Plant Physiol, 33: 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
Gibberd M R, Turner N C, Storey R. 2002. Influence of saline irrigation on growth, ion accumulation and partitioning, and leaf gas exchange of carrot (Daucus carota L.). Ann Bot, 90: 715-724. DOI:10.1093/aob/mcf253 |
Goldstein G, Drake D R, Alpha C, et al. 1996. Growth and photosynthetic responses of Scaevola sericea, a Hawaiian coastal shrub, to substrate salinity and salt spray. J Plant Sci, 157: 171-179. DOI:10.1086/297336 |
Logan B A, Demmig-Adams B, Rosenstiel T N, et al. 1999. Effect of nitrogen limitation on foliar antioxidants in relationship to other metabolic characteristics. Planta, 209: 213-220. DOI:10.1007/s004250050625 |
Neumann P M. 1997. Salinity resistance and plant growth revisited plant. Cell and Neumann Environ, 20: 1193-1198. DOI:10.1046/j.1365-3040.1997.d01-139.x |
Ott J C, Birks K, Johnson G. 1999. Regulation of the photosynthetic electron transport chain. Planta, 209: 250-258. DOI:10.1007/s004250050629 |
Ouerghi Z, Cornic G, Rrodan I M. 2000. Effect of NaCl on photosynthesis of two wheat species (Triticum durum and T. aestivum) differing in their sensitivity to salt stress. J Plant Physiol, 156: 335-340. DOI:10.1016/S0176-1617(00)80071-1 |
Richard J N. 1994. Issues and perspectives for investigating root response to elevated carbon dioxide. Plant and Soil, 165: 9-20. DOI:10.1007/BF00009958 |
Sage R F, Sharkey T D, Seeman J R. 1989. Acclimation of photosynthesis to elevated CO2 in five C3 species. Plant Physiol, 89: 590-596. DOI:10.1104/pp.89.2.590 |
Wang Y, Meny Y L, Ishikawa H, et al. 1999. Photosynthetic adaption to salt stress in three color leaves of a C4 plant Amaranthus tricolor. Plant Cell Physiol, 40: 668-674. DOI:10.1093/oxfordjournals.pcp.a029591 |
 2009, Vol. 45
2009, Vol. 45