文章信息
- 冯立娟, 苑兆和, 尹燕雷, 招雪晴, 许鑫科, 徐榕, 李自峰.
- Feng Lijuan, Yuan Zhaohe, Yin Yanlei, Zhao Xueqing, Xu Xinke, Xu Rong, Li Zifeng
- 槭属2品种叶变色期花青苷含量与相关酶活性的变化
- Anthocyanin Content and the Relevant Enzymes Activities during Leaf Color Changing of Two Acer Species
- 林业科学, 2009, 45(8): 56-60.
- Scientia Silvae Sinicae, 2009, 45(8): 56-60.
-
文章历史
- 收稿日期:2008-07-16
-
作者相关文章
2. 山东农业大学林学院 泰安 271018;
3. 山东林业科技培训中心 济南 250013
2. College of Forestry, Shandong Agricultural University Tai'an 271018;
3. Shandong ForestryScience andTechnology Training Center Jinan 250013
植物叶色的表达是花青苷合成和叶绿素降解2个过程的综合结果(王慧聪等, 2002). 目前花青苷生物合成的途径已经基本清楚, 苯丙氨酸解氨酶(PAL)、查尔酮异构酶(CHI)、二氢黄酮醇还原酶(DFR)和类黄酮糖基转移酶(UFGT)与花青苷的合成密切相关(Murray et al., 1991; Lister et al., 1996; Tsukasa et al., 2000; Hiroyoshi et al., 2007; Chung et al., 2008). 不同酶在花青苷合成过程中的作用研究结果不尽一致. Boss等(1996)认为PAL所催化的反应不仅为花青苷合成提供前体, 也为其他物质的合成提供前体, 只有在个别情况下, PAL才是花青苷合成的关键酶. Rosati等(1997)通过PCR技术证明, DFR基因不是花青苷合成的关键调控位点. Kobayashi等(2001)和Ashraf等(2002)用分子方法在葡萄上的研究证明UFGT是花青苷合成的关键酶. 目前, 关于花青苷合成的研究多集中在果实着色过程, 在苹果(Malus pumila)(Ju et al., 1999)、葡萄(Vitis)(Boss et al., 1996; Kobayashi et al., 2001; Ashraf et al., 2002)、荔枝(Litchi chinensis)(王惠聪等, 2004), 在马铃薯(Solanum tuberosum)(Daniel et al., 2006; Gisela et al., 2006)、洋葱(Allium cepa)(Kim et al., 2004; 2005; 2006)、莴苣(Lactuca)(Jong et al., 2007)等植物上已有报道, 而叶片中花青苷含量及其合成相关酶的研究报道较少.
槭树科分金钱槭属(Dipteronia)和槭属(Acer), 而槭属则常泛称为槭树(徐自坤等, 2008). 槭属为落叶大乔木, 其适应范围广, 抗逆性强, 秋季叶片为绚丽的红、黄、紫等色, 是世界各国园林绿化中应用最为广泛的彩叶树种之一. 有关槭属秋季变色期叶片中花青苷的合成与相关酶关系的研究尚未见报道. 本研究以自由人槭'秋天火焰'(Acer× freemanii'Autumn Blaze')和红花槭‘白兰地’ (Acer rubrum 'Brandywine')为试材, 其中‘秋天火焰’秋季叶片变为橙红色, 白兰地为紫红色, 研究其变色期叶片中花青苷合成与相关酶的关系, 探寻控制槭属叶片中花青苷合成的关键酶, 为槭属植物的叶色调控提供理论依据.
1 材料与方法 1.1 试验材料试验于2007年10月12日—11月19日, 在山东省果树研究所进行, 试材为‘秋天火焰’和‘白兰地’, 选取生长健壮, 长势一致的5年生树10株, 该试材2005年3月由美国俄勒冈州引进, 定植于山东省果树研究所苗圃.
1.2 试验方法10月12日2个品种叶片开始变色时取样, 每隔4天采1次样, 直至叶片完全变色落叶时为止. 每次每品种取相同部位的叶片50个(5个·plant-1), 测定2个品种变色期叶片的花青苷含量, PAL, CHI, DFR和UFGT酶活性, 每个测定指标重复3次. 集中于9: 00左右采样, 采后立即用冰壶带回实验室.
1.2.1 叶片中花青苷含量测定花青苷的测定参考仝月澳等(1982)的方法, 将叶片取回, 洗净, 擦干, 剪碎后, 采用1.5 mol·L-1 HCl:95%乙醇=15:85(V/V)混合液, 在黑暗条件下浸提24 h, 后用岛津UV-2450型紫外可见分光光度计检测535 nm波长的光密度值, 参照胡位荣等(2004)的计算方法进行花青苷含量的计算.
1.2.2 叶片中PAL, CHI酶活性的测定取0.5 g剪碎的叶片加入5 mL提取液[0.05mol·L-1Na2HPO4/KH2PO4(pH7.0), 0.05 mol·L-1抗坏血酸, 0.018 mol·L-1巯基乙醇], 冰浴匀浆, 4 ℃下15 000 g离心20 min, 上清液为酶粗提液, 用于测定PAL, CHI酶活性. PAL和CHI活性测定参照Lister等(1996)的方法.
1.2.3 叶片中DFR、UFGT酶活性的测定酶液的提取参照Murray等(1991)的方法. 取样品1 g加液氮研磨后, 加入5 mL -20 ℃的丙酮混匀离心, 弃去上清液, 用4 mL -20 ℃丙酮再提取1次, 沉淀用4 mL [0.1 mol·L-1硼酸缓冲液(pH 8.8), 5 mmol·L-1抗坏血酸]溶液提取, 上清液为DFR和UFGT酶的粗提液. DFR活性测定参照Stafford等(1984)的方法. UFGT活性测定参照Lister等(1996)的方法.
1.2.4 统计方法利用SPSS V 13.0软件进行统计分析, 并将不同时期测定的酶活性平均值进行相关分析并建立回归模型.
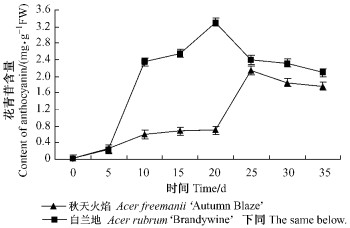
2 结果与分析 2.1 变色期叶片中花青苷含量的变化2个槭属品种叶片中花青苷含量随着时间延续呈单峰曲线(图 1). 变色初期, ‘白兰地’叶片中花青苷含量较低, 第5天开始, 随着天数的增加, 花青苷含量迅速升高, 叶色变红, 20天时出现峰值, 后逐渐下降. ‘秋天火焰’叶片中花青苷含量在20天前升高幅度较小, 20天以后花青苷大量合成, 在25天达到高峰. 可见, ‘白兰地’叶片中花青苷合成初期为0~5天, 大量合成期为5~20天, 20~35天为降解期. ‘秋天火焰’叶片中0~20天为花青苷合成初期, 20~25天为大量合成期, 25~35天为花青苷降解期.
|
图 1 2个槭属品种变色期叶片中花青苷含量的变化 Figure 1 Changes of anthocyanin content in the leaves of two Acer cultivars during leaf transition |
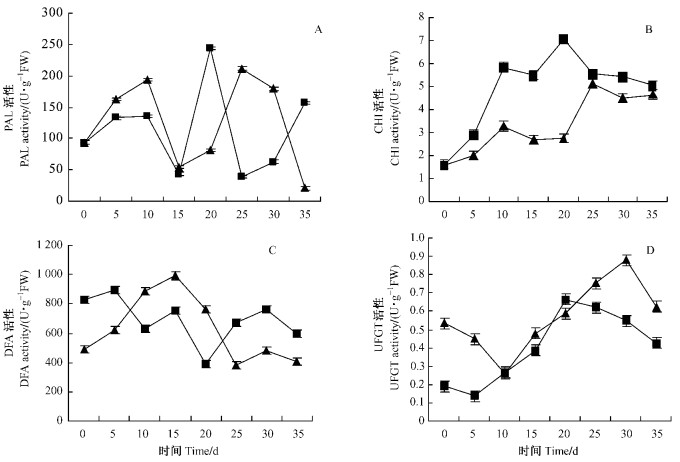
在秋季叶片变色期, 2个槭属品种叶片中4种花青苷合成相关酶PAL, CHI, DFR和UFGT的活性变化差异明显(P < 0.05)(图 2). ‘秋天火焰’叶片中PAL活性随天数的增加呈现双峰曲线, 分别在第10和25天出现峰值, 25天后逐渐下降; 在花青苷合成初期(0~20天), PAL酶活性为升—降—升的变化趋势, 大量合成期(20~25天), 酶活性不断升高. ‘白兰地’叶片中PAL活性随天数的增加, 呈现3峰曲线, 分别在第10, 20和35天出现峰值; 在花青苷合成初期(0~5天), PAL酶活性不断升高, 大量合成期(5~20天)和降解期(20~35天), 酶活性均呈现先降后升的变化趋势.
|
图 2 2个槭属品种变色期叶片中PAL, CHI, DFR和UFGT酶活性 Figure 2 Changes of activity of PAL, CHI, DFR and UFGT in the leaves of two Acer cultivars during leaf transition |
2个槭属品种CHI酶活性随着时间延续呈双峰曲线(图 2B). ‘秋天火焰’叶片中CHI活性分别在第10和25天时出现峰值后降低, ‘白兰地’叶片中CHI活性分别在第10和20天出现峰值后降低, 在花青苷大量合成期, 2个槭属品种CHI酶活性均不断升高.
2个槭属品种DFR酶活性随着天数的增加变化不相同(图 2C). ‘秋天火焰’叶片中DFR活性随着天数的增加和叶色的加深呈双峰曲线, 分别在第15和30天出现峰值, 在花青苷大量合成期, DFR酶活性逐渐降低. ‘白兰地’叶片中DFR活性变化为3峰曲线, 分别在第5, 15和30天时出现峰值, 花青苷大量合成期, 在第10~15天时酶活性升高, 其余时间呈下降趋势.
2个槭属品种UFGT活性随着时间延续和叶色的加深, 呈现不同的变化趋势(图 2D). 变色初期, ‘秋天火焰’叶片中UFGT活性较高, 后逐渐下降, 10天以后, UFGT酶活性不断升高, 在第30天出现峰值, 在花青苷大量合成期, UFGT酶活性不断升高. ‘白兰地’叶片中UFGT活性第5天开始升高, 20天时出现峰值, 与花青苷大量合成期一致.
2.3 叶片中花青苷合成相关酶与花青苷含量的相关性分析‘秋天火焰’和‘白兰地’叶片中花青苷合成相关酶的活性与花青苷的积累存在不同的相关关系(表 1). ‘秋天火焰’叶片中PAL活性与花青苷含量呈显著的2次曲线关系, 当PAL活性大于110 U·g-1FW时, 随着酶活性的升高花青苷含量增加. CHI酶的活性与花青苷的含量呈极显著的线性关系, 花青苷的含量随着CHI酶活性的升高而增加. DFR酶的活性与花青苷含量也呈显著的2次曲线关系, 当DFR酶活性大于760 U·g-1FW左右时, 花青苷的含量随DFR酶的活性的升高而增加. ‘秋天火焰’叶片中UFGT酶的活性与花青苷的含量为显著的2次曲线关系, 当UFGT活性大于0.231 U·g-1FW左右时, 随着酶活性的升高花青苷含量增加.
|
|
‘白兰地’叶片中CHI酶活性与花青苷含量成极显著的线性关系, PAL, DFR和UFGT酶活性与花青苷含量均成2次曲线关系, 与‘秋天火焰’相似. PAL酶活性与花青苷含量的2次曲线关系不显著, 当PAL活性大于140 U·g-1FW时, 随着酶活性的升高花青苷的含量增加. 当DFR活性在389~423 U·g-1FW时, 花青苷含量随酶活性增加而增加. 当UFGT活性在0.138~0.652 U·g-1FW范围时, 随着酶活性的升高花青苷含量增加.
3 讨论 3.1 2个槭属品种花青苷的合成20天以前, ‘秋天火焰’叶片中花青苷少量合成, 升高幅度较小; 20天以后, 花青苷进入大量合成期, 叶色变为橙红色; 25天时出现峰值, 花青苷含量由0.703 mg·g-1FW上升至2.141 mg·g-1FW, 后花青苷降解, 含量高于合成初期. ‘白兰地’叶片中花青苷在5天以后进入大量合成期, 20天时出现峰值, 后含量下降, 仍高于合成初期. 可见, ‘白兰地’叶片中花青苷进入大量合成期较早, 这可能与其叶片迅速变红有关; 合成后期花青苷降解可能是其发育必需的、自发的生理过程.
3.2 花青苷合成与PAL, CHI, DFR, UFGT的关系在花青苷的生物合成过程中, PAL是催化合成反应的第1个酶, 催化苯丙氨酸形成肉桂酸. PAL酶活性与花青苷积累的关系一直存在争议. Tsukasa等(2000)在草莓上的试验结果认为, 当光照强度为88.8 μmol·m-2s-1时, PAL酶活性与草莓细胞中花青苷含量均达到最高, 2者密切相关. Lister等(1996)指出只有苹果果皮变红时PAL活性才与花青苷的合成密切相关. 本研究中, ‘秋天火焰’花青苷大量合成期, PAL酶活性不断升高, PAL酶与‘秋天火焰’花青苷含量显著相关, 是其花青苷合成中的关键酶. ‘白兰地花’青苷大量合成期, PAL酶活性先降后升, 与花青苷含量为2次曲线关系, 相关性不显著, 可见, PAL不是‘白兰地’花青苷合成中的关键酶, 后期活性较高可能是因为花青苷的大量合成消耗肉桂酸(王庆菊等, 2008).
CHI酶在黄酮类化合物的转化中起重要作用, 降低或抑制CHI表达活性会直接导致上游产物的积累和下游反应底物的缺乏, 从而引起颜色变化; CHI广泛参与类黄酮代谢过程, 在植物器官颜色的形成中起作用(吴冰等, 2008). Kim等(2004)指出CHI在洋葱中的失活导致黄酮含量急剧下降和查尔酮含量增加, 使其出现黄色球根. 本研究与Kim等(2004)的研究结果类似, ‘秋天火焰’和‘白兰地’叶色变化过程中, CHI酶活性的变化与花青苷的积累均为极显著的线性关系(表 1), 随酶活性的升高花青苷含量增加.
DFR是催化栎精苷和花白素之间反应的酶, 王惠聪等(2004)在荔枝的研究中发现DFR与荔枝果皮中花青苷的积累无密切关系, Kim等(2004; 2005)指出在洋葱中, DFR活性的缺乏是花青苷积累的限制性因素. 本研究中‘秋天火焰’叶片花青苷合成初期, DFR酶活性不断升高, 但花青苷大量合成期DFR酶活性下降. ‘白兰地’叶片中花青苷大量合成期, 10~15天时DFR酶活性不断升高; 花青苷降解期, 20~30天时DFR酶活性却不断升高. DFR酶可能与2个槭属品种花青苷的合成有关, 对花青苷合成起何种作用还有待于进一步研究.
UFGT是花青苷合成过程中的最后1个酶, 在它的催化下, 不稳定的花青苷转变为稳定的花青苷. UFGT活性与葡萄红色果皮中花青苷的合成密切相关(Kobayashi et al., 2001), 但Ju等(1999)在苹果上的研究发现, 在苹果果实膨大期没有花青苷的积累时, UFGT活性仍然很高, 且此时施用乙烯利可提高UFGT活性但没有花青苷的积累, 这也说明UFGT不是花青苷合成的关键酶. 本研究中, ‘秋天火焰’和‘白兰地’花青苷大量合成期, UFGT酶活性不断升高, UFGT和花青苷含量显著相关, UFGT对2个槭属品种花青苷合成起促进作用.
综上所述, PAL, CHI, UFGT是‘秋天火焰’花青苷合成的关键酶, CHI, UFGT是‘白兰地’花青苷合成的关键酶. PAL, CHI, DFR和UFGT调控不同槭属品种花青苷合成的机理不同, 还有待于进一步研究.
胡位荣, 张昭其, 季作梁, 等. 2004. 酸处理对采后荔枝果皮色泽与生理活性的影响. 食品科学, 25(7): 176-180. DOI:10.3321/j.issn:1002-6630.2004.07.042 |
仝月澳, 周厚基. 1982. 果树营养诊断法. 北京: 农业出版社, 112-115.
|
吴冰. 2008.彩叶草的查尔酮异构酶基因的遗传转化及其功能验证.西南大学硕士学位论文, 23-30. http://cdmd.cnki.com.cn/article/cdmd-10635-2008094245.htm
|
王惠聪, 黄旭明, 黄辉白, 等. 2002. '妃子笑'荔枝果实着色不良原因的研究. 园艺学报, 29(5): 408-412. DOI:10.3321/j.issn:0513-353X.2002.05.002 |
王惠聪, 黄旭明, 胡桂兵, 等. 2004. 荔枝果皮花青苷合成与相关酶的关系研究. 中国农业科学, 37(12): 2028-2032. DOI:10.3321/j.issn:0578-1752.2004.12.043 |
王庆菊, 李晓磊, 王磊, 等. 2008. 紫叶稠李叶片花色苷及其合成相关酶动态. 林业科学, 44(3): 45-49. DOI:10.3321/j.issn:1001-7488.2008.03.011 |
徐自坤, 教忠意, 刘国富, 等. 2008. 武夷山保护区野生槭属植物资源调查. 江苏林业科技, 35(1): 28-31. DOI:10.3969/j.issn.1001-7380.2008.01.008 |
Ashraf E I K, Christian C, Jean M S, et al. 2002. Ethanol triggers grape gene expression leading to anthocyanin accumulation during berry ripening. Plant Science, 163: 449-454. DOI:10.1016/S0168-9452(02)00142-5 |
Boss P K, Davies C, Robinson S P. 1996. Expression of anthocyanin biosynthesis pathway genes in red and white grapes. Plant Molecular Biology, 32(3): 565-569. DOI:10.1007/BF00019111 |
Chung Y C, Kai W Y. 2008. Differential expression of MYB gene (OgMYB1) determines color patterning in floral tissue of Oncidium Gower Ramsey. Plant Mol Biol, 66: 379-388. DOI:10.1007/s11103-007-9275-3 |
Daniel L, Keifenheim, Alan G, et al. 2006. Cloning and accumulation of anthocyanin biosynthesis genes in developing tubers. American Journal of Potato Research, 83(3): 233-239. DOI:10.1007/BF02872159 |
Gisela J, Wilhelm F. 2006. Coloured potatoes (Solanum tuberosum L.)-anthocyanin content and tuber quality. Genetic Resources and Crop Evolution, 53: 1321-1331. DOI:10.1007/s10722-005-3880-2 |
Hiroyoshi K, Nobuaki N, Simona A L. 2007. Anthocyaninless1 gene of Arabidopsis thaliana encodes a UDP-glucose: flavonoid-3-O-glucosyltransferase. J Plant Res, 120: 445-449. DOI:10.1007/s10265-006-0067-7 |
Jong S P, Myoung G C, Jung B K, et al. 2007. Genes up-regulatedduring red colorationin UV-Birradiated lettuce leaves. Plant Cell Rep, 26: 507-516. DOI:10.1007/s00299-006-0255-x |
Ju Z G, Liu C L, Yuan Y B, et al. 1999. Coloration potential, anthocyanin accumulation, and enzyme activity in fruit of commercial apple cultivars and their F1 progeny. Scientia Horticulture, 79: 39-50. DOI:10.1016/S0304-4238(98)00180-0 |
Kim S, Bang H, Yoo K S, et al. 2006. Identification of the fourth allele of the ANS (anthocyanidin synthase) gene and its effect onredcolor intensity in onions (Allium cepa). Euphytica, 149: 45-51. DOI:10.1007/s10681-005-9053-8 |
Kim S, Binzel M L, Park S, et al. 2004. Inactivation of DFR (Dihydroflavonol 4-reductase) gene transcription results in blockage of anthocyanin production in yellow onions (Allium cepa). Molecular Breeding, 14(3): 253-263. DOI:10.1023/B:MOLB.0000047770.92977.04 |
Kim S, Jones R, Yoo K S, et al. 2004. Gold color in onions (Allium cepa): a natural mutation of the chalcone isomerase gene resulting in a premature stop codon. Mol Gen Genomics, 272: 411-419. DOI:10.1007/s00438-004-1076-7 |
Kim S, Yoo K S, Pike L M. 2005. Development of a PCR-based marker utilizing a deletion mutation in the dihydroflavonol 4-reductase (DFR) gene responsible for the lack of anthocyanin production in yellow onions (Allium cepa). Theor Appl Genet, 110: 588-595. DOI:10.1007/s00122-004-1882-7 |
Kobayashi S, Ishimaru M, Ding C K, et al. 2001. Comparison of UDP-gucose : falvonoid-3-O-glycosytransferase (UFGT) gene suquences between grapes (Vitis vinifera) and their sports with red skin. Plant Science, 160: 543-550. DOI:10.1016/S0168-9452(00)00425-8 |
Lister C E, Lancaster J E. 1996. Phenylalanine ammonialyase (PAL) activity and its relationship to anthocyanin and flavoniod levels in New Zealand-grown apple cultivars. Journal of the American Society for Horticulture Science, 12(2): 281-285. |
Murray J R, Hackett W P. 1991. Dihydroflavonol reductase activity in relation to differential anthocyanin accumulation in juvenile and mature phase Hedera helix L.. Plant Physiology, 97: 343-351. DOI:10.1104/pp.97.1.343 |
Rosati C, Cadic A, Duron M, et al. 1997. Molecular cloning and expression analysis of diydroflavonol 4-reductase gene in flower organs of Forsythia × intermedia. Plant Molecular Biology, 35(3): 303-311. DOI:10.1023/A:1005881032409 |
Springob K, Nakajima J, Yamazaki M, et al. 2003. Recent advances in the biosynthesis and accumulation of anthocyanins. Nat Prod Rep, 20: 288-303. DOI:10.1039/b109542k |
Stafford H A, Lester H H. 1984. Flavan-3-olbiosynthesisl: The conversion of (+)-dihydroquercetin and flavan-3, 4-cis-diol (leuocyanidin) to(+)-catechin by reductases extracted from cell suspension cultures of Douglas fir. Plant Physiology, 76: 184-186. DOI:10.1104/pp.76.1.184 |
Tsukasa M, Miei S, Masaaki S. 2000. Changes in PAL, CHS, DAHP synthase (DS-Co and Ds-Mn) activity during anthocyanin synthesis in suspension culture of Fragaria ananassa. Plant cell, Tissue and Organ Culture, 62: 135-139. DOI:10.1023/A:1026560223795 |
 2009, Vol. 45
2009, Vol. 45


