文章信息
- 荣丽, 李贤伟, 张健, 范川.
- Rong Li, Li Xianwei, Zhang Jian, Fan Chuan
- 4种退耕模式细根(草根)分解及N动态
- Fine Root and Grass Root Decomposition and N Dynamics in Four Land Use Types of Converting Farmland to Forest
- 林业科学, 2009, 45(8): 21-26.
- Scientia Silvae Sinicae, 2009, 45(8): 21-26.
-
文章历史
- 收稿日期:2008-06-05
-
作者相关文章
细根是森林生态系统主要的结构和功能部分, 细根死亡为地下生态系统输入大量的有机质和养分(Cairns et al., 1997), 但与地上部分凋落物分解相比, 对根系分解的研究还较少. 为更好地了解森林生态系统养分循环, 土壤有机质动态以及C贮量, 有必要对细根分解进行更多的研究. 以往的研究主要集中于对根系生长、生产、分布、养分释放, 对影响细根分解因素的研究并不多, 而这些因素却是了解细根分解的重要途径. 影响细根分解的因素包括生物因素(如细根本身质量、土壤微生物)和非生物因素(土壤温度、土壤水分、土壤养分有效性、土壤质地). 在气候条件一致的条件下, 影响细根分解的因素主要是细根的化学成分(细根质量)(Bloomfield et al., 1993; Antonietta et al., 2005). N, P, 木质素含量、C/N、木质素/N、木质素/P是常见的衡量细根质量的指标(Ostertag et al., 1999; Silver et al., 2001), 其中木质素/N被认为是预测根系分解最好的指标(Berg et al., 1984; McClaugherty et al., 1984; Hobbie et al., 2000; Chen et al., 2002), 确定影响细根分解的主要指标对于了解细根分解过程具有重要意义.
四川盆地低山丘陵区退耕还林建立了大量退耕模式, 主要有林草、经济林草、竹草、果草等模式, 已有学者对其中林草复合模式的细根和草根生物量及分布、分解及养分释放(范冰等, 2005; 2007; 王巧等, 2007)、水稳团聚体变化与细根生物量的关系等开展了研究(董慧霞等, 2007), 但还缺乏对细根分解系统的研究. 不同的退耕模式会影响细根的分解及其N含量的变化, 因此, 通过对不同退耕模式细根分解的比较研究可以深入了解森林生态系统在恢复过程中, 细根分解及其N元素变化对林地的影响. 本研究以4种退耕还林模式为研究对象, 研究不同退耕模式细根(草根)分解速率, 影响细根(草根)分解的质量指标, 细根(草根)分解过程中N含量变化.
1 研究区概况研究区位于四川省重点退耕还林示范区洪雅县柳江镇苦竹岗, 该区地理坐标为102°49′—103°47′ E, 29°24′—30°01′ N, 属中亚热带湿润山地季风气候, 最高气温为36.8 ℃, 最低气温为3.3 ℃, 年平均气温16.8 ℃, 年日照时数1 080 h, 年降水量1 493.8 mm, 地貌以低山丘陵为主, 土壤类型为酸性紫色土, 土壤层平均厚度50 cm, pH值4.9~5.6. 采样地为坡改梯形成的水平台状旱地, 2000年1月退耕前以种植玉米(Zea mays)、红薯(Dioscorea esculenta)、蔬菜为主. 主要还林植物有光皮桦(Betula luminifera)、柳杉(Cryptomeria fortunei)、撑绿杂交竹(Bambusa pervariabilis × Dendrocalamopsis grandis)及部分经济植物、优质牧草等.
2 研究方法 2.1 原状土芯法土芯数量的确定2007年4月初, 选取光皮桦与扁穗牛鞭草(Hemarthria compressa)复合模式(HN)、光皮桦人工林(H)、扁穗牛鞭草(NC)、柳杉人工林(LS)4种退耕模式, 试验地概况如表 1. 在试验地内进行每木检尺选出6株平均样木, 以样木为中心, 在半径50 cm距离的每个圆周上(由于扁穗牛鞭草分布均匀, 在该模式试验地内任意选取5块半径为50 cm的圆), 用内径5.3 cm不锈钢土钻随机钻取深15 cm土芯(王巧等, 2007)40个, 带回实验室用40目筛网在水中浸泡、漂洗、过筛, 用放大镜、镊子等工具分出直径 < 2 mm细根和草根(不分级), 置于80 ℃烘箱烘干至恒重, 称取各模式每个土芯里细根质量, HN模式的细根质量是光皮桦细根和扁穗牛鞭草草根质量之和, 分析确定分解试验采取的实际土芯数量. 经过称量每土芯质量分别为0.14~0.3 g, 平均值为0.20 g(HN); 0.12~0.2 5 g, 平均值为0.18 g(H); 0.1~0.27 g, 平均值为0.16 g(LS); 0.08~0.2 g, 平均值为0.13 g(NC). 经过统计分析, 当土芯数分别达30(HN, H)、28(LS)、24个(NC)时, 变异系数保持稳定, 因此这些数据就作为各模式细根分解研究每次采样的土芯数量.
|
|
2007年4月15日, 按照确定土芯的数量取样, 除测定各模式细根、草根初始有机C、全N、全P、纤维素和木质素的土芯直接装入塑料袋外, 其他钻取的相同数目的土芯分别装入开口尼龙网袋(孔径0.25 mm, 6或7 cm×20 cm)中后, 放回到原位置, 做好标记, 再覆盖土壤进行原位培养. HN, H, NC, LS模式放回原位的土芯分别为150, 150, 140, 120个. 共计560个. 用面积为1 m2(1 m×1 m)凋落物网收集凋落物, 并除去表层凋落物, 排除凋落物分解对土壤的影响. 分别在30, 90, 180, 270, 365天后在试验林地内回收每个模式土芯样品(HN, H, NC, LS模式分别为30, 30, 28, 24个)带回实验室. 将采回的土芯样品放在40目筛网内, 用放大镜、镊子等工具挑拣出直径 < 2 mm细根和草根(不分级), 然后将细根、草根洗净, 置于80 ℃烘箱烘干至恒重, 称重, 计算各模式细根的分解速率. 把烘干样粉碎, 过1 mm筛, 用于C、全N、全P、纤维素、木质素含量测定.
2.3 测定方法有机C、全N、全P测定分别采用K2Cr2O7外加热法、凯氏定N蒸馏法、钼锑抗比色法(鲍士旦, 2005), 纤维素木质素测定采用范氏(Van Soest)洗涤纤维分析法(杨云贵等, 2004; 李华等, 2007; Van et al., 1968).
2.4 数据处理细根分解速率用Olson指数模型计算: X/Xo=e-kt, 式中Xo为细根的初始质量, X为时间t时细根残留干质量, k为分解常数. 数据分析采用Office Excel2003和Spass11.0统计软件, 细根各质量指标与细根分解速率的关系采用简单线性回归和多元相关逐步回归分析法.
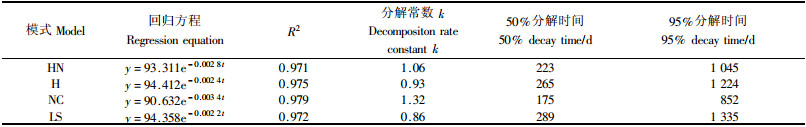
3 结果与分析 3.1 4种模式细根(草根)的分解速率分解的前90天各模式细根(草根)质量损失较大(图 1), 分解最快. HN, H, NC, LS分别损失34.27%, 31.66%, 40.47%, 29.63%, 随后明显减缓, 分解1年后残留率分别为34.51%, 42.49%, 26.68%, 39.45%; NC比其他3个模式细根分解都快, 其次是HN, H, LS分解最慢. 复合模式(HN)细根(草根)分解的速率介于H与NC之间. 各模式细根分解残留率经过指数模型分析其R2>0.97(P < 0.01)(表 2), 同时也证明了采用原状土芯法是可取的. 年分解常数(k)分别为1.06, 0.93, 1.32, 0.86, 质量损失达到95%所需时间分别为1 045, 1 224, 852, 1335天(表 2).
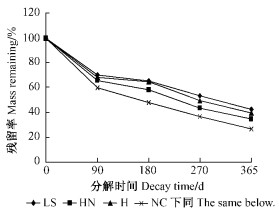
|
图 1 细根(草根)分解过程中干质量残留率的变化 Figure 1 Percentage of mass remaining of fine roots and grass roots during the decomposition |
|
|
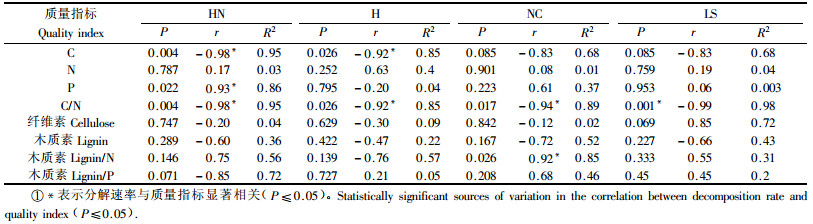
N, P, 木质素含量, C/N, 木质素/N, 木质素/P是常见的细根质量指标(Ostertag et al., 1999; Silver et al., 2001). 由表 3看出: 各模式细根(草根)分解速率都与分解过程中的C/N呈显著负相关关系(P≤0.05), 与N含量相关性不显著, 说明各模式细根C/N越大其分解速率就越小, 主要是因为根系的C/N较大, 微生物合成的细胞受到N素限制, 使合成的微生物量不可能大, 根系分解的速率变慢. 这与Silver整合全球根系分解模型所得当不考虑细根径级和分解研究方法时, 细根C/N与细根分解速率呈显著负相关, 而根系N含量却与分解速率呈弱相关的结果一致(Silver et al., 2001). HN, LS, H, NC分解速率与C含量呈负相关关系, 但LS, NC相关不显著(P≥0.05); 就P含量和木质素/N而言, 与分解速率呈显著正相关的分别是HN和NC(P≤0.05)(表 3).
|
|
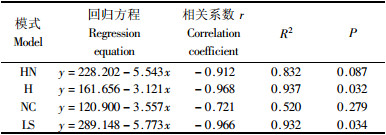
各模式细根(草根)分解90天后进入缓慢阶段(图 1), 早期质量的损失在很大程度上与易分解的C化合物有关, 而后期质量损失与难分解的含C化合物有关(Robinson et al., 1999; 林成芳等, 2008; Chen et al., 1999). 在整个分解过程中, 木质素含量与各模式细根(草根)分解速率相关性不显著(P>0.05)(表 3), 因此有必要对分解90天后各模式的细根(草根)木质素含量变化与分解速率进行相关分析. 结果表明: 除NC外, 2者均存在负相关关系, 其中HN显著性较弱(表 4). 可以认为当细根(草根)分解进入较慢阶段后, 影响退耕模式细根(草根)分解速率的最主要的指标是分解过程中木质素含量, 但扁穗牛鞭草模式除外.
|
|
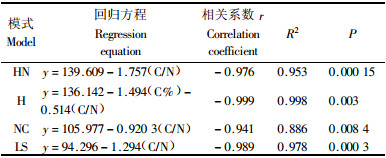
经过简单相关分析表明HN细根(草根)分解速率与C, P含量, C/N呈显著相关, H与C含量和C/N显著相关, NC草根分解速率与C/N、木质素/N显著相关, LS与C/N显著相关(表 3). 各模式细根分解的显著性质量指标进行逐步回归分析. 结果表明: 各模式细根(草根)分解速率与C/N呈极显著负相关, 占分解速率变异的88%以上, 因此整个分解过程中影响各模式细根(草根)分解速率的最主要的质量指标是C/N(表 5).
|
|
细根分解过程中, N的矿化释放是森林生态系统中N循环重要的过程, 对于维持森林生态系统地力具有重要作用(Arunachalam et al., 1996). 分解前90天内, HN, H, NC细根(草根)N含量迅速下降. 此后HN模式N平缓释放, 90天以后H有短时间的积累, 180天后一直释放, 在分解270天后NC草根N出现较少的积累, 随后缓慢释放, LS分解开始后发生N积累, 270天后才发生释放(图 2). 就这4种模式而言, 细根(草根)分解1年后N的释放比积累多, HN, H, NC, LS释放的N分别为初始含量的70.12%, 56.49%, 46.67%, 21.86%, HN释放的最快, LS释放的最慢, 都表现为净释放. 各模式N初始含量分别为0.699 8%(HN), 0.6272%(H), 0.4583%(NC), 0.3702%(LS). 分解1年后N初始含量最高的HN具有最高的N释放率, N初始含量最低的LS具最低的N释放速率, 4种模式N释放速率大小顺序为HN(70.12%)>H(56.49%)>NC(46.67%)>LS(21.86%).
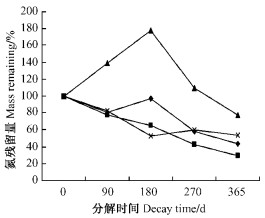
|
图 2 细根(草根)分解过程中氮动态 Figure 2 Nitrogen dynamics in fine roots and grass roots decomposition |
在森林细根分解研究中, 应用埋袋法对细根进行模拟分解研究, 是目前国际上细根分解研究的主要方法. Silver等(2001)对国外温带、热带森林生态系统细根研究的152篇文献整合发现有87%采用此法. 埋袋法模拟细根分解作用, 是模拟和外界环境条件相似的方法, 细根分解作用是土壤微生物、动物和外界环境因子综合作用的结果. 但埋袋法通常会低估分解速率(张小全等, 2001; Vogt et al., 1991), 主要是分解袋孔径大小对根系分解速率的影响(Scheu et al., 1994), 孔径太小会阻碍土壤动物的进入而影响分解, 而孔径太大则会是细根泄漏出去造成误差; 另外取样及样品处理(冲洗细根)破坏了根表面附着的微生物不可避免地影响细根分解速率(张秀娟等, 2005; Dornbush et al., 2002). 针对分解袋法的不足, Dornbush等(2002)提出了接近自然状态的原状土芯法. 尽管原状土芯法也存在树木根系分布的空间异质性、非目的树种干扰等许多不确定的因素, 但其克服了埋袋法的2大严重缺陷: 避免了对细根直径分级的争议; 对根系周围物理环境和微生物环境的干扰减少, 尤其是根际附近的微生物种类和数量的变化很小. 因此本研究为使细根接近自然状态分解, 采用原状土芯法. 由于土芯样品是完整的, 原状土芯法的质量损失是建立在总体平均数基础之上而不是单个样品, 足够的土芯数量才能准确反应细根的质量损失, 因此确定土芯数是本研究方法的重点.
4.2 细根(草根)分解及影响分解速率的质量指标4种退耕模式细根年分解速率大小依次为NC(73.32%)>HN(65.49%)>H(60.55%)>LS(57.51%). 扁穗牛鞭草草根分解速率明显大于其他3种模式细根分解速率, 这与草本植物的根系分解速率一般高于木本植物的报道一致(李培芝等, 2001). 光皮桦细根与扁穗牛鞭草草根混合分解速率大于光皮桦纯林模式细根分解速率, 林草复合模式对细根分解速率表现出一定的促进作用, Robinson等(1999)对几种高寒地区植物根系混合分解研究也表明根系混合对分解有促进作用. 不同类型植物其分解速率不同, 禾本植物>阔叶树种>针叶树种, 而针叶树种根系C/N一般显著高于其他树种(Silver et al., 2001). 本研究中柳杉细根C/N(127.47)大于HN(80.43), H(71.13), NC(63.42), 因此柳杉细根分解速率都小于其他模式. 细根分解都呈现出快-慢不同的2个阶段(图 1), 这与Arunachalam等(1996)采用分解袋法研究印度亚热带湿润地区森林不同更新年龄的林木细根分解分为慢-快-慢3个明显的阶段不一致, 其主要原因可能是采用分解袋法微生物群落重新定居的时间具有滞后性, 而原状土芯法对减少根系周围物理环境和微生物环境的干扰. 早期质量的损失在很大程度上与易分解的C化合物有关, 如细根初始水溶性提取物, 而后期质量损失与难分解的含C化合物有关, 如木质素含量(林成芳等, 2008; Chen et al., 1999; Tsuchiya et al., 2002). 凋落物的分解, 特别是早期的分解与凋落物的N含量呈正相关(Barry et al., 1989), 然而根系分解并不是这样. 各模式细根分解速率都与C/N呈显著负相关关系(P≤0.05), 与N含量无关, 这与其他的一些学者研究结果一致(Silver et al., 2001; Chen et al., 2002). 其他质量指标C%, N%, P%, 纤维素%、木质素/N、木质素%、木质素/P与各模式细根分解速率没有显著相关, 或不相关, 因此预测4种退耕模式细根年分解速率的最好指标就是根系的C/N. Berg及其合作者早在1980年就拟合出基质质量对凋落物分解影响的模型, 发现对根系和针叶凋落物而言, N以及其他养分如P, S的含量控制分解的早期阶段(≤30%质量损失), 而木质素含量在以后的分解过程中起着更为重要作用(Berg et al., 1984; Barry et al., 1989). 对分解90天后各模式的细根木质素含量变化与分解速率进行相关分析表明, 除模式3外, 2者均存在负相关关系(P≤0.05), 其中模式1存在较弱的负相关关系(表 4), 这正好验证了Berg的结论, 与其他的一些学者对根系分解研究结果一致(Hobbie et al., 1996). 因此, 当细根分解进入较慢阶段后, 预测退耕模式细根分解速率的重要指标是木质素含量, 但扁穗牛鞭草模式除外.
4.3 细根(草根)分解过程中N动态一般来说, N含量较低的有机质在分解过程中往往表现出“净固持作用”, N绝对含量增加是微生物固持作用的结果, 在分解过程中出现养分固持现象则被认为是养分限制(Prescott et al., 1995); N含量较高的通常表现为“净矿化作用”(Bosire et al., 2004). LS的N初始含量最低, 为0.370 2%, 分解刚开始N出现明显积累, 180天后达到N初始含量的177.8%, 270天后有较大下降, 分解1年后N才出现释放. 在很长一段时间内, LS的N都表现出积累现象, 说明LS细根N含量不足以满足微生物分解活动对N的利用, 需要从外界环境中吸收N来满足自身的需要, N的释放速率决定于N的供应. HN模式的N初始含量最高(0.699 8%), 微生物可利用的N并不缺乏, 不需要外源N的补给, 细根所含的有机N易矿化, 因此在整个分解过程中N都是净释放. H(0.627 2%), NC(0.458 3%)尽管在某些时间段有积累, 但相对于N初始含量来说都表现为净释放. 在针叶林生态系统和草地生态系统也存在这样的研究结果, Chen等(2002)对美国15种针叶树细根分解研究表明, N释放速率与N初始含量呈显著正相关, 只要细根N初始含量大于0.4%, 在2年的分解时间内N都表现为净释放. Seastedt等(1992)报道草原高杆草草根N固持作用较低, 死根N初始含量为0.49%. 但也有相反的研究结果, 如Ostertag等(1999)对夏威夷不同立地的桃金娘科植物细根分解研究表明, 1年后细根固持的N是初始含量的2.6倍. 光皮桦与扁穗牛鞭草复合模式细根(草根)N初始含量最高, 在1年的分解过程中N释放最多, 初始N含量较低的柳杉N释放最少, 其损失量占初始含量的21.76%. 因此, N初始含量的高低是导致上述现象的原因.
5 结论各模式细根(草根)分解速率符合Olson单指数分解模型. 采用原状土芯研究得出4种退耕模式细根(草根)分解分为快-慢2个阶段, 前90天分解较快, 以后表现出缓慢趋势. 分解90天以后, H, LS细根木质素含量与分解速率呈显著负相关(P≤0.01), 是影响退耕模式林木细根分解最重要的指标, 但扁穗牛鞭草模式除外. 1年的分解过程中, 各模式细根(草根)分解过程中的C/N与细根分解速率呈极显著负相关(P ≤0.01), 是影响退耕模式细根分解的最大质量指标.
分解1年后N初始含量最高的HN具有最高的N释放率, N初始含量最低的LS具最低的N释放速率, 4种模式N释放速率大小顺序为HN>H>NC>LS, N初始含量高低是导致此现象的原因. 细根(草根)分解释放的N是4种退耕模式的重要N源, 其中光皮桦与扁穗牛鞭草模式在整个分解过程中都表现为净释放, 分解1年后释放N最多, 对于维持该复合生态系统土壤肥力以及养分循环具有重要作用.
鲍士旦. 2005. 土壤农化分析. 北京: 中国农业出版社.
|
董慧霞, 李贤伟, 张健, 等. 2007. 退耕地三倍体毛白杨林地细根生物量及其与土壤水稳性团聚体的关系. 林业科学, 43(5): 24-29. |
范冰, 李贤伟, 张健, 等. 2005. 三倍体毛白杨-黑麦草复合生态系统林木细根与草根的分解及养分动态. 应用生态学报, 169(11): 2030-2034. DOI:10.3321/j.issn:1001-9332.2005.11.005 |
范冰, 李贤伟, 张健, 等. 2007. 退耕还林地三倍体毛白杨与黑麦草复合模式细根和草根的分解动态. 林业科学, 43(增刊): 1-6. |
李华, 孔新刚, 王俊. 2007. 秸秆饲料中纤维素、半纤维和木质素的定量分析研究. 新疆农业大学学报, 30(3): 65-68. DOI:10.3969/j.issn.1007-8614.2007.03.015 |
李培芝, 范世华, 王力华, 等. 2001. 杨树细根及草根的生产力与周转的研究. 应用生态学报, 12(6): 829-832. DOI:10.3321/j.issn:1001-9332.2001.06.007 |
林成芳, 杨玉盛, 陈光水, 等. 2008. 木人工林细根分解和养分释放及化学组成变化. 亚热带资源与环境学报, 3(1): 15-23. DOI:10.3969/j.issn.1673-7105.2008.01.003 |
杨云贵, 龙明秀, 王莺, 等. 2004. 牧草、玉米青贮和作物秸秆营养价值的洗涤剂法评定. 草地学报, 12(2): 132-135. |
王巧, 李贤伟, 杨渺, 等. 2007. 光皮桦-扁穗牛鞭草复合模式细根草根生物量及其空间分布. 四川农业大学学报, 25(4): 430-435. DOI:10.3969/j.issn.1000-2650.2007.04.013 |
张小全, 吴可红. 2001. 森林细根生产与周转研究. 林业科学, 37(3): 126-135. DOI:10.3321/j.issn:1001-7488.2001.03.021 |
张秀娟, 梅莉, 王政权, 等. 2005. 细根分解研究及其存在的问题. 植物学通报, 22(2): 246-254. DOI:10.3969/j.issn.1674-3466.2005.02.017 |
Arunachalam A, Pandey H N, Tripathi R S, et al. 1996. Fine root decomposition and nutrient mineralization patterns in a subtropical humid forest following tree cutting. Forest Ecology and Management, 86: 141-150. DOI:10.1016/S0378-1127(96)03784-X |
Barry R, Taylor D P, Willian F J Parsons. 1989. Nitrogen and lignin content as predictors of litter decay rates: A microcosm test. Ecology, 70(1): 97-104. DOI:10.2307/1938416 |
Berg B. 1984. Decomposition of root litter and some factors regulating the process: long-term root decomposition in a Scots pine forest. Soil Biol Biochem, 16: 609-617. DOI:10.1016/0038-0717(84)90081-6 |
Bloomfield J, Vogt K A, Vogt D J. 1993. Decay rate and substrate quality of fine root and foliage of two tropical tree species in the Luquillo experimental forest, Puerto Rico. Plant and Soil, 150: 233-245. DOI:10.1007/BF00013020 |
Bosire J O, Dahdouh-Guebas F D, Kairo J G, et al. 2004. Litter degradation and CN dynamics in reforested mangrove plantation at Gazi Bay, Kenya. Biological Conservation, 126: 287-295. |
Cairns M A, Brown S, Helmer E H, et al. 1997. Root biomass allocation in the world's upland forest. Oecologia, 111: 1-11. DOI:10.1007/s004420050201 |
Chen H. 1999. Root decomposition in three coniferous forests: effects of substrate quality, temperature, and moisture. Ph D dissertation, Oregon State University, Corvallis, Oreg, Mfilinge, P L, Atta, N.
|
Chen H, Harmon M E, Sexton J, et al. 2002. Fine-root decomposition and N dynamics in coniferous forests of the Pacific Northwest, U.S.A. Canadian Journal of Forest Research, 32: 320-331. DOI:10.1139/x01-202 |
Dornbush M, EIsenhart T M, Raich J W. 2002. Quantifying fine root decomposition: an alternative to buried litterbags. Ecology, 83: 2985-2990. DOI:10.1890/0012-9658(2002)083[2985:QFRDAA]2.0.CO;2 |
Fioretto A, Di Nardo C, Papa S, et al. 2005. Lignin and cellulose degradation and nitrogen dynamics during decomposition of three leaf litter species in a Mediterranean ecosystem. Soil Biology & Biochemistry, 37: 1083-1091. |
Hobbie S H. 1996. Temperature and plant species control over litter decomposition in Alaskan Tundra. Ecol Monogr, 66: 503-522. DOI:10.2307/2963492 |
Hobbie S H. 2000. Interactions between litter lignin and soil nitrogen availability during leaf litter decomposition in a Hawaiian Montane forest. Ecosystems, 3: 484-494. DOI:10.1007/s100210000042 |
McClaugherty C A, Aber J D, Melillo J M. 1984. Decomposition dynamics of fine roots in forested ecosystems. Oikos, 42: 378-386. DOI:10.2307/3544408 |
Ostertag R, Hobbie S E. 1999. Early stages of roots and leaf decomposition in Hawaiian forests: effects of nutrient availability. Oecologia, 121: 564-573. DOI:10.1007/s004420050963 |
Prescott C E. 1995. Does nitrogen availability control rates of litter decomposition in forests. Plant and Soil, 168/169: 83-88. DOI:10.1007/BF00029316 |
Robinson C H, Kirkham J B, Littlewood R. 1999. Decomposition of root mixtures from high arctic plants: a microcosm study. Soil Biol Biochem, 31: 1101-1108. DOI:10.1016/S0038-0717(99)00028-0 |
Scheu S, Schauermann J. 1994. Decomposition of roots and twigs: effects of wood type (beech and ash), diameter, site of exposure and macrofauna exclusion. Plant Soil, 163: 13-24. DOI:10.1007/BF00033936 |
Seastedt T R, Parton W J, Ojima D S. 1992. Mass loss and nitrogen dynamics of decaying litter of grasslands: the apparent low nitrogen immobilization potential of root detritus. Can J Bot, 70: 384-391. DOI:10.1139/b92-052 |
Silver W L, Miya R K. 2001. Global patterns in root decomposition: comparisons of climate and litter quality effects. Oecologia, 129: 407-419. DOI:10.1007/s004420100740 |
Tsuchiya M. 2002. Nutrient dynamics and leaf litter decomposition in a subtropical mangrove forest at Oura Bay, Okinawa, Japan. Trees, 16: 172-180. DOI:10.1007/s00468-001-0156-0 |
Van Soest, Wine P J. 1968. De termination of lignin and cellulose in acid-detergent fibre with permanganate. Journal of the Association of Official Agricultural Chemists, 51: 780-785. |
Vogt K A, Vogt D J, Blooomfield J, et al. 1991. Input of organic matter to the soil by tree roots//Person H, McMichiel. Plant root and their environments. Elsevier, Amslerdam, 171-190. http://www.sciencedirect.com/science/article/pii/B9780444891044500281
|
 2009, Vol. 45
2009, Vol. 45