文章信息
- 漆良华, 张旭东, 周金星, 彭镇华, 岳祥华, 黄玲玲.
- Qi Lianghua, Zhang Xudong, Zhou Jinxing, Peng Zhenhua, Yue Xianghua, Huang Lingling
- 湘西北小流域不同植被恢复区土壤微生物数量、生物量碳氮及其分形特征
- Soil Microbe Quantities, Microbial Carbon and Nitrogen and Fractal Characteristics under Different Vegetation Restoration Patterns in Watershed, Northwest Hunan
- 林业科学, 2009, 45(8): 14-20.
- Scientia Silvae Sinicae, 2009, 45(8): 14-20.
-
文章历史
- 收稿日期:2008-10-18
-
作者相关文章
2. 中国林业科学研究院林业研究所 北京 100091
2. Research Institute of Forestry, CAF Beijing 100091
土壤微生物分解动植物残体, 促进有机质的分解、转化和土壤腐殖质的形成, 加快土壤团粒结构的形成, 改善土壤健康状况, 利于植物生长、发育和群落演替的作用已引起普遍关注(Van Bruggen et al., 2000; 李延茂等, 2004; 胡亚林等, 2006). 土壤微生物数量与生物量是研究和评价土壤微生物调控功能的重要参数(Harris, 2003; 刘满强等, 2003; 徐惠风等, 2004), 数量、分布与组成在很大程度上影响并决定着土壤的生物活性, 在有机质分解, 腐殖质合成、土壤团聚体形成以及土壤养分转化等方面具有关键作用(徐惠风等, 2004). 土壤微生物量则可反映土壤同化和矿化能力的大小, 是土壤活性大小的标志(刘满强等, 2003). 土壤微生物碳(MBC)虽仅占土壤碳库的1%~4%, 却是土壤有效养分的给源和库存; 土壤微生物量氮(MBN)占土壤全氮的0.5%~15.3%, 是土壤氮素养分的源和库, 决定于土壤中微生物的数量(Srivastava et al., 1991; 姜培坤等, 2003). 众多学者针对不同环境条件(土壤、植被、气候)、施肥与耕作措施等因素对土壤微生物数量、生物量的影响及其对土壤肥力变化的预警与响应进行研究(Srivastava et al., 1991; Harris, 2003; 徐惠风等, 2004; 孙瑞莲等, 2004; 蔡琼等, 2006; 曹志平等, 2006; 刘文娜等, 2006), 对不同类型人工林、植被恢复群落以及侵蚀环境植被恢复过程中土壤微生物特性也有一些研究(刘满强等, 2003; 姜培坤等, 2003; Behera et al., 2003; 刘子雄等, 2006; 何友军等, 2006; 杨喜田等, 2006; 朱志建等, 2006; 薛萋等, 2007), 但我国南方大面积黄壤丘陵区因水土流失导致的退化土地植被恢复过程中的土壤微生物特性鲜见报道. 本文以湘西北女儿寨小流域为例, 对退化土地不同植被恢复模式下的土壤微生物数量、生物量碳氮进行研究, 并运用分形理论揭示生物量碳氮与微生物数量之间的空间分布关系, 旨为黄壤丘陵区退化土地植被恢复重建过程中的土壤健康保护、植被恢复模式选择和人工调控提供基础数据.
1 研究区概况研究区位于湖南省张家界市慈利县城关镇两溪村女儿寨小流域(29°30′ N, 110°10′ E). 母岩以板页岩、砂岩为主, 土壤主要为山地黄壤. 光热充足, 雨量充沛, 无霜期长, 严寒期短, 四季分明, 年均日照1 440 h, 年均气温16 ℃, 年均降水量1 400 mm, 平均无霜期216~269天, 属中亚热带山原型季风性湿润气候. 流域封闭相对良好, 面积2.81 km2, 沟口海拔210 m, 最高峰海拔917.4 m. 流域内坡度陡, 土层薄, 雨量大, 土层抗侵蚀年限短, 水土流失导致土地退化严重. 自1993年开始实施人工造林和封山育林相结合的植被恢复与重建, 形成的典型植物群落类型主要有马尾松(Pinus massoniana)天然林、杉木(Cunninghamia lanceolata)人工林、杜仲(Eucommia ulmoides)人工林、油桐(Vernicia fordii)人工林、润楠(Machilus pingii)次生林、毛竹(Phyllostachys edulis)杉木混交林及荒草灌丛等(漆良华等, 2007). 主要灌木种类有□木(Loropetalum chinensis)、苎麻(Boehmeria nivea)、悬钩子(Rubus palmatus)、白背叶(Mallotus apelta)、飞蛾槭(Acer oblongum)、油茶(Camellia oleifera)等, 主要草本植物有铁芒萁(Dicranopteris linearis)、白茅(Imperata spp.)、香石竹(Dianthus caryophyllus)、荩草(Arthraxon hispidus)、鱼腥草(Houttuynia cordat)、沿阶草(Ophiopogon japonicus)、千里光(Senecio scandens)、莎草(Cyperus rotundus)、边缘鳞盖蕨(Microlepia marginata)、渐尖毛蕨(Cyclosorus acuminatus)、凸轴蕨(Metathelypteris singalanensis)等, 还有藤黄檀(Dalbergia hancei)、海金沙(Lygodium japonicum)、赤□(Thladiantha nudiflora)、菝葜(Smilax china)、木防已(Cocculus orbiculatus)、三叶木通(Akebia trifoliate)等层外植物.
2 研究方法 2.1 样地设置与土样采集分析对流域内6种森林群落各设置样地3个, 荒草灌丛群落样地2个(作为对照), 样地面积600 m2. 每个样地中按对角线等距离设置9个小样方(2 m×2 m)进行灌木层的调查, 9个小样方(1 m×1 m)进行草本层的调查, 共计调查样地20个, 灌木层小样方180个, 草本层小样方180个. 在样地内全面开展地质、地貌、土壤、植被的调查: 1)立地因子调查, 包括各植被类型所处海拔、坡度、坡位、坡向等; 2)植物群落特征调查, 分层测定乔木层、灌木层和草本层生物量, 实测群落分层盖度、林分郁闭度、林木胸径、树高、冠幅和枝下高, 统计植物种类、株(丛)数、植株高度、盖度等; 3)土壤因子调查, 每个样地挖土壤剖面1个, 剖面规格为1.5 m(长)×1.0 m(宽), 深至母质, 详细记录剖面信息, 分层(0~20 cm, 20~40 cm)环刀采集原状土, 测定土壤水分物理性质, 同时按对角线5点混合法分别取不同土层混合土样1 kg左右, 分成2份, 1份鲜样去杂、过筛后分析土壤微生物数量与微生物量, 另1份风干、去杂、过筛后测定土壤相关土壤理化性质及各类酶活性, 于2006年7月13日采集土样. 不同植被恢复模式主要植被特征见表 1. 土壤主要理化性质参见已有研究结果(漆良华等, 2008).
|
|
采用平板涂抹法计数测定土壤中细菌、真菌、放线菌数量, 细菌用牛肉膏蛋白胨培养基, 真菌用马丁氏培养基, 放线菌用改良高氏1号培养基. 微生物量C/N用氯仿熏蒸0.5 mol·L-1 K2SO4溶液浸提测定, 分别用重铬酸钾氧化法、凯氏定氮仪蒸馏法测定滤液中的C, N含量(中国科学院南京土壤研究所, 1985; 许光辉等, 1996).
2.2 微生物数量与生物量碳氮分形特征的表征方法分形(Fractal)理论是指部分和整体在形态、功能和信息等方面具有相似性, 分形维数(Fractal dimension)是描述分形体分形特征的重要参数(祖元刚等, 1996). 设A为一测度指标(如质量、重量、生物量等), B为度量所采用的尺度指标(如数量、长度、面积、体积等), 若2者存在如下关系: A=kBD, 则D即为分形维数, k为比例系数(常量). D值的计算方法是在双对数坐标下对A、B的一系列值进行线性回归, 所得拟合直线的斜率. 据此分别计算不同植被恢复模式下微生物量碳、氮与细菌、真菌及放线菌数量对应关系的D值, 以及小流域尺度下微生物生物量与数量关系的D值(何池全等, 2003).
2.3 统计分析土壤微生物数量、生物量的方差分析、多重比较, 以及微生物量碳氮与微生物数量的分形模型构建应用SPSS统计分析软件的相关程序.
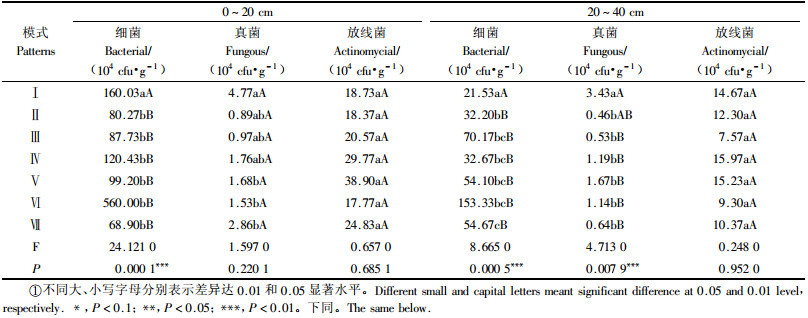
3 结果与分析 3.1 土壤微生物数量细菌是土壤微生物的主要类群, 个体小, 数量多, 繁殖快, 在将植物不能利用的复杂含氮化合物转化为可给态的含氮无机化合物的氨化作用等物质循环过程中具有关键作用, 同时还可产生多糖、脂类、蛋白质等胞外代谢物, 可发挥稳定团聚体的胶结作用.
由表 2可知: 细菌数量在0~20, 20~40 cm土层均存在显著差异(P < 0.01), 表明不同植被恢复模式对土壤细菌类群的数量、分布存在重要影响. 0~20, 20~40 cm土层细菌数量排序分别为Ⅵ>Ⅰ>Ⅳ>Ⅴ>Ⅲ>Ⅱ>Ⅶ, Ⅵ>Ⅲ>Ⅶ>Ⅴ>Ⅳ>Ⅱ>Ⅰ. 模式Ⅵ的细菌数量在不同土层均最高, 分别为5.60×106, 1.53×106 cfu·g-1, 这一方面是由于杉木、毛竹枯枝落叶物的凋落、分解, 为细菌的生长提供丰富的碳源和氮源, 另一方面由于模式Ⅵ所处立地条件较其他6种植被恢复模式通气透水, 有利于激发细菌的繁育. 表层土壤细菌数量以模式Ⅶ最低(6.89×105 cfu·g-1), 这与荒草灌丛恢复年限短, 凋落物少, 土壤有机质含量低, 细菌生长所需能源匮乏有关.
|
|
真菌在土壤碳素和能量流动过程中作用巨大. 0~20 cm土层真菌数量在不同模式之间的差异不具有统计学意义(P>0.1), 以模式Ⅰ最高(4.77×104 cfu·g-1), 模式Ⅱ最低(8.90×103 cfu·g-1); 20~40 cm土层真菌数量均存在极显著差异(P < 0.01), 真菌数量最高为模式Ⅰ(3.43×104 cfu·g-1), 模式Ⅱ最低(4.60×103 cfu·g-1), 2者相差7.46倍, 排序为Ⅰ>Ⅴ>Ⅳ>Ⅵ>Ⅶ>Ⅲ>Ⅱ. 模式Ⅰ不同土层真菌数量均最高, 可能与马尾松天然林所处立地条件等因素有关.
放线菌对土壤中有机化合物的分解及土壤腐殖质的合成具有重要作用. 0~20 cm土层模式Ⅴ放线菌数量最高(3.89×105 cfu·g-1), 模式Ⅵ最低(1.78×105 cfu·g-1); 20~40 cm土层最高为Ⅳ(1.59×105 cfu·g-1), 最低为Ⅲ(7.57×104 cfu·g-1), 表明不同模式下放线菌的数量变化尽管存在差异, 但0~20, 20~40 cm土层放线菌数量差异均未达到显著水平(P>0.1).
从不同植被恢复模式土壤微生物组成来看, 细菌是土壤微生物的主要类群, 数量最多, 为2.153×105~5.60×106 cfu·g-1, 占全部微生物比例为72.83%~92.77%; 其次为放线菌数量, 为7.57×104~3.89×105 cfu·g-1, 所占比例为6.44%~25.61%; 真菌数量最少, 为4.60×103~4.77×104 cfu·g-1, 所占比例仅为0.79%~1.99%. 这表明在退化土地植被恢复重建过程中, 细菌的繁殖力、竞争力以及土壤养分有效化能力强于其他类群; 放线菌与真菌数量上虽不及细菌, 但其绝对数量也较多, 其对于不同植被恢复模式下的物质循环、能量流动具有重要的调控作用.
细菌、真菌及放线菌数量均表现出0~20 cm土层高于20~40 cm土层, 具有表聚性. 这是因为在枯枝落叶较多的表土层土壤有机质较为丰富, 结构疏松, 为微生物的活动提供良好的营养和通气条件, 且表层土壤与空气热交换, 土壤热值状况比下层好, 利于微生物的生长繁殖.
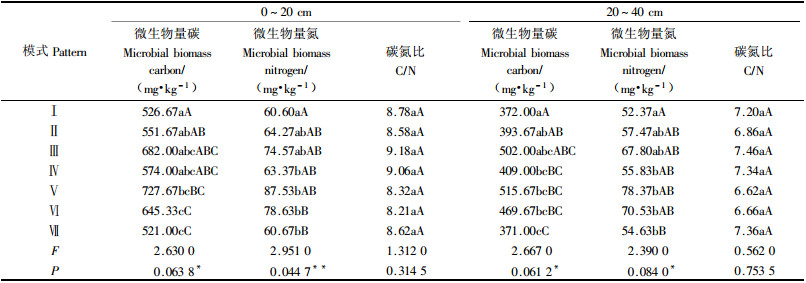
3.2 土壤微生物量碳氮由于土壤微生物量周转快, 灵敏度高, 可以反映土壤微小的变化, 土壤能量循环、养分转移与运输, 与土壤健康有着十分紧密的关系, 因而常作为研究土壤健康的生物学指标.
由表 3可知: 不同植被恢复模式不同土层土壤微生物量碳、微生物量氮均有显著差异(P < 0.1), 表明植被恢复对土壤微生物量影响显著, 也反映土壤微生物量在监测土壤质量的植被恢复效应具有指示作用. 0~20 cm土层微生物量碳、微生物量氮均大于20~40 cm土层, 说明土壤微生物量也具有一定的表聚性. 随着土层加深, 微生物量碳、微生物量氮呈下降趋势, 这是由于土壤中大多数微生物属于有机营养型, 随着植物根系分泌物和脱落物的不断减少以及土层温度的降低, 土壤中有机物质和无机物质逐渐减少, 为土壤微生物提供的营养物质下降, 减慢了微生物的自身合成代谢, 从而导致微生物生物量的降低.
|
|
不同植被恢复模式土壤微生物量碳、微生物量氮在不同土层的大小变化规律一致. 微生物量碳大小排序为Ⅴ>Ⅲ>Ⅵ>Ⅳ>Ⅱ>Ⅰ>Ⅶ, 各模式不同土层依次比荒草灌丛模式高出38.99%~39.67%, 30.90%~35.31%, 23.86%~26.60%, 10.17%~10.24%, 5.89%~6.11%, 0.27%~1.09%. 微生物量氮大小排序为Ⅴ>Ⅵ>Ⅲ>Ⅱ>Ⅳ>Ⅶ>Ⅰ, 仅马尾松天然林模式土壤微生物量氮低于荒草灌丛0.12%~4.32%, 其他5种模式土壤微生物量氮依次高于荒草灌丛模式43.46%~44.27%, 29.10%~29.60%, 22.91%~24.11%, 5.20%~5.93%, 2.20%~4.45%. 可见, 退化土地不同植被恢复模式条件下, 荒草灌丛模式土壤微生物量碳、微生物量氮含量总体偏低, 这是由于其他模式由于林木凋落物、根表脱落物和根系分泌物对土壤碳库、氮库的不断补充, 使土壤微生物数量增加, 从而不断增强土壤生物活性, 土壤微生物量C/N不断上升.
3.3 微生物量碳氮与微生物数量的分形特征土壤微生物生物量反映参与调控土壤中能量和养分循环以及有机物质转化的微生物数量. 湘西北小流域退化土地不同植被恢复模式下土壤微生物量碳、微生物量氮与真菌、细菌及放线菌数量的分形特征如表 4. 由表 4可知; 微生物量碳与土壤细菌及放线菌数量具有良好的分形关系, 相关系数R分别为0.672 0, 0.639 1, 分别达到极显著(P<0.01)和显著水平(P<0.05), 分形维数D值分别为5.446 5, 5.358 4. 微生物量氮与土壤细菌数量的分形关系也达到显著水平(R=0.593 2, P<0.05), 分形维数D值为3.687 4; 微生物量氮与土壤放线菌数量的分形关系经F检验未达到显著水平(R=0.332 1, P>0.1). 微生物量碳与细菌、放线菌数量, 微生物量N与细菌数量的分形特征模型的回归参数经t检验均具有统计学意义(P<0.05), 而土壤微生物量碳、微生物量氮与真菌数量之间不存在分形关系.
|
|
土壤微生物数量、分布与组成在很大程度上影响并决定着土壤的生物活性, 在有机质分解、腐殖质合成、土壤团聚体形成以及土壤养分转化等方面具有关键作用(Harris, 2003; 李延茂等, 2004). 7种植被恢复模式物种组成、年龄和发育阶段不同, 其分泌物的种类、数量和性质也不同, 从而影响微生物数量和种类分布的差异. 毛竹杉木混交林模式不同土层细菌数量均最多, 马尾松天然林模式不同土层真菌数量均最多; 0~20, 20~40 cm土层放线菌数量分别以润楠次生林模式、油桐人工林模式最高. 细菌是土壤微生物的主要类群, 占全部微生物比例为72.83%~92.77%; 其次为放线菌数量, 所占比例为6.44%~25.61%; 真菌数量最少, 所占比例仅为0.79%~1.99%. 细菌、真菌及放线菌数量具有明显的表聚效应, 一方面可能是由于土壤表层根系密集, 根系分泌物及死亡根系为微生物的生长繁殖提供了丰富的能源物质, 另一方面是随着土层的降低, 土壤温度下降, 限制了土壤微生物的活动, 这与刘子雄等(2006)对不同退耕还林模式下, 徐惠风等(2004)对长白山沼泽湿地土壤微生物数量变化规律较为相似.
4.2 土壤微生物量碳氮土壤微生物量是指土壤中除了活的植物体(如植物根系等)外, 体积小于5×103 μm3的生物总量, 一直为国际土壤学界研究的热点(Arunachalam et al., 2003). 土壤微生物量碳, 氮的高低是衡量土壤生物肥力的重要指标, 地上植被类型被认为是影响土壤微生物活动的重要因子(朱志建等, 2006). 随着土层加深, 土层温度降低和营养物质供给减少, 因而不同植被恢复模式0~20 cm土层微生物量碳、微生物量氮均大于20~40 cm土层, 这与刘满强等(2003)退化红壤植被恢复下土壤微生物量的研究以及蔡琼等(2006)对马尾松林下土壤微生物生物量研究结果一致. 微生物量碳, 氮大小排序分别为Ⅴ>Ⅲ>Ⅵ>Ⅳ>Ⅱ>Ⅰ>Ⅶ, Ⅴ>Ⅵ>Ⅲ>Ⅱ>Ⅳ>Ⅶ>Ⅰ, 可见荒草灌丛模式土壤微生物量碳, 氮含量总体偏低, 这是由于该模式凋落物等少, 自然恢复条件下土壤碳库、氮库难以及时补充. 因此, 在女儿寨小流域退化土地植被恢复重建过程中, 对于荒草灌丛模式应采取积极的人工辅助措施, 通过引入地带性针阔叶树种, 加大土壤培肥力度, 以提高土壤微生物量, 改善土壤健康状况.
土壤中可被土壤微生物利用营养的C/N是表征土壤微生物生长是受碳限制或是氮限制的重要指标, 影响到土壤微生物的群落结构. 当C/N≥30:1时, 土壤微生物生长受到氮源限制; 当C/N≤20:1时, 土壤微生物生长受到碳源限制; 当C/N在25:1时对土壤微生物生长最有利, 有利于维持土壤微生物在自然生态系统中的正常功能(姜培坤等, 2003; 李延茂等, 2004). 由表 3可知: 不同植被恢复模式不同土层土壤微生物量C/N值很稳定, 变幅较小, 分别为8.21~9.18, 6.62~7.46, 两者在不同土层均呈很好的线性关系, 这表明土壤微生物量碳, 氮所反映土壤健康的变化是一致的, 且碳源供给数量是女儿寨小流域退化土地土壤微生物生长的主要限制因子.
4.3 微生物量碳氮与微生物数量的分形特征分形理论自引入生态学领域研究以来, 广泛应用于植物种群分布格局及土壤团聚体结构等方面的研究(杨培岭等, 1993; 祖元刚等, 1996), 而针对土壤微生物量与微生物数量的关系探讨未见报道. 湘西北寨小流域退化土地不同植被恢复模式下微生物量碳、氮与微生物数量的分形特征研究表明, 微生物量碳与细菌(P<0.01)、放线菌数量(P<0.05), 微生物量氮与细菌数量(P<0.05)之间具有明显的分形特征, 其分形模型精度及分形维数D值经F检验、t检验均达到显著水平. 由分形模型拟合得到的D值是对土壤微生物量碳、氮空间分布的维度特征的表征, D值越大, 表明微生物量碳、氮在土壤空间积累越多, 分布空间越大. 由分形模型的D值可知, 土壤微生物量碳、氮的积累与土壤微生物种类、数量的空间分布格局存在差异, 表现为微生物量碳与细菌数量的关系最相关(D=5.446 5), 其次为微生物量碳与放线菌数量(D=5.358 4), 再次为微生物量氮与细菌数量(D=3.687 4), 而微生物量氮与土壤放线菌数量的分形关系经F检验未达到显著水平(R=0.332 1, P>0.10), 土壤微生物量碳、微生物量氮与真菌数量之间不存在分形关系, 其原因有待进一步研究. 同时, 土壤微生物量与微生物数量空间分布分形特征的存在, 可以通过土壤微生物的数量变化来预测微生物生物量的动态变化, 从而对土壤健康变化进行有效预警.
蔡琼, 丁贵杰. 2006. 黔中地区连栽马尾松林对土壤微生物的影响. 南京林业大学学报:自然科学版, 30(3): 131-133. |
曹志平, 胡诚, 叶钟年, 等. 2006. 不同土壤培肥措施对华北高产农田土壤微生物生物量碳的影响. 生态学报, 26(5): 1486-1493. DOI:10.3321/j.issn:1000-0933.2006.05.025 |
何池全, 赵魁义. 2003. 毛果苔草种群地上生物量与株长或鞘高分形特征. 应用生态学报, 14(4): 640-642. DOI:10.3321/j.issn:1001-9332.2003.04.037 |
何友军, 王清奎, 汪思龙, 等. 2006. 杉木人工林土壤微生物生物量碳氮特征及其与土壤养分的关系. 应用生态学报, 17(12): 2292-2296. DOI:10.3321/j.issn:1001-9332.2006.12.012 |
胡亚林, 汪思龙, 颜绍馗. 2006. 影响土壤微生物活性与群落结构因素研究进展. 土壤通报, 37(1): 170-176. DOI:10.3321/j.issn:0564-3945.2006.01.038 |
姜培坤, 周国模. 2003. 侵蚀型红壤植被恢复后土壤微生物量碳、氮的演变. 水土保持学报, 17(1): 112-114. DOI:10.3321/j.issn:1009-2242.2003.01.027 |
李延茂, 胡江春, 汪思龙, 等. 2004. 森林生态系统中土壤微生物的作用与应用. 应用生态学报, 15(10): 1943-1946. DOI:10.3321/j.issn:1001-9332.2004.10.048 |
刘满强, 胡锋, 何园球, 等. 2003. 退化红壤不同植被恢复模式下土壤微生物量季节动态及其指标意义. 土壤学报, 40(6): 937-743. DOI:10.3321/j.issn:0564-3929.2003.06.020 |
刘文娜, 吴文良, 王秀斌, 等. 2006. 不同土壤类型和农业用地方式对土壤微生物量碳的影响. 植物营养与肥料学报, 12(3): 406-411. DOI:10.3321/j.issn:1008-505X.2006.03.020 |
刘子雄, 朱天辉, 张健. 2006. 两种不同退耕还林模式下的土壤微生物特性研究. 水土保持学报, 20(3): 132-135. DOI:10.3321/j.issn:1009-2242.2006.03.032 |
漆良华, 张旭东, 彭镇华, 等. 2008. 湘西北退化侵蚀地植被恢复区土壤养分、微生物与酶活性的典范相关分析. 林业科学, 44(9): 1-6. DOI:10.3321/j.issn:1001-7488.2008.09.001 |
漆良华, 张旭东, 周金星, 等. 2007. 湘西北小流域典型植被恢复群落土壤持水量与入渗特性. 林业科学, 43(4): 1-8. |
孙瑞莲, 朱鲁生, 赵秉强, 等. 2004. 长期施肥对土壤微生物的影响及其在养分调控中的作用. 应用生态学报, 15(10): 1907-1910. DOI:10.3321/j.issn:1001-9332.2004.10.040 |
许光辉, 郑洪元. 1996. 土壤微生物分析方法手册. 北京: 农业出版社.
|
徐惠风, 刘兴土, 白军红. 2004. 长白山沟谷湿地乌拉苔草沼泽湿地土壤微生物动态及环境效应研究. 水土保持学报, 18(3): 115-122. DOI:10.3321/j.issn:1009-2242.2004.03.029 |
薛萋, 刘国彬, 戴全厚, 等. 2007. 侵蚀环境生态恢复过程中人工刺槐林(Robinia pseudoacacia)土壤微生物量演变特征. 生态学报, 27(3): 909-917. DOI:10.3321/j.issn:1000-0933.2007.03.010 |
杨培岭, 罗远培, 石元春. 1993. 用粒径的重量分布表征的土壤分形特征. 科学通报, 38(20): 1896-1899. DOI:10.3321/j.issn:0023-074X.1993.20.010 |
杨喜田, 宁国华, 董惠英, 等. 2006. 太行山区不同植被恢复群落土壤微生物学特征变化. 应用生态学报, 17(9): 1761-1764. DOI:10.3321/j.issn:1001-9332.2006.09.040 |
中国科学院南京土壤研究所. 1985. 土壤微生物研究法. 北京: 科学出版社.
|
朱志建, 姜培坤, 徐秋芳. 2006. 不同森林植被下土壤微生物量碳和易氧化态碳的比较. 林业科学研究, 19(4): 523-526. DOI:10.3321/j.issn:1001-1498.2006.04.022 |
祖元刚, 马克明. 1995.分形理论与生态学//李博.现代生态学讲座.北京: 科学出版社, 65-72.
|
Arunachalam A, Pandey H. 2003. Ecosystem restoration of Jhum fallows in Northeast India: microbial C and N along altitudinal and successional gradients. Restoration Ecology, 11: 168-173. DOI:10.1046/j.1526-100X.2003.00013.x |
Behera N, Sahani U. 2003. Soil microbial biomass and activity in response to Eucalyptus plantation and natural regeneration on tropical soil. Forest Ecology Management, 174: 1-11. DOI:10.1016/S0378-1127(02)00057-9 |
Harris J A. 2003. Measurements of the soil microbial community for estimating the success of restoration. Europe Journal of Soil Science, 54: 801-808. DOI:10.1046/j.1351-0754.2003.0559.x |
Srivastava S C, Singh J S. 1991. Microbial C, N and in dry tropical forest soils: Effects of alternate land use and nutrient flux. Soil Biology and Biochemistry, 23(2): 117-124. DOI:10.1016/0038-0717(91)90122-Z |
Van Bruggen A H C, Semenov A M. 2000. In search of biological indicators for soil health and disease suppression. Applied Soil Ecology, 15: 13-24. DOI:10.1016/S0929-1393(00)00068-8 |
 2009, Vol. 45
2009, Vol. 45