文章信息
- 黄红英, 窦新永, 邓斌, 吴国江, 彭长连.
- Huang Hongying, Dou Xinyong, Deng Bin, Wu Guojiang, Peng Changlian
- 不同次生种源麻疯树对高温胁迫的响应
- Responses of Different Secondary Provenances of Jatropha curcas to Heat Stress
- 林业科学, 2009, 45(7): 150-155.
- Scientia Silvae Sinicae, 2009, 45(7): 150-155.
-
文章历史
- 收稿日期:2009-01-06
-
作者相关文章
2. 中国科学院华南植物园 广州 510650;
3. 湘南学院化学与生命科学系 郴州 423000
2. South China Botanical Garden, Chinese Academy of Sciences Guangzhou 510650;
3. Department of Chemistry and Life Science, Xiangnan College Chenzhou 423000
麻疯树(Jatropha curcas)又名小桐子,起源于美洲热带地区,引种到我国有100年历史,已经在其适应区发展成野生或半野生状态,主要分布于我国的广东、广西、云南、四川、贵州、台湾、福建等省区,其中以西南地区的干热河谷最为集中,在贵州也主要分布于罗甸、册亨、安龙、贞丰和望谟干热河谷地区。它是一种抗旱耐贫瘠的速生树种,具有较大开发潜力(张明生等,2005)。它的种子含有多种药用成分(林娟等,2004),且含油量高达40%~60%(邓志军等,2005),可以用来研制生物柴油。当前开发利用麻疯树种子油作为部分石化燃料的替代物,已备受国内外科学家的关注。
高温是影响植物生长的主要原因之一(王利军等,2000)。光合作用是植物生长的生理基础,可以作为判断植物生长势和抗逆性强弱的指标(惠红霞等,2003)。高温胁迫可以使植物光合速率下降,生长减缓,出现氧化伤害症状(郭培国等,2000)。因此,研究光合作用对高温胁迫的响应,阐明高温胁迫对植物光合作用影响的机理十分重要。目前对麻疯树生物学特性的研究主要集中在种子和乳汁的化学成分、毒理学和分子水平方面,而有关麻疯树对环境因子的生理生态适应性研究较少,仅有少量关于其光合特性(张诗莹等,2005)、对低温(罗通等,2005;2006)和干旱(窦新永等,2008)的适应性研究,对于高温胁迫适应能力的研究却未见报道。随着温室效应的加剧,全球气温升高,鉴定、筛选与提高经济植物的耐高温性是现代农林业发展的迫切需要。本文以海南和贵州2个地区来源的麻疯树次生种源为研究材料,通过测定不同温度处理的叶圆片生理指标和叶绿素荧光参数,比较2个不同次生种源麻疯树对高温的适应能力,为麻疯树的大面积推广引种提供理论依据。
1 材料与方法 1.1 植物材料种子分别来源于生长在海南文昌市的麻疯树(树龄约为5年)和黔西南州兴义县的麻疯树(树龄约为4年)。种子发芽后种植于中国科学院华南植物园,2年生,一般田间管理。苗高2 m左右,海南麻疯树地径18.5 cm,贵州次生种源地径18.2 cm,生物量没有明显的差别。从植株叶片的外形上可以区分2种不同来源地的麻疯树,海南次生种源麻疯树的叶片大边缘圆,贵州麻疯树的叶片相对小边缘尖些。选取长势一致的植株取其成熟叶片,每种处理3棵,每棵2个叶片,试验的各项测定于2007年7—8月进行。
1.2 叶片膜渗漏率的测定取0.5 g切碎的叶片置于25 ℃的20 mL蒸馏水浸泡1.5 h,测定渗出液的电导率(DDS-11C电导仪),接着煮沸30 min,再测定叶片浸出液电导率,计算煮沸前后电解质渗漏的相对百分数,每处理测定重复3次。
1.3 有机自由基DPPH·清除能力的测定参照彭长连等(2000)的方法。称取0.5 g切碎的叶片,用50%的乙醇提取,4 ℃温度条件下13 000 g·min-1离心10 min,取上清液测定,以单位质量的叶片样品对1,1-二苯基2-苦基苯肼(1,1-Diphenyl-2-picrylhydrazyl,DPPH·)的实际清除量计算样品对有机自由基的清除能力,每处理测定重复3次。
1.4 不同温度对离体叶片光合放氧速率影响的测定根据Delien(1983)用叶圆片氧电极(Hasatech,King's Lynn,UK)测定叶片的放氧速率。叶室内温度由水浴锅循环水控制(分别设定25,30,35,40,45,50 ℃梯度),叶片切成标准叶圆片(10 cm2),向叶室内呼气使CO2浓度达3%~5%,并用该装置的光源附件设定光强,光照强度设为600 μmol·m-2s-1。每处理测定重复3次。
1.5 不同温度对离体叶片叶绿素荧光参数影响的测定取2种次生种源麻疯树植物距植株顶端第3~4位成熟叶片,用打孔器打成直径1 cm的叶圆片,然后进行温度处理,每个处理重复6个叶圆片。将叶圆片放入蒸馏水中分别置于25,30,35,40,50 ℃不同温度梯度的恒温水浴中,热胁迫30 min,以25 ℃处理的叶圆片作为对照。利用叶绿素荧光成像系统(Walz,Germany)测定叶圆片叶绿素荧光参数。测定前,叶圆片暗适应15 min,先照射测量光(小于0.5 μmol·m-2s-1)测定初始荧光F0,再照射饱和脉冲(2 800 μmol·m-2s-1,脉冲时间0.8 s)测定最大荧光Fm。充分暗适应的PSⅡ最大光化学效率或原初光能转化效率(Fv/Fm)及ΦPSⅡ、qP、NPQ由仪器自动给出,或由下列公式计算出:Fv/Fm=(Fm-Fo)/Fm;ΦPSⅡ=1-Fs/Fm;qP=(Fm′-Fs)/(Fm′-Fo′);NPQ=Fm/Fm′-1。
2 结果与分析 2.1 高温对膜渗漏率的影响高温对植物的伤害重要特征之一就是破坏细胞膜系统。细胞质膜透性的大小反映细胞膜受损伤的程度。质膜透性越大,细胞膜损伤越严重。电解质外渗率的大小可以反映细胞膜受伤害程度的强弱,由图 1可知,随着温度的升高,麻疯树的细胞膜电解质渗透率变化不大,在重度高温45 ℃以上的胁迫下,质膜渗透率急剧上升,显示叶片的细胞膜明显受到伤害。其中贵州次生种源麻疯树的生物膜伤害程度高于海南的,由此可知,海南次生种源麻疯树对高温的适应能力强于贵州的,这可能是其长期适应强光、高温生长环境的结果。

|
图 1 高温胁迫对2种不同次生种源麻疯树膜渗漏率的影响 Figure 1 Effect of high temperature on membrane leakage in leaves of two different secondary provenances of Jatropha curcas |
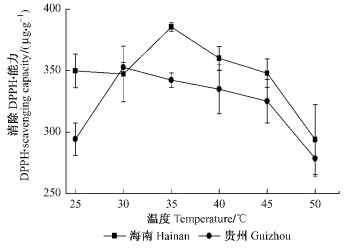
研究高温下植物的抗氧化作用有助于更好地了解植物对高温的适应性。如图 2可知,随着温度的上升,麻疯树对有机自由基(DPPH·)的清除能力呈先上升后下降的趋势,海南次生种源麻疯树在35 ℃时的清除能力最大,而贵州的在30 ℃出现峰值。海南和贵州次生种源麻疯树清除有氧自由基的最适合温度分别在35和30 ℃左右,海南次生种源麻疯树的最适温度高于贵州的。
|
图 2 高温胁迫对2种不同次生种源麻疯树清除有机自由基(DPPH·)能力的影响 Figure 2 Effect of high temperature on the ability of eliminating DPPH· in leaves of different secondarv provenances of J. curcas |
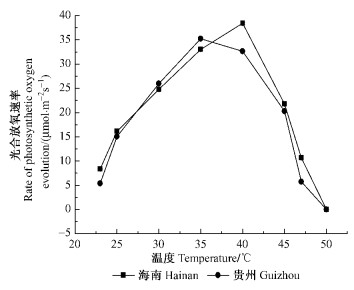
2种植物光合叶片放氧速率对不同温度的响应如图 3所示,光合放氧速率随温度升高的变化规律与不同温度下DPPH的清除率的变化趋势相似,在23~35 ℃范围,2种次生种源麻疯树的光合放氧速率增加,贵州次生种源麻疯树在35 ℃,海南的在40 ℃时的放氧速率均达最大,分别为35.223,38.422 μmol·m-2s-1。2种次生种源麻疯树植物的放氧速率达到最大后,随着温度升高急剧下降。在47 ℃时,2者的放氧速率分别为5.730和10.677 μmol·m-2s-1,当温度达50 ℃时,海南和贵州麻疯树次生种源均不再放氧,放氧速率降为0。由此可知:本试验条件下海南次生种源麻疯树的最适温度为40 ℃,依然高于贵州的35 ℃的最适温度。测定光合放氧速率时,最适温度比清除有机自由基的温度有所升高,这可能由于在测定光合放氧时,需要光照,而光照对植物的光合机构具有一定保护作用(Sato et al., 2003)。
|
图 3 高温胁迫对2种不同次生种源麻疯树光合放氧速率的影响 Figure 3 Effect of high temperature on the rate of photosynthetic oxygen evolution in leaves of different secondary provenances of J. curcas |
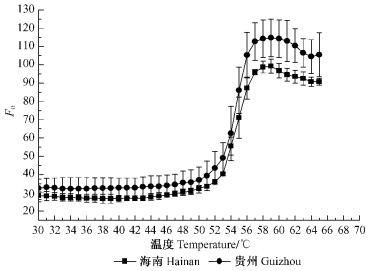
Fo荧光参数是叶绿体类囊体膜结构耐热性的敏感指标,是PSⅡ反应中心全部开放时的荧光,反映光能在色素水平上的转移及激发能捕获的效率(Oren et al., 1990;Georgieva et al., 1993)。图 4是2种次生种源麻疯树叶片的Fo-温度曲线,随着温度的持续升高,Fo-T曲线逐渐上升。拐点温度(Ti)是植物忍受最高温度的临界点,该温度的出现表示光合膜开始出现不可逆的伤害。本试验中2种麻疯树次生种源对高温的敏感性不同,Fo快速增高的拐点温度分别为52 ℃(海南)和50 ℃(贵州),贵州次生种源麻疯树Ti温度比海南的低2 ℃,而引起Fo下降的拐点温度(Tp)为58.9,59.01,差异不大,显示海南麻疯树光合膜的耐热性比贵州麻疯树高。
|
图 4 高温诱导2种不同次生种源麻疯树叶片的Fo温度曲线 Figure 4 Fo-temperature curves in leaves of two different secondary provenances of J. curcas under high temperature |
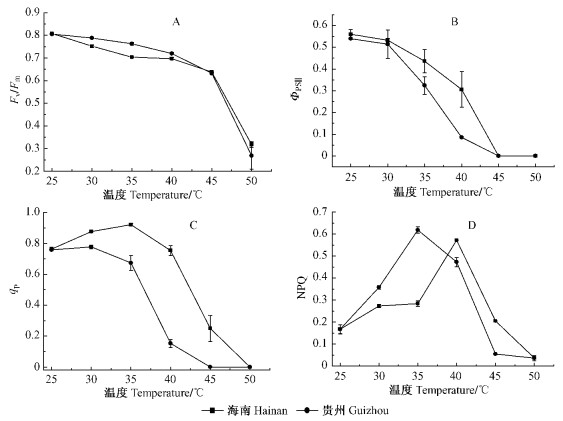
PSⅡ最大原初光化学量子效率(Fv/Fm)是PSⅡ最大光化学转化效率的度量。在非环境胁迫条件下,叶片PSⅡ最大原初光能转换效率(Fv/Fm)极少变化,但由图 5A可知,Fv/Fm随着温度的上升而出现下降,在温度低于45℃时,Fv/Fm下降缓慢,而高于45 ℃时,Fv/Fm下降幅度极其显著,2种次生种源麻疯树Fv/Fm变化趋势相同,且2者间没有显著差异(P>0.05)。
ΦPSⅡ表示通过PSⅡ的非环式电子传递的量子效率,反映了吸收的光子供给经PSⅡ反应中心的效率及开放的反应中心的比例(Krall et al., 1992),随着温度的上升,ΦPSⅡ呈下降的趋势,但温度在30~40 ℃,海南次生种源麻疯树下降的速度小于贵州的,贵州次生种源麻疯树在30~40 ℃之间下降速度最快,而40~45 ℃是海南的下降最快的阶段(图 5B),贵州ΦPSⅡ对高温胁迫更加敏感。
|
图 5 高温胁迫对2种不同次生种源麻疯树荧光参数的影响 Figure 5 Effect of high temperature on chlorophyll fluorescence parameters in leaves of two different secondary provenances of J. curcas |
非光化学猝灭系数(NPQ)表示植物无害化热耗散过剩激发能的能力(Muller et al., 2001),图 5C表示在高温胁迫下海南、贵州次生种源麻疯树的NPQ的变化过程,随着温度的升高,NPQ都出现先上升后下降的变化趋势,两者的NPQ的峰值分别出现在40和35 ℃,说明2种次生种源麻疯树在温度低于40和35 ℃时,还可以通过增加热耗散方式消耗过剩的激发能,而海南的在温度高于40 ℃,贵州的在温度高于35 ℃时,通过热耗散激发过剩的能量的能力开始受损伤而下降,光合机构不能及时耗散过多的激发能,光合机构损伤。
光化学淬灭(qP)反映了PSⅡ原初电子受体QA的还原状态,它由QA重新氧化形成。光化学淬灭系数qP愈大,QA重新氧化形成QA+的量愈大,即PSⅡ的电子传递活性愈大(张守仁,1999)。如图 5D所示,海南和贵州次生种源麻疯树的qP随着温度的升高呈先轻微上升后显著下降的趋势,海南的qP峰值出现在35 ℃左右,而贵州的峰值出现在30 ℃左右,并且,在温度高达到45 ℃时,海南次生种源麻疯树还有光合放氧作用,但贵州的光合放氧为0。
3 讨论高温是不利于植物生长的重要的环境因素之一,直接影响植物光合机构的形成与功能。2种次生种源麻疯树对高温的响应存在差异,海南的比贵州的有更高的耐高温能力强于贵州的。35 ℃及更高的温度导致供试的2种次生种源麻疯树光合效率都降低(图 5A),说明高温加重了光合作用光抑制。高温逆境首先影响麻疯树的光合电子传递过程,其次是耗散过剩激发能的能力。与Fv/Fm相比(下降21.04%~21.48%),ΦPSⅡ在45 ℃高温时降低比例更大(100%)(图 5B),暗示PSⅡ光合线性电子传递反应比光化学能转化反应对高温更敏感,即高温对PSⅡ光合电子传递的影响高于其对光能转化的影响。高温胁迫引起叶绿素荧光猝灭系数的变化,qP是由光合作用的光化学反应引起的荧光水平降低,NPQ则表示植物以热的形式耗散过剩激发能的能力(Bilger et al., 1995)。2种植物qP随温度的上升略有变化,温度超过35 ℃时,qP下降速度急剧加快(图 5C),40 ℃时贵州次生种源麻疯树和45 ℃时海南次生种源麻疯树的qP值分别比25 ℃时qP值下降79.86%和67.30%,至50 ℃时,2种植物的qP基本丧失。从图 5C可见,缓慢升温促使次生种源麻疯树热耗散的能力增强,在35和40 ℃贵州的和海南的达到最高值后,NPQ急剧下降。表明过高的温度导致PSⅡ反应中心的失活及PQ库相对水平的迅速降低,并最终使叶片失去耗散过剩激发能的能力。
高温胁迫下,植物光合机构中类囊体膜的组分最易受到热胁迫的伤害,植物叶片的光合速率和光合量子效率下降,发生光抑制现象,严重时甚至会出现由过多活性氧积累引起的氧化伤害现象(Georgieva et al., 1993;Singh et al., 1999)。本文通过次生种源麻疯树叶片乙醇提取物对DPPH·自由基的清除能力来评价热胁迫下2种植物的总抗氧化能力(图 1)。初步显示海南次生种源麻疯树对高温介导的抗氧化作用比贵州的更强。叶绿体类囊膜体结构对热敏感(Weis et al., 1988),因此由热胁迫引起的膜结构改变会反映到Fo中来,Fo是研究植物耐热性的良好生理指标(Schreiber et al., 1978)。初始荧光Fo代表激发的天线叶绿素a分子的转移到反应中心之前的荧光反射,它只依赖于PSⅡ色素中的原初密度以及类囊体膜的结构状态,与光化学过程无关(Krause et al., 1984),中度的热胁迫对膜结构的作用是可逆的,Fo变化不显著。当热胁迫达到一定的阈值时可以引起膜蛋白构象的不可逆破坏,表现为Fo的骤升,与PSⅡ反应中心与核心天线色素在功能上的分离密切相关(Weis et al., 1988)。当热胁迫使类囊体膜上PSⅡ反应中心构象完全破坏时,Fo开始下降。引起Fo骤升的临界温度Ti和引起Fo下降的拐点温度Tp可以评价植物的耐热性。由图 4可知,海南和贵州次生种源麻疯树的Ti分别为52和50 ℃,而2种植物的Tp却无差别,高温处理下海南的有更高的Ti(图 4),表明它有更稳定的光合光系统和较强的耐高温特性,其结果与高温胁迫下膜渗透率变化(图 1)一致。
细胞结构特别是膜结构的稳定性与植物的耐热性有密切的关系(马德华等,1998;张宗申等,2001)。细胞膜的热稳定性反映植物耐热能力的大小(马永战等,1998)。植物对温度逆境的适应主要在于细胞膜系统,特别是质膜和类囊体的特性,温度逆境不可逆伤害的原初反应发生在生物膜系统的类脂分子热致相变上(王洪春,1985)。Martireau等(1979)认为植物在高温逆境下的伤害与脂质透性的增加是高温伤害的本质之一,图 1和图 4结果显示:次生种源麻疯树的细胞膜和光合机构的类囊体膜等膜结构随着温度的上升,伤害程度不断加深,膜渗漏率增大,光合机构类囊体膜的稳定性降低,对植物造成了高温伤害。
总之,海南次生种源麻疯树比贵州有更高的耐高温能力,其可能机理为:一是因为海南次生种源麻疯树在高温胁迫下有较强的抗氧化能力,减少了因过剩激发能积累导致活性氧产生、积累并伤害光合机构;二是因为海南次生种源麻疯树在高温下耗散过剩激发能的能力比贵州麻疯树更强,能够通过提高热耗散的能力来消耗高温胁迫下过多的激发能,从而保护光合机构;三是因为海南次生种源麻疯树在高温下有稳定的光合系统和较强的光合效率。另外,海南次生种源麻疯树的类囊体膜的PSⅡ反应中心构象(图 3)和细胞膜结构的稳定性(图 1)均高于贵州的,这可能是前者具有较强耐受高温逆境的又一重要原因。2种不同次生种源麻疯树对高温的响应特性与其生长的环境密切相关,要考虑其次生种源的差异,因此引种麻疯树时,要注意次生种源的差别,要进一步做次生种源试验.
邓志军, 程红焱, 宋松泉. 2005. 麻疯树种子的研究进展. 云南植物研究, 27(6): 605-612. DOI:10.3969/j.issn.2095-0845.2005.06.002 |
窦新永, 吴国江, 黄红英, 等. 2008. 麻疯树幼苗对干旱胁迫的响应. 应用生态学报, 19(7): 1425-1430. |
郭培国, 李荣华. 2000. 夜间高温胁迫对水稻叶片光合机构的影响. 植物学报, 20(7): 89-94. |
惠红霞, 许兴, 李前荣. 2003. 外源甜菜碱对盐胁迫下枸杞光合功能的改善. 西北植物学报, 23(12): 2137-2142. DOI:10.3321/j.issn:1000-4025.2003.12.015 |
林娟, 周选围, 唐克轩, 等. 2004. 麻疯树植物资源研究概况. 热带亚热带植物学报, 12(3): 285-290. DOI:10.3969/j.issn.1005-3395.2004.03.018 |
罗通, 马丹炜, 邓骛远, 等. 2005. 低温对麻疯树生理指标的影响. 中国油料作物学报, 27(4): 50-54. DOI:10.3321/j.issn:1007-9084.2005.04.012 |
罗通, 邓骛远, 陈放. 2006. 不同产地麻疯树的抗冷性研究. 内蒙古大学学报:自然科学版, 37(4): 446-449. |
马德华, 庞金安. 1998. 温度逆境锻炼对高温下黄瓜幼苗生理的影响. 园艺学报, 25(4): 350-355. DOI:10.3321/j.issn:0513-353X.1998.04.008 |
马永战, 邹琦, 程炳嵩. 1998. 高温锻炼与解冻对小麦叶片细胞膜热稳定性的影响. 山东农业大学学报, 19(2): 55-58. |
彭长连, 陈少薇, 林植芳, 等. 2000. 用清除有机自由基DPPH法评价植物抗氧化能力. 生物化学与生物物理进展, 27(6): 658-661. DOI:10.3321/j.issn:1000-3282.2000.06.022 |
王洪春. 1985. 植物抗性与生物膜结构功能研究进展. 植物生理学通讯, 2: 60-66. |
王利军, 黄卫东. 2000. 高温胁迫及其信号转导. 植物学通报, 17(2): 114-120. DOI:10.3969/j.issn.1674-3466.2000.02.003 |
张明生, 樊卫国, 尹杰, 等. 2005. 麻疯树资源概况及其利用. 贵州农业科学, 33(6): 97-98. DOI:10.3969/j.issn.1001-3601.2005.06.046 |
张守仁. 1999. 叶绿素荧光动力学参数的意义及讨论. 植物学通报, 16(4): 444-448. DOI:10.3969/j.issn.1674-3466.1999.04.021 |
张诗莹, 樊卫国. 2005. 麻疯树的光合特性. 种子, 24(8): 13-15. |
张宗申, 利容千, 王建波. 2001. Ca预处理对热胁迫下辣椒叶肉细胞中Ca-ATP酶活性的影响. 植物生理学报, 27(6): 451-454. DOI:10.3321/j.issn:1671-3877.2001.06.002 |
Bilger W, Fisahn J, Brummet W, et al. 1995. Violaxanthin cycle pigment contents in potato and tobacco plants with genetically reduced photosynthetic capacity. Plant Physiol, 108: 1479-1486. DOI:10.1104/pp.108.4.1479 |
Delian R J, Wallker D A. 1983. Simultaneous measurement of oxygen evolution and chlorophyll fluorescence from leaf pieces. Plant Physiol, 73: 534-541. DOI:10.1104/pp.73.3.534 |
Georgieva K, Yordanov I. 1993. Temperature dependence of chlorophyll fluorescence parameters of pea seedlings. J Plant Physiol, 142: 151-155. DOI:10.1016/S0176-1617(11)80955-7 |
Krall J P, Edward G E. 1992. Relationship between photosystem Ⅱ activity and CO2 fixation in leaves. Physiol Plant, 86: 180-187. DOI:10.1111/ppl.1992.86.issue-1 |
Krause G H, Weis E. 1984. Chlorophyll fluorescence as a tool in plant physiology Ⅱ: interpretation of fluorescence signals. Photosynth Res, 5: 139-157. DOI:10.1007/BF00028527 |
Martineau J R, Specht J E. 1979. Temperature tolerance in soybeans. Crop Sci, 19: 75-81. DOI:10.2135/cropsci1979.0011183X001900010017x |
Muller P, Li X P, Niyogi K K. 2001. Non-photochemical quenching. A response to excess light energy. Plant Physiol, 125(4): 1558-1566. DOI:10.1104/pp.125.4.1558 |
Oren S, Pick U, Acron M. 1990. Plasma membrane potential of the alga Dunaliella and its relation to osmoregulation. Plant Physiol, 93: 403-408. DOI:10.1104/pp.93.2.403 |
Sato N, Aoki M, Maru Y, et al. 2003. Involvement of sulfoquinovosyl diacylglycerol in the structural integrity and heat-tolerance of photosystem Ⅱ. Planta, 217(2): 245-251. |
Schreiber U, Armond P A. 1978. Heat-induced changes of chlorophyll fluorescence in isolated chloroplast and related heat-damage at the pigment level. Biochim Biophys Acta, 502: 138-151. DOI:10.1016/0005-2728(78)90138-X |
Singh A K, Singhal G S. 1999. Specific degradation of D1 protein during exposure of thylakoid membranes to high temperature in dark. Photosynthetica, 36: 433-440. DOI:10.1023/A:1007080204112 |
Weis E, Berry J A. 1988. Plant and high temperature stress. Symp Soc Exp Biol, 42: 329-346. |
 2009, Vol. 45
2009, Vol. 45

