文章信息
- 李潞滨, 李术娜, 李佳, 曾来涛, 胡陶, 朱宝成.
- Li Lubin, Li Shuna, Li Jia, Zeng Laitao, Hu Tao, Zhu Baocheng
- 毛竹枯梢病拮抗细菌分离鉴定及其拮抗物质
- Screening, Identification and Fermentation Conditions Optimization of Antagonistic Strain 6-59 of Bacillus megaterium against Ceratosphaeria phyllostachydis
- 林业科学, 2009, 45(7): 63-69.
- Scientia Silvae Sinicae, 2009, 45(7): 63-69.
-
文章历史
- 收稿日期:2007-12-27
- 修回日期:2009-04-21
-
作者相关文章
2. 河北农业大学生命科学学院 保定 071001
2. College of Life Science, Agricultural University of Hebei Baoding 071001
毛竹(Phyllostachys edulis)是我国南方重要经济林植物之一,竹业现已成为部分竹产区的支柱性产业(林长春,2003).但近年来,随着竹林生态系统的破坏,毛竹枯梢病相继在浙江、安徽、福建、江西、上海等省市成灾,主要危害当年新竹的嫩枝和侧枝,造成枝枯、梢枯或整株枯死,使受害毛竹质量降低,且影响出笋,一般发病3~4年可使成片竹林趋于毁灭,给竹林生产带来严重损失(毛石禧,2007;苏毅,2004).毛竹枯梢病的病原菌竹喙球菌(Ceratosphaeria phyllostachydis),属真菌子囊菌亚门,核菌纲,球壳菌目,喙球菌属.其子囊壳圆形或扁圆形、黑色,数个聚生或单个埋于寄主病部组织内.病原菌毒素主要成分是以6碳糖为基础构成的多糖(林长春,2003;魏初奖,2005;王明旭等,2001).
植物病害的生物防治,因其具有无污染、不易诱导抗药性、防效持久等特点,成为病害控制的重要方法(朱天辉等,2007;Anne,1996;Brooks et al., 1994;Gabriele et al., 2005;Kurt et al., 2005;Mario et al., 2005;Robert et al., 2007;Selim et al., 2005;Stéphane et al., 2005).而目前国内外防治毛竹枯梢病主要还是采用以营林为基础,清除病源为主,辅以药剂防治的综合治理技术措施.毛竹枯梢病的初侵染源主要是老龄病竹上的子实体,故林内前1~3年病竹和病枯枝的存留数是决定当年新竹发病的基本因素,清理病源是防治枯梢病的根本措施.因此,充分利用竹林生态系统本身对病害的调控作用,保护和创造天敌栖居的环境,利用生物防治措施,达到自然控制病害成为了备受人们关注的热点(丁丽萍等,2000;林长春,2003;熊彩云等,2006).而获得高效拮抗细菌和使其作用充分发挥是生物防治的基础(Cheng et al., 2003;Valérie et al., 2005).
本研究经过初筛、复筛,筛选出对竹喙球菌具有较高拮抗活性的菌株6-59,并通过形态观察、生理生化试验和16S rDNA序列分析对其进行了菌株鉴定.对其拮抗物质的性质进行了初步研究.由于生防菌株往往同时产生多种对特定病原菌具有很高活性的抑菌物质,而培养基成分及培养条件是影响拮抗物质形成的重要因素.因此采用单因素试验和正交试验对拮抗细菌6-59菌株摇瓶发酵条件进行了优化.拮抗菌株拮抗物质产量的提高,是对拮抗物质进行性质分析、分离纯化、基因克隆的前提条件;也可为利用该菌株发酵生产高效生物农药打基础.
1 材料与方法 1.1 试验菌株病原菌:竹喙球菌为本实验室保存菌株.
1.2 培养基 1.2.1 分离筛选培养基NA培养基、NB培养基、马铃薯培养基(PDA)见《微生物学实验技术》(程丽娟等,2000).
1.2.2 生理生化鉴定培养基参见《常见细菌系统鉴定手册》(东秀珠等,2001).
1.2.3 16S rDNA序列分析所用培养基LB培养基见《微生物学实验技术》(程丽娟等,2000).
1.2.4 优化发酵条件培养基种子培养基:蛋白胨2%,葡萄糖2%,NaH2PO4·2H2O 0.2%,Na2HPO4·2H2O 0.4%,MgSO4·7H2O 0.05%,H2O 1 000 mL,pH 7.0~7.2.基础发酵培养基:蛋白胨2%,葡萄糖2%,NaH2PO4·2H2O 0.2%,Na2HPO4·2H2O 0.4%,MgSO4·7H2O 0.05%,CaCl2 0.02%,H2O 1 000 mL,pH 7.0~7.2.
1.3 试验试剂 1.3.1 形态及生理生化鉴定试剂见《常见细菌系统鉴定手册》(东秀珠等,2001).
1.3.2 16S rDNA序列分析所用试剂TE缓冲液:Tris-HCl 10 mmol·L-1,EDTA 1 mmol·L-1,pH 8.0.CTAB/NaCl溶液:NaCl 1.4 mmol·L-1,EDTA 20 mmol·L-1,CTAB 2%(W/V),pH 8.0.dNTPs混合液:2.5 mmol·L-1.正向引物27F,反向引物1495R:上海生工生物工程技术服务有限公司合成.纯化试剂盒:购自北京泽星科技.
1.4 试验方法 1.4.1 拮抗细菌的分离取1 g土样置装有9 mL无菌水的试管中,混匀后于80 ℃水浴加热20 min,取1 mL进行梯度稀释,得到系列浓度的稀释液.分别取10-4,10-5 mol·L-1 2个稀释梯度的稀释液涂布NA培养基平板,倒置于30 ℃培养箱中培养24 h.挑取不同形态的单菌落转接至NA培养基斜面,30 ℃恒温培养24 h,置于-4 ℃冰箱保存备用.所挑取的菌落同时在NA培养基平板上划线检查纯度.
1.4.2 竹喙球菌平板的制作用竹签刮取培养10天的竹喙球菌斜面上的孢子,制成悬液,取5 mL悬液倒入融化后冷却到55 ℃左右的100 mL PDA培养基中,摇匀,制成平板.
1.4.3 拮抗细菌的初筛和复筛将分离得到的单菌落分别转接在含竹喙球菌的PDA平板上,与竹喙球菌进行生长对峙试验,筛选产生抑菌圈的拮抗菌株.将初筛得到的拮抗细菌以NA培养基活化后接种于NB培养基中,37 ℃,180 r·min-1摇床培养48 h.按上述方法制备含竹喙球菌的平板,在平板上选择合适的间距打孔,取用0.2 μm微孔滤膜过滤除菌的拮抗细菌的发酵液75 μL加入孔中,28 ℃培养48 h,测量抑菌圈直径.
1.4.4 拮抗细菌6-59的形态鉴定将活化后的菌株6-59划线接种于NA平板上,37 ℃培养24 h,观察菌落形态.挑取NA斜面上37 ℃培养24 h的菌株6-59进行革兰氏染色及芽孢染色(东秀珠等,2001),在光学显微镜下观察其菌体及芽孢形态,选取常见标准细菌菌株枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(B. licheniformis)、解淀粉芽孢杆菌(B.amyloliquefaciens)、花域芽孢杆菌(B. vallismortis)、巨大芽孢杆菌(B. megaterium)、漠海威芽孢杆菌(B. mojaveis)等作为对照.
1.4.5 拮抗细菌6-59的生理生化鉴定主要根据《常见细菌系统鉴定手册》(东秀珠等,2001)中相应属、种鉴定有关的内容进行.共进行乙酰甲基甲醇试验、酪素水解和硝酸盐还原等20项试验.同时选取上述常见标准细菌菌株作为对照.
1.4.6 基因组DNA的提取及16S rDNA的扩增纯化取菌株6-59对数生长期发酵液,基因组总DNA的提取采用CTAB法(Frederick et al., 1995),并稍作改进.以琼脂糖凝胶电泳检测DNA质量.
PCR反应体系:DNA模板2 μL,10×Taq Buffer(含Mg2+) 5 μL,dNTP 3.5 μL,27F 1.5 μL,1495R 1.5 μL,Taq DNA聚合酶0.5 μL,ddH2O 36 μL.PCR条件为:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火40 s,72 ℃延伸90 s,共32个循环;最后72 ℃延伸10 min.PCR产物经试剂盒纯化后,由上海生工生物工程技术服务有限公司测序.
1.4.7 16S rDNA序列分析及系统发育树的构建利用BLAST将供试菌株6-59的16S rDNA序列在GenBank中进行比较,并构建系统发育树.序列比对采用CLUSTAL X program,进化距离的计算利用PHYLIP program package中的DANDIST program,进化树的构建利用PHYLIP program package中的Neighbor-joing进行,分支模式的重复性利用PHYLIP中的seqboot和consense分析,重复1 000次(Cui et al., 2001).
1.4.8 菌株拮抗物质的性质研究菌株发酵液于4 ℃,6 000 r·min-1,离心3 min除去菌体,上清分别用氯仿、乙醚、乙酸乙酯等体积(10 mL·10 mL-1)萃取,每种溶剂萃取3次并合并萃取液,在室温下自然挥发到3 mL,每种提取物做3个重复,按1.4.3中复筛方法测定有机相的抑菌活性,以未处理的发酵液为对照.25 ℃培养2~3天后观察抑菌结果,测量抑菌圈直径.菌株发酵液除菌体后向上清液中加入硫酸铵,使其饱和度达到80%,4 ℃静置2 h,11 000 r·min-1,离心20 min,沉淀用0.01 mol·L-1 Tris-HCl溶液溶解后透析除盐.冷冻干燥后,配制成50 μg·mL-1的溶液测定抑菌活性.
1.4.9 发酵条件的优化种子培养将斜面培养的拮抗菌株6-59接种于装有种子培养基的三角瓶中.于200 r·min-1,30 ℃,摇床培养18 h后使用,摇瓶容量为250 mL,装液量为100 mL.发酵培养根据试验需要配制发酵培养基置于250 mL三角瓶中,装液量为50 mL,单因素改变碳源、氮源、无机盐等条件.将培养好的液体菌种按6%的接种量接种发酵培养基,设3个重复.于200 r·min-1,30 ℃,摇床培养48 h.测定抑菌圈直径,抑菌圈直径的数值表示为:均数x±标准差SD.
正交试验 综合各单因素试验结果,选择最适碳源、氮源、无机盐进行正交试验,具体培养基配方如表 6所示.设计5因素4水平的正交试验确定种龄、初始pH、发酵时间、接种量、装液量等发酵工艺条件.以上每项均设3个重复.
|
|
抑菌圈直径的数值表示为:均数x±标准差SD.
2 结果与分析 2.1 拮抗细菌的筛选共分离筛选到具拮抗作用的菌株78株,选其中拮抗性能较好的68株菌株复筛,得到10株抑菌圈直径大于15 mm的菌株,其中菌株6-59抑菌圈直径达21.3 mm,能有效抑制竹喙球菌的生长.
2.2 拮抗菌株的鉴定 2.2.1 菌落特征观察NA培养基上生长的菌株6-59的菌落形态,培养24 h的菌落呈近圆形,微黄色,边缘不整齐,不透明,表面有皱褶,中间突起.
2.2.2 菌体形态特征菌株6-59经染色后置于显微镜下观察,菌体成线状排列,单个菌体呈杆状,革兰氏染色呈阳性,菌体长约2.5 μm,宽约0.9 μm,芽孢呈椭圆形中生,稍膨大,长约1.9 μm,宽约1.0 μm.
2.2.3 生理生化试验试验结果见表 1.对照东秀珠等(2001)中相应属、种鉴定有关内容,初步判定菌株6-59属于芽孢杆菌属(Bacillus).
|
|
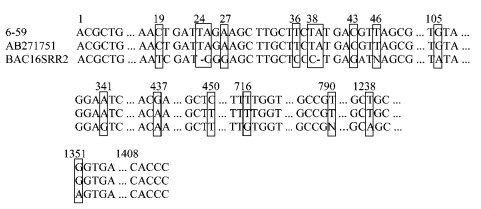
提取菌株6-59的基因组DNA进行了16S rDNA序列扩增并对扩增产物进行纯化,最终测得16S rDNA序列.采用PHYLIP program package软件处理菌株6-59的16S rDNA序列与GenBank中原核生物的16S rDNA序列比对所得的数据,得到菌株6-59及相关菌株的进化距离并构建了系统发育树.菌株6-59及与之同源性最高的2株标准菌株的原序列见图 1,构建的系统发育树见图 2,构建系统发育树所用相关标准菌株的菌种号及其16S rDNA序列的登录号以及菌株6-59与参比菌株的16S rDNA序列相似性见表 2.
|
图 1 拮抗细菌6-59菌株与2株标准菌株的16S rDNA原序列比对 Figure 1 16S rDNA sequences alignment of antagonistic strain 6-59 and two related type strains |

|
图 2 依据16S rDNA序列构建的拮抗细菌6-59菌株及相关菌株的系统发育树 Figure 2 Neighbour-joing tree based on 16S rDNA sequences showing relationship between antagonistic strain 6-59 and related strains |
|
|
根据以上试验结果,将供试菌株6-59的16S rDNA序列与GenBank中原核生物比对,得到的与供试菌株6-59 16S rDNA序列相似性最高的9株标准菌株均为芽孢杆菌,且与供试菌株6-59 16S rDNA序列相似性大都在95%以上,因此菌株6-59应属于芽胞杆菌属.
此外,由表 2可看出,供试菌株6-59与巨大芽孢杆菌的标准菌株NBRC 15308 16S rDNA序列的同源相似性达99.86%,是GenBank所有标准菌株中与供试菌株6-59 16S rDNA序列的同源性最高的,结合该供试菌株形态特征及生理生化特性,鉴定此菌株为巨大芽孢杆菌.
2.3 拮抗物质性质研究经测定,6-59菌株的去菌体发酵液经氯仿、乙醚、乙酸乙酯3种有机溶剂提取后,均未产生抑菌圈,而对照发酵液产生抑菌圈,发酵液的硫酸铵盐析物则产生更大抑菌圈.初步表明此拮抗菌株所产生的拮抗物质为蛋白类物质.
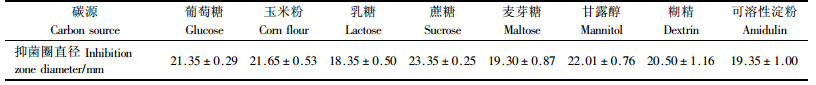
2.4 拮抗细菌6-59菌株发酵条件的优化 2.4.1 最适碳源的确定在发酵培养基中分别加入2%的不同碳源,进行发酵,由表 3可知,蔗糖为最佳碳源.
|
|
以2%蔗糖为碳源,在发酵培养基中分别加入2%的不同氮源,进行发酵,结果见表 4.由表 4可知,该菌株对有机氮源的利用普遍好于无机氮源,其中以蛋白胨效果最佳.
|
|
在发酵培养基中分别添加不同种类的无机盐,添加量为0.05%,考察无机离子对发酵的影响(表 5).Mg2+,K+对活性物质的产生最有利,所以发酵液中选择添加Mg2+,K+.
|
|
综合以上各单因素试验结果,选择蔗糖、蛋白胨、MgSO4·7H2O,KCl设计4个因素3水平的正交试验,结果见表 6.
依据正交试验直观分析结果,极差值RA>RB>RC>RD,因此,蔗糖为主要影响因素,KCl影响最小.由表 6可见,6号试验组合(A2B3C1D2)抑菌圈最大.因此,确定该菌株的最佳培养基组成为:蔗糖2%、蛋白胨3%、MgSO4·7H2O 0.03%、KCl 0.02%.
2.4.5 正交试验优化发酵工艺条件采用5因素4水平的正交试验确定种龄、初始pH、发酵时间、接种量、装液量.结果见表 7.
|
|
由于极差值RpH>R发酵时间=R装瓶量>R接种量>R种龄,所以pH是主要影响因素,种龄的影响最小.确定最佳条件为种龄18 h,发酵液初始pH值为7.0,装瓶量为250 mL三角瓶装50 mL,发酵时间72 h,接种量为4%.
综合单因素试验及正交试验优化结果,确定供试菌株6-59的最佳条件是:蔗糖2%、蛋白胨3%、MgSO4·7H2O 0.03%、KCl 0.02%、种龄18 h、发酵液初始pH值为7.0、装瓶量为250 mL三角瓶装50 mL、发酵时间72 h、接种量为4%.在此条件下培养的菌株6-59发酵液,滤除菌后以含竹喙球菌的平板检测其抑菌活性,抑菌圈直径可达25.8 mm左右.
3 讨论近年来,有研究者参照国际上有害生物风险性分析(PestRiskAnalysis,简称PRA)方法,对毛竹枯梢病病原菌竹喙球菌的风险性作了综合评价.结果表明:竹喙球菌是接近于高度危险的林业有害生物,对我国竹林资源与竹业发展具有潜在的严重威胁,应加强风险性管理力度(魏初奖,2005).
利用生物防治措施控制该病害是目前最具潜力的方法之一,其基础是获得高效拮抗菌株.芽孢杆菌由于抗逆性强、抗菌谱广泛,被认为是理想的植物病害生防细菌来源之一.目前,生防研究所涉及的芽孢杆菌种类主要集中在枯草芽孢杆菌、多粘芽孢杆菌(B. polymyxa)、短小芽孢杆菌(B. pumilus)、解淀粉芽孢杆菌(B. amyloliquefaciens)、蜡状芽孢杆菌(B. cereus)和地衣芽孢杆菌等几个种.近年来,关于巨大芽孢杆菌在生防方面的研究报道越来越受到重视,羊宋贞等(2007)曾发现1株对番茄青枯病有一定抑制效果的巨大芽孢杆菌,另外,马镝等(2007)也发现巨大芽孢杆菌对瓜果腐霉菌(Pythium aphanidermatum)、烟草赤星病菌(Alternaria alternata)、黄瓜菌核病菌(Sclerotinia sclerotiorum)等17种植物病原真菌具有不同程度的抑制效果.但是,对于巨大芽孢杆菌用于毛竹枯梢病的防治研究未见报道.拮抗细菌6-59菌株是本试验筛选得到的对毛竹枯梢病具有较高拮抗活性的优良菌株,为1株巨大芽孢杆菌,有较强的抗逆能力,具有作为生防菌株的较大潜力.
在对供试菌株总DNA进行提取时,有报道采用收集菌体煮沸离心的方法(Altschu et al., 1997);此法所得模版DNA杂质较多,可能影响后续操作.本研究在6-59的DNA提取过程中采用有机溶剂抽提将样品中的蛋白及其他杂质去除,得到的样品DNA含蛋白及多糖等杂质较少,保证了后续试验效果.
优化得到的供试菌株6-59的培养基成分是工业生产中较常用的原料,培养条件在工业生产中也较易达到;因此,为潜在的应用于商品化,投入工业生产打下基础.
程丽娟, 薛泉宏, 来航线, 等. 2000. 微生物学实验技术. 西安: 世界图书出版公司.
|
丁丽萍, 王丽文, 陆登广. 2000. 福建省毛竹病虫害发生及综合防治对策. 江苏林业科技, 27(2): 62-65. |
东秀珠, 蔡妙英. 2001. 常见细菌系统鉴定手册. 北京: 科学出版社, 349-388.
|
林长春. 2003. 毛竹枯梢病的研究进展. 竹子研究汇刊, 22(2): 25-29. DOI:10.3969/j.issn.1000-6567.2003.02.005 |
马镝, 赵秀香, 吴元华, 等. 2007. 土壤中产壳聚糖酶菌株的筛选、鉴定及抑菌活性研究. 沈阳农业大学学报, 38(6): 811-815. DOI:10.3969/j.issn.1000-1700.2007.06.010 |
毛石禧. 2007. 毛竹轻度枯梢病防治效果研究. 竹藤保护, 5(1): 43-45. |
苏毅. 2004. 毛竹枯梢病防治. 安徽林业, (3): 34-36. |
王明旭, 叶茂, 罗宽, 等. 2001. 毛竹枯梢病病原菌毒素的生物测定及成分研究. 湖南环境生物职业技术学院学报, 7(1): 28-32. DOI:10.3969/j.issn.1671-6361.2001.01.006 |
魏初奖. 2005. 毛竹枯梢病病原菌竹喙球菌风险性分析. 南京林业大学学报:自然科学版, 29(2): 38-42. |
熊彩云, 刘东明, 黎美莲. 2006. 江西毛竹林主要病虫害的综合防治策略. 世界竹藤通讯, 4(4): 40-42. DOI:10.3969/j.issn.1672-0431.2006.04.013 |
羊宋贞, 姚青, 孙晓棠, 等. 2007. 一株番茄青枯菌拮抗菌的鉴定及抗病效果初探. 微生物学通报, 34(5): 859-862. DOI:10.3969/j.issn.0253-2654.2007.05.008 |
朱天辉, 刘富平. 2007. 坚强芽孢杆菌对3种病原真菌的抗生现象. 林业科学, 43(2): 120-123. |
Altschul S F, Madden T L, Schaffer, et al. 1997. Gapped BLAST and PSI-BLAST : a new generation of protein database search programs. Nucleic Acids Res, 25: 3389-3402. DOI:10.1093/nar/25.17.3389 |
Anne E O. 1996. Performed antimicrobial compounds and plant defense against fungal attack. The Plant Cell, 8: 1821-1831. DOI:10.1105/tpc.8.10.1821 |
Brooks D S, Gonzalez C F, Appel D N, et al. 1994. Evaluation of endophytic bacteria as potential biological-control agents for oak wilt. Biological Control, 4(4): 373-381. DOI:10.1006/bcon.1994.1047 |
Cheng Y L, David J M, Caroline L, et al. 2003. Insertional mutagenesis of a fungal biocontrol agent led to discovery of a rare cellobiose lipid with antifungal activity. Applied and Environmental Microbiology, 69(5): 2595-2602. DOI:10.1128/AEM.69.5.2595-2602.2003 |
Cui X L, Mao P H, Zeng M, et al. 2001. Streptomonospora salina gen. nov., sp. nov., a new member of the family Nocardiopsaceae. Int J Syst Evol Microbiol, 51: 357-363. DOI:10.1099/00207713-51-2-357 |
Frederick M A, Roger B, Robert E K, et al. 1995. Short Protocols in Molecula r Biology. New York: John Wiley & Sons, Inc.
|
Gabriele B, Christin Z, Jana L, et al. 2005. Impact of plant species and site on rhizosphere-associated fungi antagonistic to Verticillium dahliae Kleb. Applied and Environmental Microbiology, 71(8): 4203-4213. DOI:10.1128/AEM.71.8.4203-4213.2005 |
Kurt B, Susanne Z, Rosalia C, et al. 2005. Improvement of the fungal biocontrol agent Trichoderma atroviride to enhance both antagonism and induction of plant systemic disease resistance. Applied and Environmental Microbiology, 71(7): 3959-3965. DOI:10.1128/AEM.71.7.3959-3965.2005 |
Mario O, Javier F, Jaime M O, et al. 2005. Evaluation of beneficial microorganisms for controlling the wilt caused by Fusarium oxysporum f. sp. melonis on cantaloupe olants under greenhouse. Conditions, 40: 993-1147. |
Robert W B, Eloise K. 2007. Fungal pathogens of Miconia calvescens (Melastom ataceae) from Brazil, with reference to classical biological control. Mycologia, 99(1): 99-111. DOI:10.1080/15572536.2007.11832605 |
Selim S, Negrel J, Govaerts C, et al. 2005. Isolation and partial characterization of antagonistic peptides produced by Paenibacillus sp. strain B2 isolated from the sorghum mycorrhizosphere. Applied and Environmental Microbiology, 71(11): 6501-6507. DOI:10.1128/AEM.71.11.6501-6507.2005 |
Stéphane C, Brion D, Jerzy N, et al. 2005. Use of plant growth-promoting bacteria for biocontrol of plant diseases: principles, mechanisms of action, and future prospects. Applied and Environmental Microbiology, 71(9): 4951-4959. DOI:10.1128/AEM.71.9.4951-4959.2005 |
Valérie L, Max B, Akram A, et al. 2005. Mycosubtilin overproduction by Bacillus subtilis BBG100 enhances the organism's antagonistic and biocontrol activities. Applied and Environmental Microbiology, 71(8): 4577-4584. DOI:10.1128/AEM.71.8.4577-4584.2005 |
 2009, Vol. 45
2009, Vol. 45