文章信息
- 周肖红, 葛雨萱, 王亮生, 甘长青.
- Zhou Xiaohong, Ge Yuxuan, Wang Liangsheng, Gan Changqing
- 黄栌叶片变色期生理变化及植物生长调节剂对叶色的影响
- Physiological Changes during Leaf Color Change in Cotinus coggygria and Effects of Growth Regulators
- 林业科学, 2009, 45(7): 59-62.
- Scientia Silvae Sinicae, 2009, 45(7): 59-62.
-
文章历史
- 收稿日期:2008-06-20
-
作者相关文章
2. 中国科学院植物研究所北京植物园 北京 100093;
3. 中国科学院研究生院 北京 100049
2. Beijing Botanical Garden, Institute of Botany, Chinese Academy of Sciences Beijing 100093;
3. Graduate University of Chinese Academy of Sciences Beijing 100049
黄栌(Cotinus coggygria),漆树科黄栌属落叶灌木或小乔木,在北京山区有广泛的分布,其叶片到秋季由绿转红,是著名风景区香山公园的主要观赏树种之一.
目前国内外关于黄栌叶色方面的报道较少,于晓南(2000)对不同位置香山红叶的花青素相对含量变化进行了研究,郝峰鸽等(2007)测定了5月份黄栌叶中各色素含量的变化,但对黄栌叶在变色过程中主要色素的动态变化及其他影响叶色的因素并没有报道.Tanchev等(1969)调查了黄栌紫色叶中的花青素组成,实际上黄栌群体的秋叶色彩存在明显差异,因此,不同叶色黄栌色素组成的差异需进一步研究.
要改变自然条件下生长的黄栌叶色及变色期,难以通过改变温度、光照或者紫外线照射量等因素来实现,所以,有必要进一步研究其他的理化因素对叶色的影响,而生长调节剂在改善苹果(Malus) (Li et al., 2002;Whale et al., 2008),荔枝(Litchi chinensis)(Wang et al., 2007),兔眼蓝莓(Semen trigonellae)(Ban et al., 2007)等果皮颜色方面应用较为成熟,但在黄栌等观叶植物上应用还很少.本研究通过对典型叶色差异的黄栌进行花青素相对含量、可溶性糖含量和pH值变化的动态分析,在掌握其变色规律的基础上,应用植物生长调节剂改善黄栌叶色,寻找能够改善观赏期红叶颜色的最适调节剂及其浓度,探索人工调控叶色的方法.
1 材料与方法 1.1 叶色差异及生理指标分析经多年观察,香山公园黄栌叶片主要呈“黄”、“橙红”、“紫红”和“红”4种叶色类型,每个类型各选取叶色稳定的样树1株进行试验,2000年10月13日到10月31日,每5天采样1次,采集高约2 m处枝条上部成熟叶片,4次重复,分别放入自封袋中,用冰壶冷藏,迅速带回实验室进行测量.
花青素相对含量的测量参照张志良(1990)方法.将新鲜叶剪成碎块,称取1 g,加入10 mL 0.1 mol·L-1盐酸,封口后于32 ℃提取4 h,过滤后取上清液,用国产754型紫外分光光度计测定530 nm处的吸光度值(OD).以每克鲜质量叶在10 mL提取液中OD值为0.1时的花青素浓度记为1个色素单位.所测得的OD值除以0.1即代表花青素相对含量(色素单位).
叶绿素a、b的含量测定采用Arnon(1949)的方法.新鲜叶剪成碎块,称取0.5 g,加入10 mL 80%丙酮及碳酸钙和石英砂充分研磨,转入50 mL容量瓶定容后过滤得到上清液.用国产754型紫外分光光度计测定663,645 nm处的吸光度值(OD).参考Arnon(1949)公式计算得到叶绿素a、叶绿素b及总叶绿素的浓度(mg·L-1).求得各浓度后,分别计算出叶片中单位鲜质量中的各色素含量(mg·g-1).
可溶性糖含量的测定参照韩德元(1997)蒽酮比色法.
酸碱度测定,取叶数片,用直径12 mm的打孔器在每片叶上打3个小圆片,共取15个圆片,放入试管中,加10 mL去离子水,真空泵抽真空2 h后,用F-20A型酸度计测定pH值.
利用SPSS 11.5软件进行单因素方差分析.
1.2 叶色改善试验选取树龄3年、叶色一致且长势良好的样树60株供本试验用.使用40%乙烯利、国光催红素(购于四川国光农化有限公司)、脱落酸、赤霉素和萘乙酸等5类生长调节剂,其施用浓度分别如下:乙烯利浓度为1 000,667和500 mg·L-1,即40%乙烯利水溶液用蒸馏水稀释400,600和800倍,相应浓度以下简称为Y-4,Y-6和Y-8.国光催红素浓度为2 500,1 250和833 mg·L-1,即每5 g粉剂加蒸馏水2,4和6 L,相应浓度以下简称为C-2,C-4和C-6.脱落酸、赤霉素浓度均为500,250和125 mg·L-1.萘乙酸浓度为40和60 mg·L-1.另设1个空白对照组,共15个处理,每处理4次重复.
1998和1999年采用手提喷雾器喷施,2001年为提高试验准确性采用毛笔涂抹叶片正反面的方法进行施药.3次试验处理时间均为每年的9月25日16:00—18:00,处理后3天内无降雨出现.10月5日起开始采样,前期每8天采样1次,至10月21日叶片变色关键期,后在10月24日和31日各采样1次.采集高约2 m处的枝条,取其上、中、下3部分的成熟叶片,混匀后放入自封袋中,用冰壶冷藏,迅速带回实验室测量花青素相对含量和叶绿素a、b的含量,1998和1999年采用国产754型紫外分光光度计,2001年采用UV-9100型紫外分光光度计,测定和分析方法同1.1.
2 结果与分析 2.1 不同叶色黄栌花青素相对含量的比较从图 1可以看出,在2000年秋随着时间的推移,不同叶色类型黄栌的花青素相对含量变化基本相同,均呈现先上升再下降的趋势,到10月24日达最高峰,“紫红”类型的花青素相对含量最高达306.55个色素单位,“橙红”和“红”2类型的花青素相对含量接近,而“黄”类型花青素相对含量低且变化幅度较小,最高时仅42.25个色素单位.花青素相对含量与叶色表现相吻合:在变色期,“紫红”的叶色在各类型中最红,而“黄”明显区别于其他红色叶.

|
图 1 2000年不同叶色黄栌花青素相对含量的变化 Figure 1 The changes of anthocyanin relative content in C. coggygria with different leaf colors in 2000 |
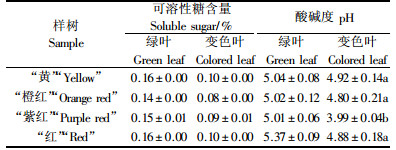
如表 1所示,不同叶色黄栌之间可溶性糖含量不存在显著差异(P>0.05),且在叶色由绿转红过程中呈下降趋势,下降幅度相近.变色期“紫红”的pH值最低,仅3.99,“黄”的pH值最高,达4.92.经ANOVA分析SNK检验,“紫红”与其他类型间的pH值存在显著差异(P<0.05).另外,同株树上变色叶片的pH值明显低于绿色叶片.
|
|
1998年,进行乙烯利、国光催红素、脱落酸、赤霉素和萘乙酸5种生长调节剂处理后,通过测定花青素相对含量并参考落叶时间早晚,结果表明:乙烯利和国光催红素促使叶色转红的效果较好,花青素相对含量分别为13.68,7.41个色素单位,而对照仅为5.27个色素单位.赤霉素和萘乙酸未能有效提高黄栌叶片中的花青素相对含量,且导致施药后的黄栌过早落叶,效果不好.脱落酸对提高花青素相对含量的效果不明显,而且价格昂贵,不适宜大面积使用.
1999年,同时进行不同浓度的乙烯利(Y-6,Y-8)、催红素(C-2,C-4和C-6)处理.结果如下:施用Y-8和C-2后黄栌叶片花青素相对含量明显提高,幅度均超过15.00个色素单位.乙烯利和国光催红素能有效地提高黄栌叶片中花青素的含量,但效果与药品的施用浓度有密切关系,初步试验表明:乙烯利低浓度效果好(Y-8),而国光催红素高浓度效果好(C-2).
2001年,为确定国光催红素和乙烯利的最适浓度并验证其稳定性,进行Y-6,Y-8,C-2和C-6 4个处理.施用Y-8后叶片中的花青素相对含量最高,达230.90个色素单位,并且在红叶观赏期10月15—25日间大量合成花青素,10月25日后花青素相对含量开始下降,但分解速度较慢,叶片中的花青素相对含量仍高于对照.施用Y-6后虽然能大幅度提高叶片中的花青素相对含量,最高达215.65个色素单位,但随后的分解速度很快,并且落叶较早,不利于红叶观赏期的延长(图 2).国光催红素在1999年中C-2能较大幅度提高叶片中的花青素相对含量,但在2001年的试验中提高幅度不大,施用C-6后花青素相对含量甚至低于对照叶片,其效果不稳定.

|
图 2 2001年生长调节剂对黄栌叶片花青素相对含量的影响 Figure 2 The effects of growth regulators on anthocyanin relative content in the leaves of C. coggygria in 2001 |
综合3年试验结果,以低浓度的乙烯利(Y-8)处理效果最佳,黄栌叶片成色好且红叶期长.
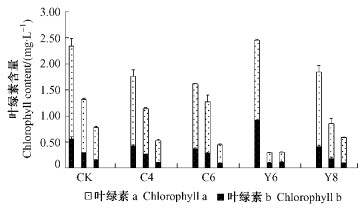
2.4 植物生长调节剂对叶绿素含量的影响施用乙烯利和国光催红素后,叶片中的叶绿素含量下降速度加快,其中乙烯利Y-6处理后下降最快(图 3),叶绿素含量迅速下降,使叶色迅速变红,但叶片过早脱落,红叶观赏期缩短.施用Y-8后叶绿素含量下降相对缓慢,有利于观赏期延长.国光催红素对叶绿素的降解作用缓慢.
|
图 3 2001年生长调节剂对黄栌叶片叶绿素含量的影响(10月5日,13日,21日) Figure 3 The effect of growth regulators on chlorophyll content in the leaves of C. coggygria in 2001(5th, 13th, 21th Oct.) |
叶绿素的下降,花青素的积累,使黄栌叶片由绿色转为红或黄色.变色期不同叶色类型黄栌的花青素相对含量不同,“深红”叶片远远高于“黄”的叶片(6倍以上),这表明花青素的含量是黄栌叶片呈现深浅不一红色的主要原因.pH值也是影响花青素颜色表现的因子之一,花青素在酸性条件下呈现红色(Yoshida et al., 2003).不同叶色黄栌的pH值存在明显差异,红色较深叶片的pH值明显低于黄色及绿色叶片,花青素相对含量与pH值呈负相关性,花青素相对含量越高,pH越低,叶色越红.
一般来说细胞中花青素的生物合成与糖类的含量密切相关,糖类是花青素生物合成的信号分子、能源物质和前体物质(Solfanelli et al., 2006),不过也有人认为花青素积累与糖含量无关(Saure,1990).套袋、摘叶或修剪虽使苹果含糖量降低,但仍能明显促进果实着色,说明糖分只在一定范围内限制着色,其含量越过一定阈值后则不会成为限制因素(Saure,1990).黄栌叶片由绿变红过程中可溶性糖含量下降,这与唐前瑞等(2006)对红檵木(Loropetalum chinense var. rubrum)叶色研究的结果一致.此外,Noro等(1988)发现红色品种和黄色品种的苹果成熟期间果皮糖含量无显著性差异,本研究发现在变色期不同叶色黄栌之间可溶性糖含量也不存在显著差异.
乙烯利可以触发并增强花青素合成(Awad et al., 2002),与其他几种植物生长调节剂及其浓度相比,500 mg·L-1的乙烯利(Y-8)可以有效地改善黄栌在观赏期间的叶色,并且不会缩短红叶观赏期.在连续3次试验中均能有效地提高叶片中花青素的相对含量,效果很稳定(表 1,图 2,3),而且没有促使植株后期叶绿素的大量分解.乙烯利对叶色改善效果明显,这与其在苹果(Li et al., 2002;Whale et al., 2008),荔枝(Wang et al., 2007),兔眼蓝莓(Ban et al., 2007)等果色改善效果一致.本试验表明乙烯利是迄今黄栌叶色的最佳调节剂,但因其能加速植物衰老(Whale et al., 2008),施用浓度高会造成黄栌过早落叶,因此建议生产上使用浓度应不高于500 mg·L-1.
韩德元. 1997. 植物生长调节剂—原理与应用. 北京: 北京科学技术出版社.
|
郝峰鸽, 李保印, 杨立峰, 等. 2007. 几种彩叶植物生长期色素含量研究. 华北农学报, 2(1): 161-163. DOI:10.3321/j.issn:1000-7091.2007.01.038 |
贺士元, 邢其华, 尹祖棠, 等. 1993. 北京植物志. 2版. 北京: 北京出版社.
|
庞海慧, 张涛, 肖建忠, 等. 2007. 红叶黄红色素的提取方法及稳定性研究. 河北农业大学学报, 30(3): 94-96. DOI:10.3969/j.issn.1000-1573.2007.03.023 |
唐前瑞, 陈德富, 陈友云, 等. 2006. 红檵木叶色变化的生理生化研究. 林业科学, 42(2): 111-115. |
于晓南. 2000. 植物叶片中花青素的分析与研究. 现代仪器, (4): 37-38. DOI:10.3969/j.issn.1672-7916.2000.04.012 |
张志良. 1990. 植物生理学实验指导. 北京: 高等教育出版社.
|
Arnon D I. 1949. Copper enzymes in isolated chloroplasts polyphenoloxidase in Beta vulgaris. Plant Physiology, 24(1): 1-15. DOI:10.1104/pp.24.1.1 |
Awad M A, Jager A D. 2002. Formation of flavonoids, especially anthocyanin and chlorogenic acid in 'Jonagold' apple skin: influences of growth regulators and fruit maturity. Scientia Horticulturae, 93(3/4): 257-266. |
Ban T, Kugishima M, Ogata T, et al. 2007. Effect of ethephon (2-chloroethylphosphonic acid) on the fruit ripening characters of rabbiteye blueberry. Scientia Horticul turae, 112: 278-281. DOI:10.1016/j.scienta.2006.12.027 |
Li Z H, Gemma H, Iwahori S. 2002. Stimulation of 'Fuji' apple skin color by ethephon and phosphorus-calcium mixed compounds in relation to flavonoid synthesis. Scientia Horticulturae, 94: 193-199. DOI:10.1016/S0304-4238(01)00363-6 |
Noro S, Kudo N, Kitsuwa T. 1988. Differences in sugars and organic acids between red and yellow apple cultivars at time of coloring, and effect of citramalic acid on development of anthocyanin. Journal of the Japanese Society for Horticultural Science, 57(3): 381-389. DOI:10.2503/jjshs.57.381 |
Saure M C. 1990. External control of anthocyanin formation in apple. Scientia Horticulturae, 42(3): 181-218. DOI:10.1016/0304-4238(90)90082-P |
Solfanelli C, Poggi A, Loreti E, et al. 2006. Sucrose-specific induction of the anthocyanin biosynthetic pathway in Arabidopsis. Plant Physiology, 140: 637-646. DOI:10.1104/pp.105.072579 |
Tanchev S S, Timberlake C F. 1969. Anthocyanins in leaves of Cotinus coggygria. Phytochemistry, 8: 2367-2369. DOI:10.1016/S0031-9422(00)88156-X |
Whale S K, Singh Z, Behboudian M H, et al. 2008. Fruit quality in 'Cripp′s Pink' apple, especially colour, as affected by preharvest sprays of aminoethoxyvinylglycine and ethephon. Scientia Horticulturae, 115: 342-351. DOI:10.1016/j.scienta.2007.10.015 |
Wang H C, Huang H B, Huang X M. 2007. Differential effects of abscisic acid and ethylene on the fruit maturation of Litchi chinensis Sonn. Plant Growth Regulation, 52: 189-198. DOI:10.1007/s10725-007-9189-8 |
Yoshida K, Toyama-Kato Y, Kameda K, et al. 2003. Sepal color variation of hydrangea macrophylla and vacuolar pH measured with a proton-selective microelectrode. Plant Cell Physiology, 44(3): 262-268. DOI:10.1093/pcp/pcg033 |
 2009, Vol. 45
2009, Vol. 45