文章信息
- 李义良, 苏晓华, 张冰玉, 黄秦军, 张香华.
- Li Yiliang, Su Xiaohua, Zhang Bingyu, Huang Qinjun, Zhang Xianghua
- 转vgb基因银腺杂种杨的耐涝性
- Waterlogging Tolerance of vgb-Transgenic Poplar
- 林业科学, 2009, 45(7): 26-31.
- Scientia Silvae Sinicae, 2009, 45(7): 26-31.
-
文章历史
- 收稿日期:2008-05-21
-
作者相关文章
2. 广东省林业科学研究院 广州 510520
2. Guangdong Forest Research Institute Guangzhou 510520
银腺杂种杨(Populus alba × P. glandulosa)1984年引入我国,目前在华北、西北地区均有广泛栽培.白杨派杨树品种的推广繁育区域主要在华北、西北、东北等地,南方栽培品种主要以黑杨为主.杨树耐涝性较差,南方常常由于大量降雨造成长时间积水,给杨树生产造成了巨大损失.目前通过基因工程改良植物耐涝性已有报道,如Mao等(2003)获得了耐涝转基因矮牵牛(Petunia hybrida),而杨树耐涝性研究较为薄弱,国内还未见报道.开展杨树耐涝性研究对于杨树在我国南方广大地区经济建设和水土保持中发挥更大作用具有重要意义.
氧是呼吸代谢必需的底物,它能够迅速通过细胞膜到达所有的细胞器,在植物一级代谢和次级代谢的许多生化反应中作为底物或辅助因子,据报道提高植物细胞中氧含量可促进植物的生长,而加速这些依氧过程的一个显著方法是增加植物中的氧浓度(张静娴等,1999).透明颤菌血红蛋白(vitreoscilla haemoglobin,VHb)是研究比较成熟的能够增加供氧的蛋白.VHb发现于20世纪70年代(Tyree et al., 1978),这种蛋白具有专性好氧特性,与真核生物的血红蛋白具有很高的同源性(Wakabayashi et al., 1986).VHb与氧结合力强,能降低透明颤菌的需氧量,在缺氧条件下能大量合成(Dikshit et al., 1990),是一种氧调节、氧结合的蛋白.它有氧化态、还原态和氧合态3种状态.它的血红素铁原子保持亚铁状态时,能与氧可逆结合,其氧复合物很稳定.实验表明,VHb在有氧呼吸时以生理活性的氧结合形式存在于细胞质和外周胞质空间(Khosla et al., 1989),同时也能促进缺乏末端氧化酶的大肠杆菌的需氧生长(Dikshit et al., 1992).1988年成功克隆到编码VHb的基因(vgb)(Dikshit et al., 1988;Khosla et al., 1988),并在多种异源宿主中得到了表达(Bailey et al., 1996).在转基因植物方面,有试验证明可以通过引入编码细菌血红蛋白的单个基因使转基因植物较早发芽,并加速植物生长,这与增加细胞中的氧浓度的假设相一致(Bailey et al., 1996).目前透明颤菌血红蛋白基因已在烟草(Nicotiana tabaccum)(Holmberg et al., 1997;Lu et al., 2001;Farres et al., 2002)、毛曼陀罗(Datura innoxia)(Bülow et al., 1999)、矮牵牛(Mao et al., 2003)、马铃薯(Solanum tuberosum)(周壮志等,2004)中获得成功转化,并促进转基因植物的生长.本课题组2000年将vgb基因导入银腺杂种杨,获得44个转基因株系,在温室正常条件下,其外部形态与对照相比差异不显著,但有3株转基因株系在株高、地径上明显高于对照植株(张冰玉等,2005).本文在此研究基础上进一步对转基因银腺杨进行分子检测及室内耐涝性鉴定,为培育耐涝转基因杨树良种奠定基础.
1 材料与方法 1.1 供试材料以Southern点杂交初步证实外源vgb基因已整合到基因组中的银腺杨株系为材料,编号为T34,T81,T85,T90.以未转化银腺杨为对照(编号为T0).
1.2 试验方法 1.2.1 Southern印记杂交ECL法:1)模板质粒DNA制备 采用质粒DNA提取试剂盒(天为时代)从大肠杆菌LBA4404中提取含有vgb基因的pPZV质粒DNA.2)探针标记 用Amersham LIFE SCIENCE公司生产的Direct Nucleic Acid Labeling and Detection Systems(核酸标记及检测系统)标记探针.3)样品DNA酶切及电泳 银腺杂种杨样品DNA的酶切,所用酶为HindⅢ.电泳用0.8%琼脂糖凝胶电泳.4)转膜、杂交及洗膜、信号产生及检测 使用Amersham L1FE SCIENCE公司生产的Direct Nucleic Acid Labeling and Detection Systems开展转膜、杂交及检测.
1.2.2 RT-PCR分子检测转基因杨树叶片总RNA提取采用QIAGEN试剂盒,1 μg总RNA用于cDNA合成.以ubiquitin基因为内参,引物为P1(5′-tgaggcttaggggaggaact-3′)和P2(5′-tgtagtcgcgagctgtcttg-3′);vgb基因的引物为:P1(5′- gcgaagcttccctcatgttagaccagcaaa-3′)和P(5′-gcgtcgacgcggcctgaaactttattca-3′).ubiquitin基因产物大小为620 bp,阴性对照的模板为未经转化的对照银腺杂种杨植株RNA,反应条件为:94 ℃预变性5 min,然后94 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min,扩增30个循环,72 ℃延伸10 min;vgb基因产物大小为440 bp,阳性对照的模板为含有vgb基因的pKP质粒,反应条件同ubiquitin.
1.2.3 转基因植株的耐涝性测定试验在中国林业科学研究院温室进行,转基因株系插穗于2005年4月中旬栽于塑料花盆中.盆高30 cm、直径24 cm.基质由草炭土、珍珠岩、砂土以质量比3:1:1混匀.每盆质量3.5 kg.各转基因株系插穗大小和质量尽量保持一致,每盆1株,按常规方法进行肥水管理和病虫害防治.6月5日苗高达到40 cm左右时,从每个株系中(包括4个转基因株系及对照植株)选择生长状况基本一致的植株20株,完全随机区组设计,进行正常供水和淹水处理(维持表面水层2~3 cm左右)试验,每个水平重复10次.每个花盆下垫一个塑料桶以保证水分达到淹水量.淹水22天后排除土壤中多余水分,正常条件下恢复生长10天.试验于7月25日结束.在淹水处理2,7,12,17,22,24(恢复生长第2天),27(恢复生长第5天)和32(恢复生长第10天)天时取功能叶片(第7—9片)参照汤章城(1999)方法测定叶绿素、脯氨酸和MDA含量,每个处理3次重复,结果取平均值.在淹水处理结束后,用卷尺测定转基因植株株高,游标卡尺测定地径,每个株系调查3个样本.然后拔出、洗净,放入烘箱中105 ℃杀青15 min,然后75 ℃烘至恒重,约60 h.用1/10 000电子感应天平称取根、茎、叶的生物量(单位:g).
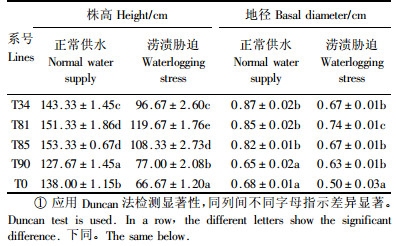
2 结果与分析 2.1 转基因植株的分子检测 2.1.1 Southern印记杂交为了检测外源基因在杨树基因组中的整合情况,对转基因植株基因组DNA进行HindⅢ单酶切,以vgb基因标记探针开展Southern印记杂交(图 1),Southern杂交结果显示转基因株系中均出现1条明显杂交条带,而对照植株无杂交条带,说明转基因株系基因组中整合了vgb基因.
|
图 1 转基因杨树Southern印迹杂交 Figure 1 Southern blotting detection of transgenic plants M:1 kb DNA ladder; 1:阳性对照 Positive control; 2-5:转基因植株 Transgenic plants; 6:阴性对照 Negative control. |
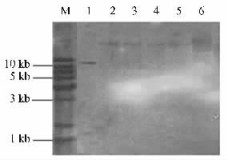
为了检测vgb基因在转基因杨树中的转录表达,以携带vgb基因杨树总RNA为模板经反转录后进行RT-PCR扩增.经ubiquitin基因特异引物扩增确定RNA浓度后,进行vgb基因的RT-PCR检测,对照植株没有扩增出相应条带,转基因株系均扩增出1条440 bp的特征条带,表明转基因株系中vgb基因已成功转录mRNA,并得到表达(图 2).
|
图 2 转基因杨树RT-PCR分析 Figure 2 RT-PCR analysis of transgenic plants 1:阴性对照 Negative control; 2-5:转基因植株 Transgenic plants. |
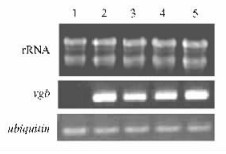
对转基因植株涝渍胁迫下叶绿素含量测定的结果发现,淹水初期转基因株系和对照植株叶绿素含量逐渐下降;在淹水12天时出现急剧下降,转基因株系的下降幅度低于对照植株;在处理的第17天时转基因株系逐渐恢复到正常水平,而对照植株在叶绿素含量急剧下降后并未恢复而是继续下降,在恢复正常供水的时候依然下降,无法恢复,叶绿素合成受到严重影响.表明转基因株系在淹水胁迫下受伤害程度低于对照植株(图 3A).
|
图 3 不同淹水处理下转基因植株和对照植株叶绿素、脯氨酸、丙二醛含量变化 Figure 3 Changes of chlorophyll, proline and MDA contents of transgenic lines and control in different waterlogging treatment T34,T81,T85,T90:转基因植株 Transgenic plants; T0:对照 Negative control. |
淹水处理下转基因株系和对照植株叶片脯氨酸含量较正常供水时略有增加,随着淹水时间的延长,大体变化趋势为先上升后逐渐下降,在12天或17天时脯氨酸含量达到最高值,此时转基因株系增幅高于对照植株,排序为T85>T90>T81>T34>T0,12天或17天后开始下降,淹水处理在正常条件下恢复2天后转基因株系T85、T81、T90脯氨酸含量高于对照植株,T34与对照相比差异不明显(图 3B).从脯氨酸含量变化可以看出转基因株系对淹水的抗性强于对照植株.
2.2.3 涝渍胁迫处理对转vgb基因银腺杂种杨丙二醛含量的影响淹水后转基因株系MDA含量均低于对照植株,随着淹水时间延长,转基因株系和对照植株MDA相对含量先上升而后又有所下降,淹水7天时的MDA相对含量明显高于淹水2天时的含量,同时MDA含量达到最大值,此时4个转基因株系苗木叶片MDA含量依次是T0>T34 >T81>T90>T85;淹水12天时其相对含量低于淹水7天,开始下降.淹水处理在正常条件下恢复2天后转基因株系MDA的含量仍低于对照.说明对照植株细胞膜系统受到的损伤大于转基因株系(图 3C).
2.2.4 涝渍对转基因植株生长的影响为了研究转基因植株的耐涝性,对转基因株系进行大量扩繁,选取生长一致的转基因植株和非转化对照植株各20株,在温室进行模拟涝渍胁迫试验.试验表明:淹水胁迫下转基因株系和对照植株生长均受到一定影响,对照植株水淹2天时大部分叶片开始变黄并出现萎蔫下垂,4天时有个别叶片开始脱落,随着水淹时间的延长,植株干部变黑并伴随死亡,水淹17天时死亡率达到66.70%,存活植株生长缓慢;转基因株系在淹水初期虽然出现叶片萎蔫,个别植株死亡,但死亡率明显低于对照植株,在50.00%以下,T81死亡率只有25.00%.存活转基因植株在淹水一段时间后能够恢复正常生长(图 4).

|
图 4 转基因植株和对照植株在涝渍处理下的生长情况 Figure 4 Growth of transgenic lines and control under waterlogging treatment A.涝渍处理第4天4 days of waterlogging treatment; B.涝渍处理第12天12 days of waterlogging treatment. |
对经过涝渍胁迫处理后转基因株系的生长量调查结果表明,在正常生长条件下转基因株系株高、地径和对照相比差异达到显著水平,其中T81,T85株高超过对照9.66%,11.11%,地径超过对照10.86%,17.38%.涝渍胁迫下转基因株系和对照植株生长量均呈现下降趋势,但转基因株系下降幅度低于对照植株,多重比较表明转基因株系株高、地径与对照相比差异达到显著水平,其中T81,T85株高超过对照82.22%,64.97%,地径超过对照48.00%,34.00% (表 1).
|
|
生物量的多少及其组成反映了外界环境对杨树生长的影响程度及杨树对环境的适应,很多研究都将生物量的变化作为植物抗性强弱的衡量指标.从表 2可以看出,水淹导致植株的生物量急剧下降,对照植株下降最为明显,转基因株系下降程度小于对照植株,说明淹水对转基因株系的抑制程度小于对照植株.在根生物量方面,T81下降幅度最小,为45.75%,其次是T85,对照植株下降达95.83%,降幅最大;茎生物量方面,同样是T81降幅最低,仅为29.23%,未转化对照降幅最大,高达98.86%;叶生物量同样T81表现最好,只下降45.71%,对照植株最差,超过90.38%.从中可以看出地下部分的生物量比地上部分的下降更快,这在试验观察中也得到了证实.
|
|
目前,通过基因工程来实现对植物抗逆性的改良已成为人们普遍关注的课题之一,人们通过基因克隆技术获得了很多抗旱(耐盐)基因,如渗透调节物质基因、功能蛋白基因以及转录因子等,同时也获得了很多抗旱(耐盐)的转基因植株.如Zhu等(1998)从蛾豆(Vigna aconitifolia)中克隆得到P5 CS基因并导入水稻(Oryza sativa),在干旱、盐胁迫条件下转基因植株生物量高于对照植株,获得抗旱、耐盐的转基因植株.但是大部分工作主要集中在植物抗旱、耐盐生理特性方面,而通过基因工程实现对植物耐涝性的改良目前报道还较少.
Dikshit等(1988)首次克隆得到编码VHb的基因vgb,同年Khosla等(1988)也用类似方法克隆了vgb基因.目前通过vgb基因对植物耐涝性的改良已有报道,如Lu等(2001)发现转血红蛋白烟草对淹水的抗性增强;Mao等(2003)对VHb的研究表明,转vhb基因矮牵牛株系在液体培养基中的低氧耐受能力强于对照植株,盆栽苗涝渍7天后转基因株系比对照表现出较强的忍受能力;水涝试验显示,转VHb基因马铃薯植株对低氧胁迫有较好的耐受性(周壮志等,2004).因此该基因对银腺杂种杨耐涝性的改良研究具有重要意义.
大量研究结果表明,在各种逆境胁迫下,植物体内叶绿素均会受到不同程度破坏,使其含量降低.另据报道导入VHb基因的转基因烟草植株生长量提高,35天后平均干物质量比对照增加了80%~100%,发芽较野生型提早6~8天,开花较野生型提前3~5天,叶绿素含量增加30%以上(Holmberg et al., 1997).据报道转基因烟草中叶绿素水平增加可能是由于VHb增加了ATP和氧的供应量,它们均参与叶绿素生物合成中的几步反应(Brewin et al., 1997).已知叶绿素含量增加会促进植物的生长,表达VHb的转基因烟草增加的叶绿素含量至少会部分加快转基因植株的生长.VHb与氧亲合力适度并位于整个胞质溶胶中,从而可以使细胞中有较稳定的氧浓度.此外,VHb还可能有清除氧自由基、作为一种末端氧化酶、还原过氧化物酶以及抑制种子中不饱和脂肪酸的氧化等其他功能,可能有助于加速转基因植株的生长.本研究发现,淹水2天后对照植株叶片即出现失绿现象,继续淹水叶片失绿逐渐加重,变黄萎蔫,直至部分叶片脱落,最后部分植株开始死亡;由图 3A可以看出淹水初期对照植株叶绿素含量逐渐下降,12天时急剧下降,无法恢复,叶绿素合成受到严重影响,同时叶片含水量也明显降低,说明叶绿素的降解导致叶片代谢能力降低.转基因株系叶绿素含量的下降幅度低于对照植株,在处理17天时叶绿素含量能够逐渐恢复到正常水平.说明在涝渍胁迫下vgb基因的表达增强转基因植株叶绿素含量的积累进而促进了转基因植株的生长.
植物在逆境条件下游离脯氨酸的大量积累被认为是对逆境胁迫的适应性反应.本试验中转基因株系在淹水处理期间脯氨酸含量的动态变化存在一定差异,脯氨酸只能在植株体内短时间积累,在水淹12天或17天时转基因株系和对照脯氨酸含量达到最高值,此时转基因株系增加幅度高于对照植株,排序为T85>T90>T81>T34>T0,从脯氨酸含量动态变化可以看出转基因株系对淹水胁迫的适应性和自我保护性强于对照植株.
研究表明,淹水对杨树生长的抑制作用主要是由于根系缺氧而引起的(汪宗立等,1988;汤章城,1983;Philipson et al., 1980),涝渍胁迫会导致杨树生理干旱,进而导致叶片气孔开度缩小,甚至关闭,膜脂过氧化产物MDA含量提高,促使叶片衰老脱落(陈少裕,1991),最终导致光合产物减少.本研究中在涝渍胁迫下对照植株叶片MDA含量上升幅度明显高于转基因株系(图 5),表明转基因株系抗氧化能力强于对照植株,细胞膜较稳定,受到伤害较小.
涝渍对植物造成的伤害主要有衰老、叶片变黄、落叶、停止生长等,长时间的淹水会导致植物在生理上以及氧代谢方面做出反应.植物细胞中增加氧或增强氧的传递效率可以改善植物对缺氧的抵抗能力.研究表明血红蛋白能够改善细菌生长和氧代谢(Kallio et al., 1996;Patel et al., 2000).在缺氧条件下血红蛋白可以快速分解氧促进氧的运输和储存从而使转基因毛曼陀罗加速生长、萌芽、开花(Bülow et al., 1999);同样的结果在烟草(Lu et al., 2001)、矮牵牛(Mao et al., 2003)、马铃薯(周壮志等,2004)中获得验证,导入该基因后转基因植株耐涝性均得到提高.对转基因植株进行温室涝渍胁迫试验结果表明,对照植株在淹水2天时大部分叶片开始出现萎蔫下垂,在淹水12天时开始死亡,17天时死亡率高达66.67%,而转基因株系死亡率明显低于对照植株,同时T81、T85株高超过对照82.22%,64.97%,地径超过对照48.00%,34.00%,茎生物量超过对照89.00%,67.60%,表现较好.
温室模拟持续淹水胁迫条件下对照植株出现叶片变黄、萎蔫,逐渐脱落,并有大部分植株死亡,存活植株基本停止生长的现象;而转vgb基因植株虽然也出现死亡现象,但存活植株仍能继续生长.通过对叶绿素、脯氨酸、MDA含量的分析发现,转基因株系在淹水胁迫下叶绿素含量合成受抑制程度小于对照植株,脯氨酸含量较高,渗透调节能力增强,同时细胞膜的稳定性强于对照植株,这可能是由于vgb基因在银腺杂种杨中的表达使其在生理方面发生了有益的改善,进而提高了转基因植株的耐涝性.转vgb基因杨树耐涝性研究在林木上尚属首次,研究的开展为林木转基因抗涝育种奠定基础.
陈少裕. 1991. 膜脂过氧化对植物细胞的伤害. 植物生理学通讯, 27(2): 84-90. |
汤章城. 1983. 植物对水分胁迫的反应和适应性. 植物生理学通讯, (3): 24-29. |
汤章城. 1999. 现代植物生理学实验指南. 北京: 科学出版社.
|
汪宗立, 刘晓忠. 1988. 玉米的涝渍伤害与膜脂过氧化作用和保护酶活性的关系. 江苏农业学报, 4(3): 1-7. |
张冰玉, 苏晓华, 李义良, 等. 2005. 转透明颤菌血红蛋白基因杨树的再生及其生长量初步测定. 农业生物技术学报, 13(3): 288-293. DOI:10.3969/j.issn.1674-7968.2005.03.004 |
张静娴, 荆玉祥. 1999. 植物的血红蛋白. 生命科学, 11(2): 66-71. |
周壮志, 周永刚, 何朝族, 等. 2004. cry 3A和vhb基因在转基因马铃薯中的表达. 生物化学与生物物理进展, 31(8): 741-745. DOI:10.3321/j.issn:1000-3282.2004.08.014 |
Bailey J E, Sburlati A, Hatzimanikatis V, et al. 1996. Inverse metabolic engineering: a strategy for directed genetic engineering of useful phenotypes. Biotechnol Bioeng, 52: 109-121. |
Brewin N J, Flavell R B. 1997. A cure for anemia in plants. Nature Biotechnology, 15: 222-223. DOI:10.1038/nbt0397-222 |
Bülow L, Holmberg N, Lilius G, et al. 1999. The metabolic effects of native and transgenic hemoglobin on plant. Trends Biotechn, 17: 21-24. DOI:10.1016/S0167-7799(98)01252-9 |
Dikshit K L, Dikshit R P, Webster D A. 1990. Study of vitreoscilla globin (vgb) gene expression and promoter activity in Escherichia coli through transcriptional fusion. Nucleic Acids Research, 18(14): 4149-4155. DOI:10.1093/nar/18.14.4149 |
Dikshit K L, Webster D A. 1988. Cloning characterization and expression of the bacterial goblin gene from vitreoscilla in Escherichia coli. Gene, 70: 377-386. DOI:10.1016/0378-1119(88)90209-0 |
Dikshit R P, Dikshit K L, Liu Y, et al. 1992. The bacterial hemoglobin from vitreoscilla can support the aerobic growth of Escherichia coli lacking terminal oxidases. Arches Biochem Biophys, 293(2): 241-245. DOI:10.1016/0003-9861(92)90391-9 |
Farres J, Kallio P T. 2002. Improved cell growth in tobacco suspension cultures expressing vitreoscilla hemoglobin. Biotechnol Prog, 18: 229-233. |
Holmberg N, Lilius G, Bailey J E, et al. 1997. Transgenic tobacco expressing vitreoscilla hemoglobin exhibits enhanced growth and altered metabolite production. Nature Biotechnology, 15(3): 244-247. DOI:10.1038/nbt0397-244 |
Kallio P T, Bailey J E. 1996. Intracellular expression of vitreoscilla hemoglobin (VHb) enhances total protein secretion and improves the production of α-amylase and neutral protease in Bacillus subtilis. Biotechnol Prog, 12: 31-3. |
Khosla C, Bailey J E. 1988. The vitreoscilla hemoglobin gene: molecular cloning, nucleotide sequence and genetic expression in Escherichia coli. Mol Gene Genet, 214: 158-161. |
Khosla C, Bailey J E. 1989. Characterization of the oxygen-dependent promoter of the vitreoscilla hemoglobin gene in Escherichia coli. J Bacteriol, 171(11): 5995-6004. DOI:10.1128/jb.171.11.5995-6004.1989 |
Lu Y Y, Wang X F, Liang S P. 2001. Enhancement of flooding tolerance of plant expressed hemoglobin. The 3rd Cross-Strait Symposium on Plant Molecular Biology and Biotechnology, Hongkong.
|
Mao Zichao, Hu Yuanlei, Zhong Jin, et al. 2003. Improvement of the hydroponic growth and waterlogging tolerance of petunias by the introduction of vhb gene. Acta Botanica Sinica, 45(2): 205-210. |
Patel S M, Stark B C, Hwang K W, et al. 2000. Cloning and expression of vitreoscilla hemoglobin gene in Burkholderia sp. strain DNT for enhancement of 2, 4-dinitrotoluene degradation. Biotechnol Prog, 16: 26-30. DOI:10.1021/bp9901421 |
Philipson J J, Couts P P. 1980. The tolerance of tree roots to waterlogging. New Physiologists, 85: 489-531. DOI:10.1111/nph.1980.85.issue-4 |
Tyree B, Webster D A. 1978. Electro-accepting properties of cytochrome purified from vitreoscilla. Journal of Biology Chemistry, 253: 6988-6991. |
Wakabayashi S, Matsubara H, Webster D A. 1986. Primary sequence of a diametric bacterial hemoglobin from vitreoscilla. Nature, 322(6078): 481-483. |
Zhu B C, Su J, Chang M C, et al. 1998. Overexpression of a Δ1-pyrroline -5-carboxylate synthetase gene and analysis of tolerance to water- and salt-stress in transgenic rice. Plant Science, 139: 41-48. |
 2009, Vol. 45
2009, Vol. 45