文章信息
- 吴丽君.
- Wu Lijun
- 湿地松不定芽分化生根与解剖观察
- Differentiation and Rooting of Slash Pine Adventitious Buds and the Histological Anatomy
- 林业科学, 2009, 45(7): 21-25.
- Scientia Silvae Sinicae, 2009, 45(7): 21-25.
-
文章历史
- 收稿日期:2008-08-06
-
作者相关文章
近年来,针叶树种直接器官发生植株再生的研究取得了可喜的进展(唐巍等,1997).而针叶树种间接器官发生植株再生的研究报道很少,目前仅有火炬松(Pinus taeda)(Tang et al., 1998;1999;2001)、湿地松(P. elliottii)、晚松(P. serotina)(阙国宁等,1997)、弗吉尼亚松(P. virginiana)(Tang et al., 2004)、美国五针松(P. strobus)(Tang et al., 2005)、华北落叶松(Larix principis-rupprechtii)(齐力旺等,1996)、辐射松(P. radiata)(Schestibratov et al., 2003)、欧洲落叶松(L. eurolepis)(Laliberte et al., 1998)和外高加索松(P. eldarica) (Gladfelter et al., 1987),经间接器官发生获得了低频率的再生植株.
湿地松为我国南方重要的造林树种,研究证明湿地松同大多数针叶树种一样属离体培养顽拗型植物,其直接器官发生途径实现快繁仍存在一定的技术障碍(吴丽君等,2007).郑进等(2005)、Tang等(2006)先后对湿地松间接器官发生植株再生进行了探索性试验,为湿地松组培快繁开辟了新的途径.吴丽君(2008)开展了湿地松器官性愈伤组织的诱导与增殖的研究,通过间接器官发生获得了高频率增殖的不定芽,然而促进湿地松器官性愈伤组织不定芽分化及生根,提高不定芽分化率和生根率是间接器官发生急待解决的关键技术.
1 材料与方法 1.1 材料以湿地松成熟胚诱导的器官性愈伤组织为试验材料.
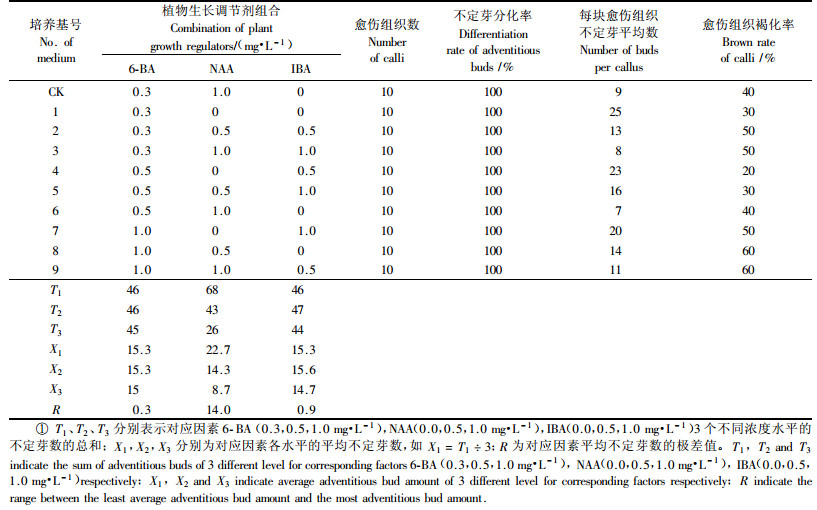
1.2 不定芽分化培养基的筛选 1.2.1 植物生长调节剂组合的筛选以不定芽增殖培养基TX+6-BA0.3 mg·L-1+NAA1.0 mg·L-1(吴丽君,2008)为对照,TX(加拿大Cellfor公司设计)为基本培养基,NAA,IBA各3个质量浓度水平(0.0,0.5,1.0 mg·L-1),6-BA 3个质量浓度水平(0.3,0.5,1.0 mg·L-1),采用表L9(34)设计试验方案.将0.5~0.7 cm2大小的愈伤组织接入10种分化培养基(表 1),每种培养基接入愈伤组织10块.根据不定芽分化率、褐化率及每块愈伤组织不定芽数,筛选适宜的不定芽分化培养基.培养基均添加400 mg·L-1水解酪蛋白(CH)、3%蔗糖.不定芽分化率=分化不定芽的愈伤组织数/接种的愈伤组织数.
|
|
以植物生长调节剂组合筛选试验中筛选出的最佳培养基TX+6-BA0.5 mg·L-1+IBA0.5 mg·L-1为不定芽分化培养基,开展不同质量浓度蔗糖(10,20,30,40 g·L-1)对不定芽分化的影响试验.
1.3 不定芽分化的解剖观察在愈伤组织接入分化培养基第1,15,30,45天各取材1次,石蜡切片,显微镜观察并拍照.
1.4 不定芽同步化发育培养基的筛选以植物生长调节剂组合筛选试验中筛选出的最佳培养基TX+6-BA0.5 mg·L-1+IBA0.5 mg·L-1为对照,比较6-BA(0,0.2 mg·L-1)不同质量浓度水平对不定芽同步化发育的影响.各培养基转接分化培养50天的愈伤组织10块,培养40天后,统计有效芽苗数.
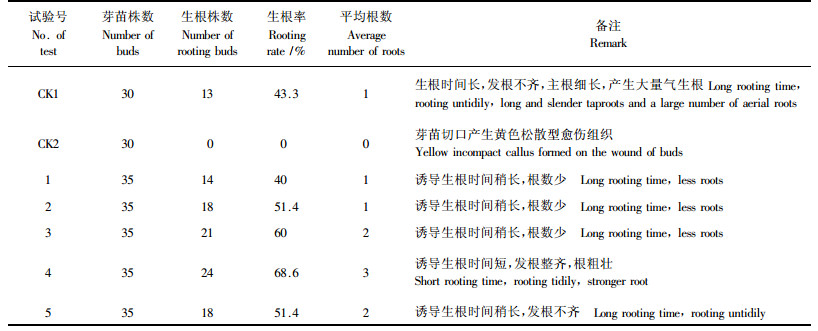
1.5 不定芽生根培养程序的优化将苗高1.5 cm左右的单芽转入生根培养基诱导不定根,以DCR+AC 0.5 g·L-1(朱丽华等,2005)及1/2GD(GD大量元素减半)+NAA0.05 mg·L-1(朱丽华等,2004;2005;2006)为对照培养基,以GD(无大量元素)+NAA0.05 mg·L-1为生根培养基;分别在培养10,15,20,25,30天后添加10 mL大量元素减半GD营养液,比较不同培养程序的生根率.各生根培养基均附加CH500 mg·L-1、谷氨酰胺450 mg·L-1、15 g·L-1蔗糖、6 g·L-1琼脂.
1.6 生根苗的移栽苗高2 cm以上、根长0.5~1 cm左右,有2~3条粗壮的白色根,即可将生根苗移栽至温室.
2 结果与分析 2.1 不同植物生长调节剂组合对不定芽分化的影响湿地松器官性愈伤组织(OC)在10种不定芽分化培养基中分化培养50天后,不定芽分化率、平均每块愈伤组织不定芽数及愈伤组织褐化率见表 1.分化培养20天后,观察到10种培养基均有不同程度的愈伤组织褐化现象,但褐化的愈伤组织仍可见不定芽的分化,如图版Ⅰ-1所示,愈伤组织表面形成白色或淡绿色小突起,这些小突起很容易从愈伤组织表面剥离.由表 1可见,10种培养基均获得了100%的不定芽诱导率,但不同植物生长调节剂组合平均每块愈伤组织分化不定芽数不同,对照培养基(CK)平均不定芽数少于10个;添加NAA的培养基不定芽明显少于没有NAA的培养基,可见NAA对不定芽的分化不利,这从表 1中的不定芽数极差值(RNAA>RIBA>R6-BA)得到了证实;而不同浓度6-BA与IBA组合成的3种培养基(培养基1,4,7号)分化的不定芽数多达20个以上,可见6-BA与IBA的组合有利于不定芽的分化.根据每块愈伤组织分化的不定芽平均数及褐化率两指标,不定芽分化的理想培养基为TX+6-BA0.5 mg·L-1+IBA0.5 mg·L-1.

|
图版Ⅰ Plate Ⅰ |
不同质量浓度蔗糖不定芽分化试验结果(图版Ⅰ-1, 2, 3, 4):蔗糖质量浓度为10,20,30,40 g·L-1,不定芽平均数分别为8,13,23,17个.可见在30 g·L-1的质量浓度范围内,随着质量浓度的升高,分化不定芽数量增多,在30 g·L-1时,不定芽数达到最高.蔗糖质量浓度太高也不利于不定芽的分化.
2.3 不定芽器官分化的解剖观察由石蜡切片(图版Ⅰ-5)观察到,OC转入分化培养基前,OC近表层细胞或内部细胞已发生快速分裂,形成椭圆形或圆形的“拟分生组织”即生长中心,这些细胞在显微镜下很容易与周围老化细胞区分开来,具有体积小、核大、细胞质浓厚、染色深、细胞排列紧密等特点.试验证明“拟分生组织”是OC的重要标志.OC转入分化培养15天(图版Ⅰ-6),随着“拟分生组织”细胞继续分裂,突破周围褐化死亡的细胞层,向组织表面继续发育.分化培养30天(图版Ⅰ-7),“拟分生组织”细胞加速分裂而发育为不定芽原基.分化培养45天,不定芽原基发育成肉眼可见的绿色不定芽(图版Ⅰ-8).
2.4 不同植物生长调节剂组合对不定芽同步化生长发育的影响为促进不定芽同步生长,提高有效芽苗率,将分化培养50天的愈伤组织切成4块(每块约含5~6个不定芽),转接到3种不定芽高生长培养基:1) TX+6-BA0.5 mg·L-1 +IBA0.5 mg·L-1;2) TX+6-BA0.2 mg·L-1+IBA0.5 mg·L-1;3) TX+IBA0.5 mg·L-1.培养40天后,统计各培养基有效芽苗数.1号培养基,芽苗生长缓慢(图版Ⅰ-9);2号培养基,每块愈伤组织约有1~2个有效芽苗,苗高0.5~1.2 cm(图版Ⅰ-10);3号培养基,每块愈伤组织平均有3~4个有效芽苗,高生长均匀一致,苗高1.0~1.5 cm(图版Ⅰ-11,12).可见3种培养基中,2号与3号培养基均促进了不定芽的同步生长,获得了有效芽苗,而3号培养基TX+IBA0.5 mg·L-1最有利于不定芽的同步化生长发育.
2.5 不同培养程序对不定芽生根诱导的影响由表 2可见,DCR+AC0.5 g·L-1无植物生长调节剂培养基也能诱导生根,但生根时间长、发根不齐、以气生根为特征(图版Ⅰ-14).这与朱丽华等(2005)报道的湿地松不定芽生根试验结果有一定的差异,这可能与试验材料基因型有关,或与统计生根试验结果的时间不同有关.不定芽在1/2GD+NAA0.05 mg·L-1的对照培养基上培养100天未见生根,而其他5个试验号均获得不同比率的生根苗,试验号4即不定芽转接到GD(无大量元素)+NAA0.05 mg·L-1培养25天后添加10 mL大量元素减半GD营养液获得了最高的生根率68.6%(图版Ⅰ-13).由此推断大量元素对生根诱导不利,不定芽生根培养初期无大量元素的培养基有利于根的诱导,生根培养25天时,添加1/2GD大量元素,促进根的生长发育.过早添加大量元素不利根的诱导,而太迟添加也可能因根苗养分不足而导致发根不齐.
|
|
选用体积比为8:2的黄心土与细砂(图版Ⅰ-15)和纯黄心土(图版Ⅰ-16) 2种基质移栽,均获得90%以上的移栽成活率.
3 结论与讨论湿地松器官性愈伤组织不定芽分化、伸长(同步化生长发育)和不定芽生根各培养阶段的植物生长调节剂种类及浓度不同.不定芽分化培养阶段,IBA取代NAA克服了NAA对不定芽分化的抑制作用.美国黄松(Pinus ponderosa)愈伤组织不定芽的诱导也有相似的结果(李科友等,2004).不定芽最佳分化培养基为TX+6-BA0.5 mg·L-1+IBA0.5 mg·L-1,愈伤组织不定芽分化率达100%.蔗糖浓度是影响不定芽分化的重要因素,添加30 g·L-1蔗糖培养基不定芽分化数量最多.根据细胞全能性理论,具有器官发生潜能的细胞均具有器官发生能力,然而在实际培养过程中,由于离体培养的培养基及植物生长调节剂组合的不适宜,在分化过程中,仅有少部分细胞具有器官发生潜能.湿地松每块大小0.5~0.7 cm3的器官性愈伤组织可分化20多个不定芽,仍然远远高于直接器官发生芽增殖率.据报道,辐射松成熟合子胚培养13.5个月后产生5 480个分生组织小块,每个小块平均形成68个伸长的小芽(Aitken-Christie et al., 1985),由此可见间接器官发生的快繁效率之高.愈伤组织解剖研究证实了分化培养前,器官性愈伤组织已包含大量具有器官分化潜能的生长中心——“拟分生组织”,这为间接器官发生愈伤组织不定芽高频率发生提供了可能.
针叶树组织培养中,不定芽生长缓慢是普遍现象(成小飞等,1995).湿地松愈伤组织在原分化培养基上形成了许多大小不等的不定芽,而不定芽生长缓慢且不同步化.火炬松不定芽也有类似的发育不同步现象(Tang et al., 2001).这一方面与树种本身细胞分裂频率低、生长缓慢有关,另一方面可能与愈伤组织上不定芽数量多、离体培养外源养分供给不足或不平衡有密切关系.为此,不定芽分化培养后,应将器官性愈伤组织分切成小块,转入低细胞分裂素或无细胞分裂素的培养基,以促进不定芽同步化生长发育,提高有效芽苗率,不定芽同步化生长最佳培养基为TX+IBA0.5 mg·L-1.
诱导生根时间及生根率是快繁效率的重要指标.培养基及生长素种类、浓度是生根率的主要影响因素,在这方面,前人已做了大量的研究工作.本试验从添加培养基大量元素的不同时间进行对比,表明不定芽生根培养25天时,添加1/2GD大量元素,促进根的生长发育,提高了生根率.这是否源于芽苗转入生根培养25天时,不定芽原基已基本发育形成,此时再添加大量元素不再影响根原基的发育,这一结论还有待于进一步的重复试验和结合芽苗发根过程的解剖研究进行验证.朱丽华(2007)认为黑松(Pinus thunbergii)生根培养21天时,根原基已发育完成,24天不定根开始突出表皮,形成肉眼可见的突起.湿地松不定根的诱导过程是否有相似的发育时间进程,也需要深入研究.此外,进一步优化生根培养基及培养程序以提高湿地松不定芽生根率将是今后研究的重点方向.
成小飞, 花晓梅, 李文钿. 1995. 马尾松离体培养条件下的微繁殖和菌根的形成. 林业科学研究, 8(3): 241-246. DOI:10.3321/j.issn:1001-1498.1995.03.002 |
李科友, 唐德瑞, 朱海兰. 2004. 美国黄松离体胚培养条件下不定芽的形成与根产生的研究. 林业科学, 40(4): 63-67. DOI:10.3321/j.issn:1001-7488.2004.04.011 |
齐力旺, 韩素英, 杨云龙, 等. 1996. 华北落叶松的组织培养再生植株. 植物生理学通讯, 32(2): 128-129. |
阙国宁, 房建军, 葛万川. 1997. 火炬松、湿地松、晚松组培繁殖的研究. 林业科学研究, 10(3): 227-232. DOI:10.3321/j.issn:1001-1498.1997.03.001 |
唐巍, 欧阳藩. 1997. 针叶树体细胞无性系研究和应用进展. 生物工程进展, 17(4): 2-10. |
吴丽君, 叶建仁, 王志洁, 等. 2007. 湿地松组培继代增殖的影响因子. 福建林学院学报, 27(2): 165-169. DOI:10.3969/j.issn.1001-389X.2007.02.017 |
吴丽君. 2008. 湿地松器官性愈伤组织诱导与增殖. 西南林学院学报, 28(6): 49-52. |
郑进, 康薇, 洪华珠, 等. 2005. 湿地松愈伤组织的诱导研究初报. 湖北林业科技, 134(4): 9-11. DOI:10.3969/j.issn.1004-3020.2005.04.003 |
朱丽华, 张艺, 吴小芹. 2004. 湿地松的组织培养及植株再生. 南京林业大学学报:自然科学版, 28(6): 47-51. |
朱丽华, 吴小芹. 2005. 湿地松组培苗生根的影响因子. 东北林业大学学报, 33(5): 15-18. DOI:10.3969/j.issn.1000-5382.2005.05.006 |
朱丽华, 吴小芹. 2006. 湿地松成熟合子胚直接器官发生及植株再生. 林业科学, 42(8): 25-29. |
朱丽华. 2007. 黑松、赤松组培繁殖技术研究. 南京林业大学博士学位论文.
|
Aitken-Christie J, Singh A P, Horgan K J. 1985. Explant developmental state and shoot formation in Pinus radiata cotyledons. Botanical Gazette, 146(2): 196-203. DOI:10.1086/337515 |
Gladfelter H J, Phillips G C. 1987. Denovo shoot organogenesis of Pinus eldarica in vitro. Plant Cell Rep, 6: 163-166. DOI:10.1007/BF00268468 |
Laliberte S, Lalonde M. 1998. Sustained caulogenesis in callus cultures of Larix eurolepis initiated from short shoot buds of a 12-year-old tree. American Journal of Botany, 75: 767-777. |
Schestibratov K A, Mikhailov R V, Dolgov S V. 2003. Plantlet regeneration from subcultured nodular callus of Pinus radiata. Plant Cell, Tissue and Organ Culture, 72: 139-146. DOI:10.1023/A:1022296028951 |
Tang Wei, Ouyang Fan, Guo Zhongcheng. 1998. Plant regeneration through organogenesis from callus induced from mature zygotic embryos of loblolly pine. Plant Cell Rep, 17: 557-660. DOI:10.1007/s002990050441 |
Tang Wei, Ouyang Fan. 1999. Plant regeneration via organogenesis from six families of loblolly pine. Plant Cell, Tissue and Organ Culture, 58: 223-226. DOI:10.1023/A:1006392330738 |
Tang Wei, Whetten R, Sederoff R. 2001. Genotypic control of high-frequency adventitious shoot regeneration via somatic organogenesis in loblolly pine. Plant Science, 161(2): 267-272. DOI:10.1016/S0168-9452(01)00394-6 |
Tang Wei, Harris L C, Outhayong V. 2004. Antioxidants enhance in vitro plant regeneration by inhibiting the accumulation of peroxidase in Virginia pine(Pinus virginiana Mill.). Plant Cell Rep, 22: 871-877. |
Tang Wei, Newton R J. 2005. Plant regeneration from callus cultures derived from mature zygotic embryos in white pine (Pinus strobus L.). Plant Cell Rep, 24: 1-9. DOI:10.1007/s00299-005-0914-3 |
Tang Wei, Newton R J, Charles T M. 2006. Plant regeneration through multiple adventitious shoot differentiation from callus cultures of slash pine. Journal of Physiology, 163(1): 98-101. |
 2009, Vol. 45
2009, Vol. 45