文章信息
- 徐进, 施季森, 杨立伟, 王桂凤.
- Xu Jin, Shi Jisen, Yang Liwei, Wang Guifeng.
- 杉木花粉母细胞减数分裂的细胞学特性及异常现象的观察
- Cell Biological Characteristics and Abnormal Behavior during the Meiosis of Pollen Mother Cells in Cunninghamia lanceolata
- 林业科学, 2007, 43(11): 32-36.
- Scientia Silvae Sinicae, 2007, 43(11): 32-36.
-
文章历史
- 收稿日期:2006-10-23
-
作者相关文章
植物减数分裂的研究一般以花粉母细胞为观察对象。通过对花粉母细胞减数分裂过程和机制的研究,即可观察植物减数分裂过程并揭示其遗传调控规律。通过分析减数分裂中期Ⅰ单价体、二价体、三价体和四价体等的有无及出现的频率,可以得到染色体组间的同源性信息及染色体结构变异的证据(郭军洋等,2004;刘大钧,1999)。在通常情况下,减数分裂的前期有单价体、后期有滞后染色体以及末期有微核等现象出现,则说明花粉败育是由减数分裂染色体配对异常引起的(Stebbins et al., 1939; 彭海峰等,2006)。因此,研究植物减数分裂中染色体行为对植物发育生物学研究和植物育种均有重要的意义。
木本植物的减数分裂的研究大多也是以花粉母细胞为研究材料,如分别在松科(Pinaceae)、杉科(Taxodiaceae)、杨柳科(Salicaceae)、木兰科(Magnoliaceae)等一些树种中开展了减数分裂的进程、减数分裂中染色体行为和染色体的构型等方面研究(潘乃穟等,1982;Hizume et al., 1989;康向阳等,2000;李建强等,2003)。自韩一凡等(1984)报道杉木(Cunninghamia lanceolata)染色体核型研究之后,陆续有对杉木染色体多态性和带型等方面的研究报道(张朝成,1986;李占林等,1990)。对杉木花粉母细胞(PMCs)减数分裂进程,黄紫恒(1986)、蒋恕等(1988)分别进行过报道。蒋恕等(1988)使用透射电镜对杉木小孢子发育过程中细胞的超微结构变化进行观察,结果表明,杉木小孢子发生过程与其他一些植物基本类似,经历2次分裂,染色体数目减半。但减数分裂过程中,染色体的行为特征未见详细报道。本文用荧光染料染色的方法,对杉木母细胞减数分裂的细胞学特征进行了较为深入的观察分析,以期揭示杉木花粉母细胞减数分裂过程中染色体变化的行为规律,寻找杉木花粉败育的细胞学依据。
1 材料与方法 1.1 材料供试3个杉木无性系为:福建洋口11号无性系、句容0号无性系和软叶杉木(C. lanceolata ‘Mollifolia’)(陈岳武等,1983)。其中11号无性系为南京林业大学校园保存的10年生嫁接植株,其余直接来自福建。
1.2 方法 1.2.1 固定与保存2005年从2月初到3月中、下旬,对以上材料进行取样,观察杉木小孢子叶球发育形态。将需要保存的雄球花放入卡诺固定液中固定5 min,然后转入70%酒精,再放入冰箱中冷藏待用。
1.2.2 制片方法压片法。
1.2.3 荧光染色1) 色霉素A(Chromomycin A,CMA)染色在染色缸中倒入标准缓冲液MCIlvaine缓冲液(体积比为0.1 mol·L-1柠檬酸:0.2 mol·L-1磷酸氢二钠=1:4.63,pH 7.0),将制片放入其中浸泡10 min;转置0.2 mg·mL-1远霉素A(Distamycin A)缓冲液染色10 min;用含有5 mmol·L-1MgSO4缓冲液冲洗,盖玻片自行滑落;再用0.1 mg·mL-1色霉素A(含有5 mmol·L-1 MgSO4)缓冲液染色10或15 min;滴一小滴甘油,再盖一张新的盖玻片;置Leica DM LB2型光学显微镜,蓝色激发光激发用数码相机拍照。2) DAPI(4,6-二脒基-2-苯基咪哚,4,6-diamidino-2-phenylindole)染色制片浸入标准缓冲液MCIlvaine缓冲液5~10 min;转入DAPI染色5 min,甘油封片,置Laica DM LB2型光学显微镜,紫色激发光激发用数码相机拍照。
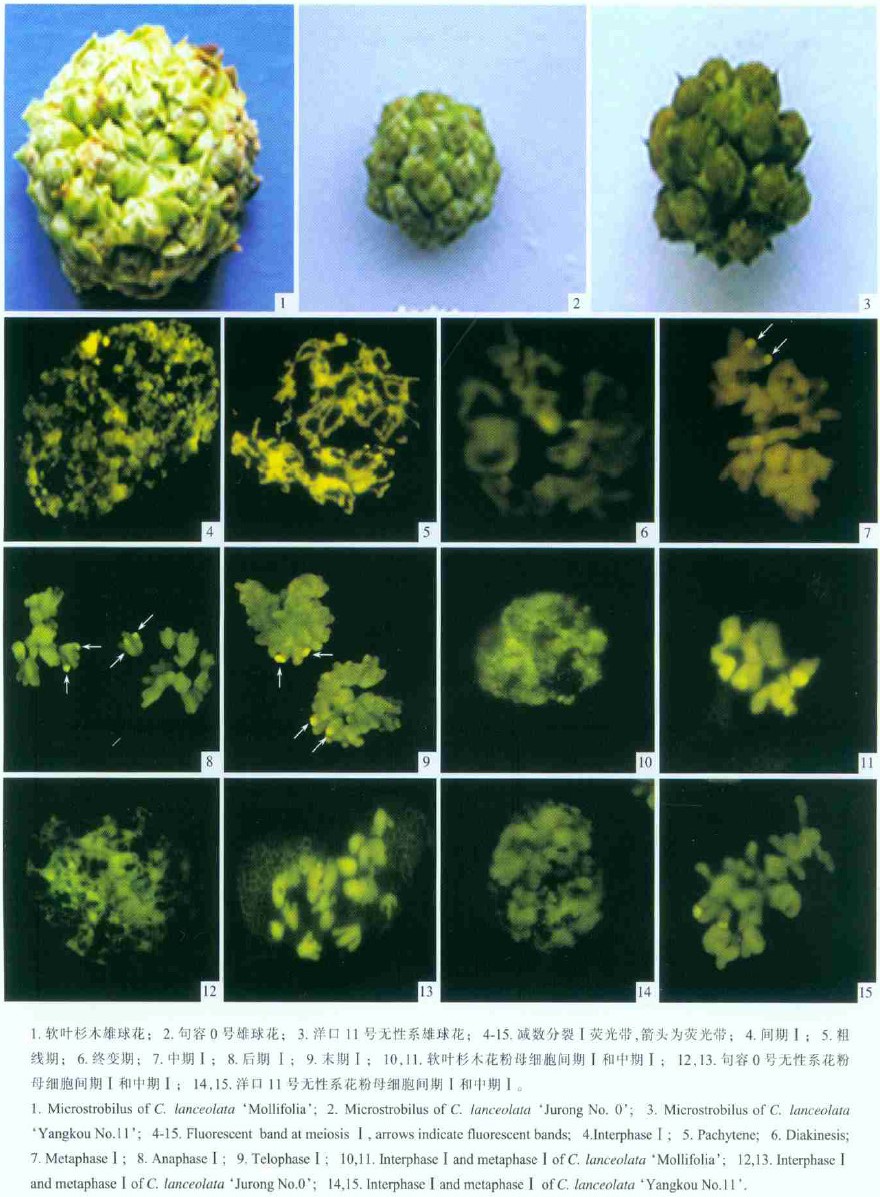
2 结果与分析 2.1 杉木花粉母细胞减数分裂中的染色体的荧光带纹杉木(洋口11号无性系)减数分裂中的花粉母细胞进行色霉素A(CMA)染色,发现花粉母细胞在减数分裂的各个时期,染色质或染色体上有荧光亮点出现。在间期(图版Ⅰ-4),染色质内有4~5个荧光亮点;前期Ⅰ(图版Ⅰ-5,6)染色体上有3~4个荧光亮点不等;中期Ⅰ (图版Ⅰ-7)有2个荧光亮点;后期Ⅰ(图版Ⅰ-8)有4个荧光亮点分别位于赤道板的两侧,向两极移动;末期Ⅰ(图版Ⅰ-9),在细胞的两极仍然可分别见到2个荧光亮点;晚末期Ⅰ,染色体解螺旋,细胞两极有4个荧光亮点。
|
采集而来的处于减数分裂中期Ⅰ的杉木的3种无性系的雄球花花簇的外部形态特征(表 1,图版Ⅰ-1,2,3),从外观来看,软叶杉木的整个花簇较大,其大小为16.0~20.0 mm,均值是18.00 mm;句容0号和洋口11号花簇大小相当,变异范围分别为9.0~14.2 mm和11.0 ~14.5 mm,均值在12.00 mm左右,比软叶杉木要小,但句容0号花簇的外部有蜡状物质包裹。
|
|
由表 1可见,处于减数分裂中期Ⅰ的3个杉木无性系小孢子叶球(雄球花)长度、直径差异不是很大。洋口11号、句容0号无性系和软叶杉木的雄球花长度变异范围基本相当,雄球花长度的均值相差不大。直径方面,软叶杉木的变异范围稍大,为2.8~3.2 mm,有0.4 mm的幅度,它们的直径均值也相差不太大。
2.3 不同杉木无性系染色体荧光带纹的比较对3个杉木无性系的花粉母细胞减数分裂Ⅰ进行比较(图版Ⅰ-10~15),发现中期Ⅰ染色体上的CMA亮带均为2个,间期核中CMA亮点数以软叶杉木和句容0号多一些(4~5个),因此,3个杉木无性系荧光带纹差异不显著。
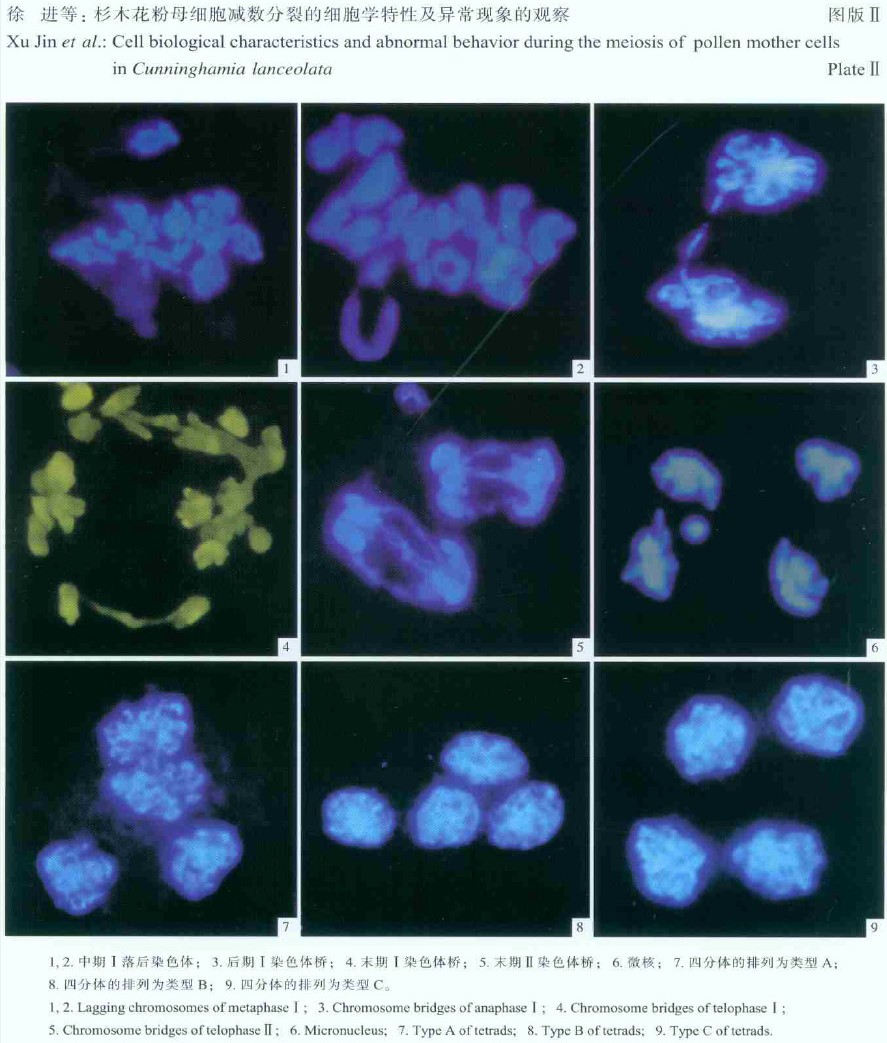
2.4 减数分裂中异常现象的发生 2.4.1 滞后染色体、染色体桥、断片3个杉木无性系的花粉母细胞在减数分裂过程中均存在单价体和多价体、染色体桥、滞后染色体、不均等分离、微核等异常现象。在减数分裂中期Ⅰ,多数染色体能在纺锤体牵引下排列在赤道板上,少数染色体分散在赤道面两侧或远离赤道面成为滞后染色体(图版Ⅱ-1,2),具滞后染色体的细胞占10%左右;后期Ⅰ、后期Ⅱ出现了染色体桥(图版Ⅱ-3,5),另在末期Ⅰ也观察到了染色体桥(图版Ⅱ-4)。这种染色体桥随着染色体向两极移动,就会造成其随机断裂,染色体桥断裂后形成的缺失-重复一般会导致小孢子的不育。
|
一个花粉母细胞进行正常的减数分裂时,至末期Ⅱ会形成4个细胞核,最后产生4个子细胞。而微核是染色体片断、滞后的染色体形成的,从而造成一个花粉母细胞最后可能形成了5个或5个以上的核。在本次研究中发现末期Ⅱ就有5个核的细胞出现(图版Ⅱ-6)。
3 结论与讨论 3.1 荧光带纹在减数分裂染色体研究中的应用杉木花粉母细胞减数分裂中期Ⅰ染色体上的CMA带在一对配对的同源染色体上出现,根据杉木根尖细胞染色体的CMA亮带只出现在带随体的染色体上的事实(另文发表),即有理由判断杉木减数分裂中期Ⅰ有荧光亮点的染色体应是有随体的染色体。
一些染色体长度较小的植物的核型研究是取减数分裂粗线期的染色体进行分析(Chen et al., 2005)。但杉木有丝分裂中期相的染色体的长度相对较长的,那么其减数分裂粗线期的染色体就会更长,很容易相互缠绕在一起,而中期Ⅰ的染色体又缩得较短,也不易区分(随体也观察不到)。因此,用CMA带就可以从中期Ⅰ染色体中把有随体的染色体挑选出来。因为杉木染色体组中相邻染色体的相似度很大,很难具体区分。因此,杉木主要以形态上较容易辨别的有随体的染色体为突破口,研究带随体的染色体的结构和DNA序列的组成,最终实现杉木的遗传物理图谱的构建。
3.2 减数分裂末期Ⅱ细胞学行为的多样性一个花粉母细胞减数分裂经连续2次分裂而成为4个单倍体的子细胞。末期Ⅱ时形成的四分体的排列方式基本有3种形式(类型A、B、C),类型A、B、C为四边形排列形式(图版Ⅱ-7,8,9)。观察杉木3个无性系末期Ⅱ时四分体排列情形基本相近,四边形的排序方式(图Ⅱ-7)出现的频率较高,大约占到70%左右。而另2种类型的排列出现的几率大致相当,合计占3 0%左右(表 2)。
|
|
四分体的分裂方式分为2种类型:一种为单平面的分裂,即所有分裂而来的子细胞均在同一平面上;另一种为多平面的分裂,即所有分裂而来的子细胞处于一个以上的平面上(Chen et al., 2005)。单平面的分裂将形成线形(c)、T-形(d)、长菱形(e)和四边形(f);而多平面的分裂将形成交叉十字形(g)和四面体(h)。特定的四分体类型与细胞分裂的对称性和方向性有一定的关系。对于单平面的分裂类型形成的四分体来说,它们的分裂方向是在一平面上对称的,而对多平面的分裂类型的四分体来说,它们的分裂方向非同一平面,但它们的分裂轴心是对称的。
根据对杉木末期Ⅱ四分体的观察,发现杉木的四分体主要是四边形的四分体(约70%),其余的是T-形居多(约30%),交叉十字形和四面体很少见。因此,杉木四分体分裂方式主要是单平面分裂方式。与杉属的另一个种——水杉(Metasequoia glyptostroboides)的四分体分裂方式相似(He et al., 2004)。
3.3 减数分裂的异常与孢子的育性减数分裂是有性生物形成配子的一种特殊的细胞分裂方式。二倍体生物在减数分裂中,同源染色体配对并有规律地分配到配子中,因此,减数分裂是维持物种染色体数目的稳定,使生物物种得以保存延续的重要生物过程(刘大钧,1999)。在本次研究中,尽管同源染色体配对基本正常,形成了二价体,但在中期Ⅰ还是发现有滞后的染色体存在。滞后的染色体在分裂后期将随机分向两极,从而导致细胞分裂过程中遗传物质分配不均匀。在杉木小孢子母细胞减数分裂后期Ⅰ和Ⅱ,均观察到染色体桥。这些桥在细胞分裂过程中,会随机断裂,最终形成的配子中,有一些包含有部分遗传物质的缺失和重复,推测与配子表现为半不育相关。
从前人的研究结果来看,杉木花粉的生活力不是很高。管康林(1997)报道,杉木花粉的平均发芽率为54.5%,最高为73.9%,最低为28.4%。因此杉木花粉形成过程中,由于减数分裂异常引起遗传物质不均衡分配,导致花粉败育,可能是导致杉木花粉生活力不高的主要因素之一。
3.4 减数分裂异常的可能原因 3.4.1 染色体的畸变染色体畸变会使细胞在分裂时出现一些异常现象,如染色体倒位。染色体倒位有可能在分裂的后期出现染色体桥,后期染色体桥主要是单染色体桥,这类桥可能是倒位圈内只有1次交换或者是由倒位圈内发生3线双交换所致(刘大钧,1999)。产生的双着丝粒和无着丝粒的染色单体,在后期形成染色单体桥和断片。在本次研究中只观察到后期的染色单体桥,而没有发现断片,也可能如有的学者推断的那样只有桥而无断片是因为形成的倒位很小,伴随的断片很小而难以观察(李雪等,2003)。在后期Ⅰ染色体桥是一种不稳定结构,在以后的细胞分裂过程中将开始“断裂—融合—桥”(BFB)循环,致使这条染色体从细胞中丢失,结果导致遗传物质的减少。
杉木花粉母细胞减数分裂中出现的这种异常情形,使产生的配子里的遗传物质为一种缺失-重复,导致其配子部分不育,此种不正常的状况不能在世代的传递中延续。因此在自然生长的杉木中很难发现染色体畸变的突变体存在。
3.4.2 染色体端粒的受损端粒是一重要的遗传元件,具有稳定线性真核细胞染色体天然末端的作用(伊丽莎白等,2002;Thomas et al., 2002)。在植物染色体端粒方面,最早是McClintock(1939)对玉米(Zea mays)的研究,研究认为端粒的一个重要功能是为染色体末端提供稳定的帽子结构。
端粒是由端粒酶合成的。在端粒酶缺失时,复制停止导致染色体缩短,进一步使染色体发生融合及其他细胞生成的异常,最终限制了细胞增殖能力(翟中和等,2000)。后期有染色体桥而未有断片,Stebbins等(1939)认为此现象可能是由于二价体的每个染色体中的一个染色单体的端部发生融合所致。Riha等(2001)研究了端粒酶缺失的一种拟南芥(Arabidopsis thaliana)突变体,该突变体在最后5代出现了染色体融合,至最晚的一个世代,染色体的融合发生率达40%以上,在一些细胞中几乎有一半的染色体发生了融合。因此认为染色体融合出现染色体桥主要是由于染色体缺失端粒酶。因此,本研究观察到的染色体桥也有可能是染色体缺乏端粒酶所致。
3.4.3 染色体分离器异常染色体的异常分裂特别是染色体的滞后,可能与牵引染色体向两极移动的分离器——纺锤体异常有关(Riha et al., 2001)。Golubovskaya等(1980)研究玉米的突变体发现染色体异常分离与纺锤体迟聚合有关。而在一种曲霉菌(Aspergillus nidulans)的突变体里,染色体异常分离与微管的解体有关,β微管分子可防止染色体向两极移动(Oakley et al., 1981)。推测杉木花粉母细胞出现的滞后的染色体可能也与细胞中微管分子不能或迟聚合形成纺锤体有关,但具体原因有待进一步研究。
减数分裂异常除了上述原因还有其他原因如外界环境等(Romanova et al., 2005),它是受多因素综合影响的。植物花粉母细胞减数分裂是否正常,直接关系到配子的育性。通过植物中花粉母细胞异常减数分裂可形成配子的半不育,从中可筛选出一些雄性不育系的植株,这对农作物和一些花卉的育种以及遗传改良等具有很好的利用价值。
陈岳武, 施季森. 1983. 杉木遗传改良中的若干基本问题. 南京林产工业学院学报, (4): 9-23. |
管康林. 1997. 杉木种子空瘪涩粒成因的综合分析. 浙江林学院学报, 14(1): 88-93. |
郭军洋, 陈劲枫, 钱春桃, 等. 2004. 植物减数分裂染色体配对与染色体组分析的研究进展. 植物学通报, 21(5): 513-520. DOI:10.3969/j.issn.1674-3466.2004.05.001 |
韩一凡, 杨自湘, 佟永昌, 等. 1984. 杉木地理种源核型研究. 林业科学, 20(2): 114-120. |
黄紫恒. 1986. 用杉木雄球花观察减数分裂. 植物杂志, (3): 23. |
蒋恕, 黄金生. 1988. 杉木小孢子发育过程中细胞超显微结构. 南京林业大学学报, 12(3): 52-55. |
康向阳, 朱之悌, 张志毅. 2000. 毛白杨花粉母细胞减数分裂及其进程的研究. 北京林业大学学报, 22(6): 5-7. DOI:10.3321/j.issn:1000-1522.2000.06.002 |
李建强, 何子灿. 2003. 玉兰减数分裂观察及染色体构型分析. 植物分类学报, 41(4): 362-368. |
李雪, 陈丽梅, 杜捷, 等. 2003. 兰州百合小孢子母细胞减数分裂异常现象的观察. 西北植物学报, 23(10): 1796-1799. DOI:10.3321/j.issn:1000-4025.2003.10.026 |
李占林, 宋运淳, 刘立德. 1990. 杉木染色体G-带的研究. 林业科学, 26(5): 452-455. |
刘大钧. 1999. 细胞遗传学. 北京: 中国农业出版社.
|
潘乃穟, 刘春清, 万耀球. 1982. 三种松科植物(白皮松Pinus bungeana、油松Pinus tabulaeformis、白杄 Picea meyer)小孢子母细胞减数分裂现象. 北京大学学报, (4): 68-76. |
彭海峰, 邱振国, 陈雄辉, 等. 2006. 无花粉型水稻温敏核不育系籼S的育性表现与细胞学观察. 生态学报, 26(7): 2322-2327. DOI:10.3321/j.issn:1000-0933.2006.07.036 |
伊丽莎白H.布莱克本, 卡罗尔W.格雷德. 2002.端粒.张玉静, 译.北京: 科学出版社
|
翟中和, 王喜忠, 丁明孝. 2000. 细胞生物学. 北京: 高等教育出版社.
|
张朝成. 1986. 杉木同源染色体随体异形现象. 武汉植物学研究, 4(1): 103-104. |
Chen Changbin, Xu Yunyuan, Ma Hong, et al. 2005. Cell biological characterization of male meiosis and pollen development in rice. Journal of Integrative Plant Biology, 47(6): 734-744, 276. DOI:10.1111/j.1744-7909.2005.00102.x |
Golubovskaya I N, Sitinikova D V. 1980. Three mei mutations in maize impairing the segregation of homologous chromosomes. Genetika, 6: 656-665. |
He Zican, Li Jianqiang, Cai Qing, et al. 2004. Cytogenetic studies on Metasequoia glyptostroboides, a living fossil species. Genetica, 122: 269. DOI:10.1007/s10709-004-0926-x |
Hizume M, Kondo T, Myale T. 1989. Meiosis in pollen mother cells of 15 Cryptomeria japonica clones with special emphasis on the behavior of the 6th chromosome pair heteromorphic to chromomycin A3 band. Jpn J Genet, 64: 287-294. DOI:10.1266/jjg.64.287 |
McClintock B. 1939. The behavior in successive nuclear divisions of a chromosome broken at meiosis. Proc Natl Acad Sci USA, 25: 405-416. DOI:10.1073/pnas.25.8.405 |
Oakley B R, Morris R A. 1981. Beta tubulin in Aspergillus nidulans that blocks microtubule function without blocking assembly. Cell, 24: 837-845. DOI:10.1016/0092-8674(81)90109-4 |
Riha K, McKnight T D, Griffing L R, et al. 2001. Living with genome instability: plant responses to telomerase dysfunction. Science, 291: 1797-1800. DOI:10.1126/science.1057110 |
Romanova L I, Tret'yakova I N. 2005. Specific features of microsporogenesis in the Siberian Larch growing under the conditions of technogenic load. Russian Journal of Developmental Biology, 36(2): 99-104. DOI:10.1007/s11174-005-0017-7 |
Stebbins G L, Ellerton S. 1939. Structural hybridity in Paeonia californica and Paeonia brownie. J Genet, 38: 1-36. DOI:10.1007/BF02982164 |
Thomas D M, Karel R, Dorothy E S. 2002. Telomeres, telomerase, and stability of the plant genome. Plant Molecular Biolog, 48: 331-337. DOI:10.1023/A:1014091032750 |
 2007, Vol. 43
2007, Vol. 43