文章信息
- 郭永泽, 何新华, 李杨瑞, 罗聪.
- Guo Yongze, He Xinhua, Li Yangrui, Luo Cong.
- 黄皮LEAFY同源基因的克隆与序列分析
- Cloning and Sequence Analysis of LEAFY Homologous Gene from Clausena lansium
- 林业科学, 2007, 43(10): 130-133.
- Scientia Silvae Sinicae, 2007, 43(10): 130-133.
-
文章历史
- 收稿日期:2006-09-28
-
作者相关文章
2. 广西农业科学院广西作物遗传改良与生物技术重点实验室 南宁 530007
2. Guangxi Crop Genetic Improvement and Biotechnology Lab, Guangxi Academy of Agricultural Sciences Nanning 530007
LEAFY(简写为LFY)同源基因是控制花分生组织形成的基因之一,并调控植物开花的时间(Weigel et al., 1992),是开花启动所必需的,处于成花相关基因网络中比较关键的位置,为转入生殖发育的中心调节剂, LFY基因不仅参与花分生组织属性的决定,还对抑制成花的EMF基因和TFL1基因起负调作用(王利琳等, 2004)。毛果杨(Populus trichocarpa)、枳橙(Citrus sinensis×P. trifoliata)、烟草(Nicotina tabacum )、菊花(Chryzanthemum morifolium)、水稻(Oryza sativa)等植物中, LFY的超量表达均使花期提前(Weigel et al., 1995; 邵寒霜等, 1999; Ahearn et al., 2001; He et al., 2001; Pena et al., 2001)。如Pena等(2001)将拟南芥(Arabidopsis thaliana)LFY基因转入枳橙, 得到的转基因枳橙当年开花, 且果实正常, 其种子当年播种, 翌年春天即开花结果。马月萍等(2005)对近10年来LFY基因研究进展进行了综合分析,从已报道的文献和GenBank中的序列来看,目前仅从20多种植物中克隆出了LFY的全长基因。研究LFY同源基因对于调节植物开花,了解果树童期的分子调控机制具有十分重要的意义。
无核黄皮(Clausena lansium)系芸香科黄皮属热带亚热带常绿果树,是一种很有发展潜力的经济林果(潘建平等,2007),其开花的分子机制尚未见报道。作者克隆了无核黄皮(Clausena lansium)LFY全长基因(GenBank登录号DQ497006), 比较芸香科(Rutaceae)不同属植物LFY基因的异同, 为研究黄皮开花的分子调控机制, 并通过转LFY基因来培育童期短的黄皮奠定基础。
1 材料与方法 1.1 材料1) 植物材料 采自广西大学园艺系果树标本园, 以无核黄皮的叶片为材料提取基因组DNA。2)菌株和质粒 大肠杆菌(Escherichia coli)TG1和质粒pUC18广西大学园艺生物技术实验室保存。3)化学试剂 pMD18-T载体、dNTP、Taq plus DNA聚合酶、限制性内切酶、GeneRulerTM 100 bp DNA ladderplus均购自TaKaRa公司,XGal、IPTG、氨苄青霉素(Amp)购自上海生物工程公司; 其他试剂均为国产分析纯试剂。4)寡核苷酸引物 根据GenBank上已知甜橙(Citrus sinensis)和枳壳(Poncirus trifoliata)的LFY全长基因(AY338976、AY970823和AY970824)设计1对引物, 上游引物:5′-GAAGGCAATGGACCCGGAAGC-3′,下游引物:5′-ACTCCGCCCAAATCCATCCTT-3′,委托捷瑞生物工程(上海)有限公司合成。
1.2 方法1) 基因组DNA与质粒DNA的提取 用改良CTAB法提取叶片基因组DNA作为模板(He et al., 2005)。碱法小批量抽提质粒(奥斯伯等,2004)。2)PCR扩增 在Thermocycler PCR仪中扩增,采用20 μL反应体系:10 mmol·L-1 Tris-HCl (pH 8.3), 50 mmol·L-1 KCl, 1.5 mmol·L-1 MgCl2, 0.2 mmol·L-1 mixed dNTP, 上、下游引物各0.25 μmol·L-1, 1 U rTaq DNA聚合酶(Takara Biotechnology, Japan), 模板DNA约60 ng。扩增参数为: 94 ℃预变性5 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸2 min,35个循环;72 ℃延伸10 min。3)DNA片段重组入质粒载体 PCR产物在1%的琼脂糖凝胶上电泳, 用Biospin Gel Extraction Kit从凝胶上回收、纯化目的条带。将回收产物连接到pMD18-T载体上, 连接产物转化大肠杆菌TG1菌株感受态细胞, 通过蓝白斑筛选、PCR验证、质粒长度对比和酶切鉴定获得重组质粒(萨母布鲁克等,2002)。4) DNA序列测定与分析 委托捷瑞生物工程(上海)有限公司测序,用GenBank BLAST和CLUSTAL W (1.83)分别进行相似性搜索和同源性分析。
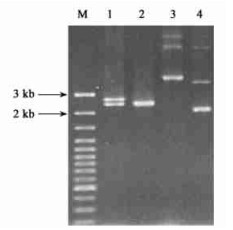
2 结果与分析 2.1 PCR产物的获得和克隆利用自行设计的一对引物,通过PCR扩增,从无核黄皮叶片基因组DNA中扩增出1条约2 300 bp的DNA片段。将该片段纯化后,连接至pMD18-T载体,转化大肠杆菌TG1菌株。通过PCR和双酶切(EcoRⅠ和HindⅢ)鉴定,获得重组质粒,命名为pMD18-ClLFY(图 1)。
|
图 1 凝胶电泳图 Fig. 1 Gel electrophoresis map M.GeneRulerTM 100 bp DNA ladder plus;1.质粒pMD18-ClLFY酶切产物pMD18-ClLFY digested by EcoRⅠ and HindⅢ;2.PCR产物PCR product;3.质粒pMD18-ClLFY Plasmid pMD18-ClLFY;4.PUC18. |
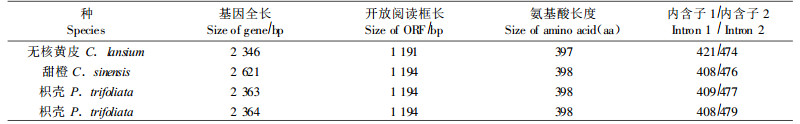
重组质粒pMD18-ClLFY的DNA序列分析结果表明,分离克隆的D NA片段长度为2 346 bp, 通过GenBank BLAST和CLUSTAL W (1.83)序列同源性分析,发现该序列与GenBank中同科(芸香科)的甜橙(AY338976)、枳壳(AY970823、AY970824)的LFY全长基因核苷酸序列同源性分别为93%、93%和92%;进一步分析发现,该DNA片段含有LFY基因完整的编码区序列,由3个外显子组成,其完整的开放阅读框长1 191 bp,编码397个氨基酸(表 1), 与甜橙和枳壳LFY同源基因的氨基酸序列同源性均为95%。由于该DNA片段是根据GenBank上已知的甜橙和枳壳LFY全长基因设计的1对引物扩增出来,而且与已知甜橙和枳壳LFY全长基因的核苷酸和氨基酸同源性分别高达92%以上和95%,因此推测该DNA片段包含有无核黄皮的 LFY全长基因(简写为ClLFY),该基因的核苷酸序列及推测的氨基酸序列如图 2。
|
|

|
图 2 无核黄皮LFY基因(ClLFY)的核苷酸序列及推测的氨基酸序列 Fig. 2 The nucleotide sequence and the deduced amino acid sequence of LFY (ClLFY)from s 小写字母为内含子; ClLFY基因的起始密码子和终止密码子为黑体阴影部分。Intron sequences are given in the small letters; the black letters and shadow parts are the start codon and termination codon of ClLFY. |
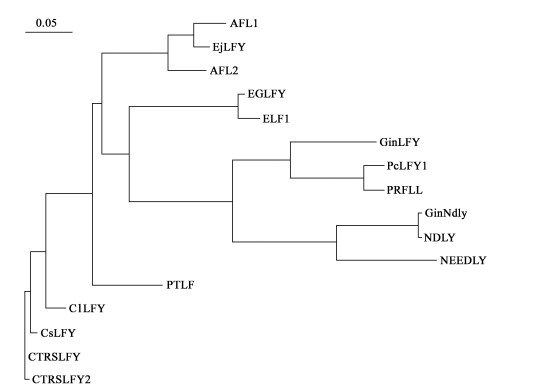
无核黄皮LFY同源基因与GenBank上已知的几种木本果树和林木LFY同源基因的氨基酸序列关系见图 3。从图 3可以看出,无核黄皮、甜橙和枳壳LFY基因编码的氨基酸序列聚类在一起,说明本文克隆的无核黄皮LFY基因和甜橙及枳壳LFY基因亲缘关系最近。
|
图 3 几种木本植物LFY同源基因编码的氨基酸序列系统树 Fig. 3 Phylogenetic relationship of amino acid sequences deduced from LFY homologous genes among several kinds of woody plants AFL1,AFL2:苹果Malus×domestica (DQ535885,DQ535886); ClLFY:无核黄皮C. lansium (DQ497006); CsLFY:甜橙Citrus sinensis(AY338976); CTRSLFY,CTRSLFY2:枳壳Poncirus trifoliata (AY970823,AY970824); EjLFY:枇杷Eriobotrya japonica (AY551183); EGLFY:巨桉Eucalyptus grandis(AY640314); ELF1:蓝桉Eucalyptus globulus subsp. globulus (AF034806); GinLFY, GinNdly, NDLY:银杏Ginkgo biloba (AF108228, AF105111,AY656676); PcLFY1:加勒比松Pinus caribaea (AY640315); PRFLL,NEEDLY:辐射松 Pinus radiata (AF109149,U76757); PTLF:毛果杨Populus trichocarpa (U93196). |
黄皮、甜橙、枳壳是芸香科中不同属的植物,但黄皮与甜橙和枳壳的LFY同源基因核苷酸和氨基酸序列的同源性分别在92%以上和95%,说明LFY基因序列及其编码的氨基酸序列在同科不同属植物中相当保守,本研究正是利用LFY基因的保守性,根据已知甜橙和枳壳的LFY全长基因设计引物克隆出黄皮的LFY全长基因。从研究结果来看,无核黄皮LFY全长基因编码区的核苷酸序列比甜橙和枳壳少3个核苷酸,氨基酸序列比甜橙和枳壳少1个氨基酸,而无核黄皮LFY全长基因第1个内含子比甜橙多13个核苷酸,比枳壳多12~13个核苷酸,第2个内含子的大小差异不大,这一结果是否与无核黄皮的开花特性有关,原因尚不清楚,有待进一步研究。有关无核黄皮开花调控的分子机制尚未见报道,无核黄皮LFY全长基因的克隆为进一步研究和探讨黄皮开花的分子机制打下良好的基础。
奥斯伯F M, 金斯特R E, 塞德曼J G, 等. 2004.精编分子生物学实验指南.4版.马学军, 舒跃龙, 颜子颖, 等译.北京: 科学出版社, 20-22
|
马月萍, 陈凡, 戴思兰. 2005. 植物LEAFY同源基因的研究进展. 植物学通报, 22(5): 605-613. DOI:10.3969/j.issn.1674-3466.2005.05.015 |
潘建平, 袁沛元, 曾杨, 等. 2007. 华南地区黄皮良种、生产现状与发展对策. 广东农业科学, (1): 103-105. DOI:10.3969/j.issn.1004-874X.2007.01.041 |
萨母布鲁克J, 拉塞尔D W. 2002.分子克隆实验指南. 3版.黄培堂, 等译.北京: 科学出版社, 2-137
|
邵寒霜, 李继红, 郑学勤, 等. 1999. 拟南芥LFY cDNA的克隆及转化菊花的研究. 植物学报, 41(3): 268-271. |
王利琳, 梁海曼, 庞基良, 等. 2004. 拟南芥LEAFY基因在花发育中的网络调控及其生物学功能. 遗传, 26(1): 137-142. DOI:10.3321/j.issn:0253-9772.2004.01.026 |
Ahearn K P, Johnson H A, Weigel D, et al. 2001. NFL1, a Nicotiana tabacum LFY-like gene, controls meristem initiation and floral structure. Plant and Cell Physiology, 42: 1130-1139. DOI:10.1093/pcp/pce143 |
He Xinhua, Li Yangrui, Guo Yongze, et al. 2005. Genetic analysis of 23 mango cultivar collection in Guangxi Province revealed by ISSR. Molecular Plant Breeding, 3(6): 829-834. |
He Zuhua, Zhu Qun, Dabi T, et al. 2001. Transformation of rice with the Arabidopsis floral regulator LFY causes early heading. Transgenic Research, 9: 223-227. |
Pena L, Martin-Trillo M, Juarez J, et al. 2001. Constitutive expression of Arabidopsis LFY or APETALA1 genes in citrus reduces their generation time. Nature Biotechnology, 19: 263-267. DOI:10.1038/85719 |
Weigel D, Alvarez D, Smyth D R, et al. 1992. LFY controls floral meristem identity in Arabidopsis. Cell, 69: 843-859. DOI:10.1016/0092-8674(92)90295-N |
Weigel D, Coupland G. 1995. LFY blooms in aspen. Nature, 377: 482-483. DOI:10.1038/377482a0 |
 2007, Vol. 43
2007, Vol. 43