文章信息
- 相昆, 李宪利, 张美勇, 史作安, 王晓芳.
- Xiang Kun, Li Xianli, Zhang Meiyong, Shi Zuo'an, Wang Xiaofang.
- 外源一氧化氮对核桃幼苗抗旱性的影响
- Effects of Exogenous Nitric Oxide on Drought-Resistance of Walnut(Juglans regia)
- 林业科学, 2007, 43(10): 122-126.
- Scientia Silvae Sinicae, 2007, 43(10): 122-126.
-
文章历史
- 收稿日期:2006-09-06
-
作者相关文章
2. 山东省果树研究所 泰安 271000
2. Shandong Institute of Pomology Tai'an 271000
水分胁迫是影响植物生产力最普遍的环境因素之一。在水分胁迫下植物将发生一系列生理反应,其中细胞保护酶活性、膜透性、脯氨酸含量等生理参数可作为评价植物抗旱性强弱的指标(彭立新等,2002;曹慧等,2001;王伟,1998)。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、细胞色素C氧化酶(COX)、抗坏血酸过氧化物酶(APX)和过氧化物酶(POD)是植物细胞内清除活性氧的重要保护酶,当胁迫强度和胁迫时间不超过植物活性氧调控限度时,保护酶可降低活性氧自由基对植物的伤害(赵丽英等,2005)。植物遭受干旱胁迫时,膜脂发生相变,膜透性增加,溶质向胞外渗透,代谢失调,导致植物的死亡。所以,细胞质膜相对透性可反映水分胁迫下植物细胞膜受伤害的程度(王伟,1998;马向丽等,2005)。脯氨酸为细胞渗透调节物质,植物体内脯氨酸的含量在一定程度上反映了植物的抗逆性,其含量的多少与植物抗性呈正相关(马向丽等,2005)。
一氧化氮(nitric oxide,NO)是一种植物内源的调节分子,主要通过一氧化氮合酶(nitric oxide synthase)、硝酸还原酶(nitrate reductase)等酶促途径催化合成,参与植物的生长、发育和防御反应的调节(Beligni et al., 2001; 1999;Garcia-Mata et al., 2001;阮海华等,2001;阮海华等,2004;刘开力等,2004;2005;Akio et al., 2002;Bogdan, 2001)。最近研究结果表明:外源NO能够通过诱导小麦(Triticum aestivum)的气孔关闭来提高其抗旱性(Garcia-Mata et al., 2001);NO对盐胁迫下小麦叶片的氧化损伤具有保护作用(阮海华等,2001);外源NO对盐胁迫下水稻(Oryza sativa)根部脂质过氧化有缓解作用(刘开力等,2005);外源NO可提高1年生黑麦草(Lolioum multiflorum)抗冷性(马向丽等,2005)。总之,作为信号分子,NO对植物抗逆性的作用越来越受重视。但是,目前关于外源NO提高植物抗旱性的报道主要集中于草本植物,涉及木本植物特别是果树的较少。
核桃(Juglans regia)原产于欧洲东南部和亚洲西部,在我国分布面积较广,主要集中于山区种植。山区的特殊环境及年降雨量决定了干旱是制约核桃栽培和产量的重要因素。因此,本研究选用核桃‘香玲’品种为试验材料,通过根部浇施外源一氧化氮供体硝普纳(SNP)溶液,研究NO对水分胁迫下核桃幼苗细胞保护酶活性、膜透性、脯氨酸含量等的影响,探讨NO在果树对水分胁迫适应中的作用机制。
1 材料与方法 1.1 试验材料供试的核桃材料为山东省果树研究所苗圃提供的1年生核桃嫁接苗,品种为‘香玲’,砧木为实生核桃苗。于2006年3月中旬移栽到盆中,盆高40 cm,口径为35 cm,培养土为苗圃熟土和农家肥按质量比3:1混合而成,田间持水量为21.4%。每盆栽植1株。正常供水管理,直到8月15日。8月初,将盆栽苗移至防雨棚中。
1.2 处理方法1) SNP处理 处理所用的NO供体硝普钠([Na2Fe(CN)5]·NO,sodium nitroprusside,SNP)均为现用现配。先用蒸馏水配成1.0 mmol·L-1的母液,再分别稀释为3个SNP处理浓度250、500和1 000 μmol·L-1。8月15日,选取长势整齐一致、无病、无损伤的植株进行SNP处理,各浓度处理量为2 000 mL,把溶液浇到盆中,每个处理3次重复,对照处理为水,每天处理1次,连续处理5 d。
2) 干旱胁迫处理 8月20日,试材进行自然干旱胁迫处理,持续9 d。9 d后重新正常供水,恢复生长。试验分5种处理——A:正常生长对照;B:0 μmol·L-1SNP浇灌+干旱胁迫(CK);C:250 μmol·L-1SNP浇灌+干旱处理(C250);D:500 μmol·L-1SNP浇灌+干旱处理(C500);E:1 000 μmol·L-1SNP浇灌+干旱处理(C1 000)。每个处理3个重复。分别于胁迫后的第1、2、4、5、6、7、9天采取叶片,液氮处理后进行相关指标的测定。第9天采样结束后,立即复水,3 d后采样,进行相关指标的测定。
1.3 测定方法参照骆洪义等(1995)主编的《土壤学实验》测定土壤含水量。分别于胁迫后的第1、2、4、5、6、7、9天采取叶片后,每处理取3个土样,测定土壤含水量。土壤绝对含水量(g·kg-1)=(土壤湿质量-土壤干质量)/土壤干质量×1 000;土壤相对含水量(%)=土壤绝对含水量/田间持水量。算得各天的土壤绝对含水量分别为168、90、71、56、45、36、28 g·kg-1;土壤相对含水量分别为78.5%、42.1%、33.2%、26.2%、21.0%、16.8%、13.1%。参照赵世杰(1998)主编的《植物生理学实验指导》,膜相对透性采用DDS-11A电导仪法测定,以相对电导率表示;超氧化物歧化酶(SOD)的测定采用NBT比色法;脯氨酸的测定采用茚三酮比色法; MDA和CAT的测定采用胡学俭等(2005)的方法。
1.4 数据处理数据通过Microsoft Excel和DPS软件进行统计分析。
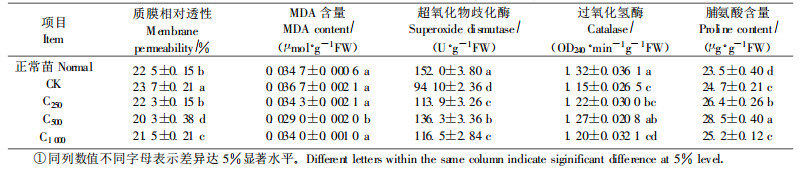
2 结果与分析 2.1 核桃幼苗叶片质膜相对透性及膜脂过氧化的变化水分胁迫对植物的伤害表现为质膜相对透性增加。随着SNP处理浓度的增大,核桃叶片质膜相对透性有不同程度的降低,对照组核桃叶片质膜透性最高,而经过SNP诱导处理后,叶片质膜透性均呈下降趋势。处理前期,土壤含水量较大,各处理组间差异不显著,随着土壤含水量的降低,CK、C250、C500、C1 000各处理组之间差异达显著水平(P < 0.05)。其中,500 μmol·L-1的SNP处理浓度最为有效。与CK相比,在土壤绝对含水量为36 g·kg-1时,经SNP 250、500和1 000 μmol·L-1诱导处理后,质膜相对透性分别降低了12.2%、30.3%和16.2%(图 1A)。
|
图 1 外源NO对干旱胁迫下核桃叶片膜透性和MDA含量的影响 Fig. 1 Effects of exogenous nitric oxide on membrane permeability and MDA content in walnut leaves under drought stress CK:0 μmol·L-1SNP浇灌+干旱胁迫0 μmol·L-1SNP+Drought stress;C250:250 μmol·L-1SNP+干旱胁迫250 μmol·L-1SNP+Drought stress;C500:500 μmol·L-1SNP+干旱胁迫500 μmol·L-1SNP+Drought stress;C1 000:1 000 μmol·L-1SNP+干旱胁迫1 000 μmol·L-1SNP+Drought stress.胁迫第1、2、4、5、6、7、9天的土壤绝对含水量分别为168、90、71、56、45、36、28 g·kg-1。下同。Absolutewater content of soil is 168,90,71,56,45,36 and 28 g·kg-1 after one day, two days, four days, five days, six days, seven days,and nine days, respectively. The same below. |
丙二醛(MDA)是膜脂过氧化代谢产物,其含量的高低可反映逆境下植物细胞膜受伤害的程度。如图 2所示,核桃叶片中的MDA含量随胁迫时间的延长、胁迫强度的加剧而呈增加趋势,表明叶片受到明显的氧化伤害。外源NO处理可缓解MDA的增加趋势。其中在胁迫第7天时,C250、C500和C1 000处理的核桃叶片MDA含量分别比CK减少了17.8%、30.1%和16.4%。经进一步分析检验,不同浓度SNP处理组间MDA含量存在显著差异(P < 0.05),其中500 μmol·L-1SNP处理最显著(图 1B)。
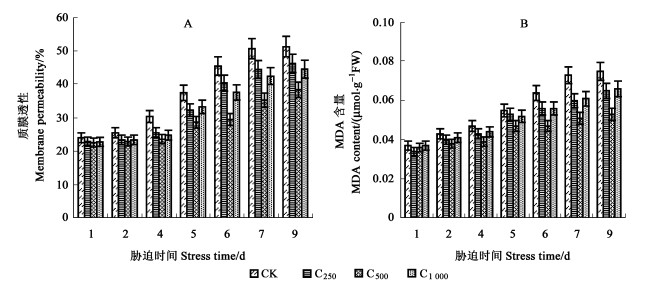
2.2 外源NO处理对水分胁迫下核桃幼苗叶片保护酶活性的影响水分胁迫初期,SOD活性升高,胁迫第4天,SOD酶活性达到最大值,随着胁迫强度的加剧,SOD活性显著下降。SNP处理则显著提高了水分胁迫下的SOD活性。与CK相比,在胁迫第4天,C250、C500和C1 000处理的核桃叶片SOD酶活性分别升高了14.0%、24.7%和15.0%,各处理组间均达到显著水平(P < 0.05)(图 2A)。

|
图 2 外源NO对干旱胁迫下核桃叶片SOD和CAT活性的影响 Fig. 2 Effects of exogenous nitric oxide on SOD and CAT activity in walnut leaves under drought stress |
干旱胁迫下,CK和SNP诱导处理均使得核桃叶片CAT活性先上升后下降,但SNP诱导处理可使CAT活性保持在较高水平。C250、C500和C1 000诱导处理可以快速诱导核桃叶片中CAT活性的升高,并在胁迫第4天均达到最大值(2.37、3.02、2.62 ΔOD240·min-1g-1FW),随着胁迫强度的加剧,酶活性仍保持较高水平;CK处理在胁迫第5天才达到最大值(2.31 ΔOD240·min-1g-1FW),然后迅速下降。进一步分析检验,各浓度处理组间差异显著(P < 0.05)(图 2B)。
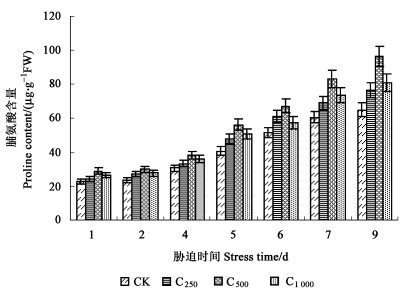
2.3 外源NO处理对水分胁迫下核桃幼苗叶片脯氨酸含量的影响脯氨酸含量的变化如图 3所示。结果表明干旱胁迫引起核桃叶片中脯氨酸的积累,且随着胁迫时间的延长、胁迫强度的加剧而增加,SNP处理后起进一步的促进作用。当土壤绝对含水量降至36 g·kg-1时,经C250、C500和C1 000 SNP处理的核桃苗,其叶片脯氨酸含量分别提高了13.8%、36.9%和21.2%。这表明NO可以提高干旱胁迫下核桃叶片的渗透保护能力。
|
图 3 `外源NO对干旱胁迫下核桃叶片脯氨酸含量的影响 Fig. 3 Effects of exogenous nitric oxide on proline content in walnut leaves under drought stress |
复水后第3天,CK幼苗叶片膜相对透性、MDA含量和脯氨酸高于正常生长苗,而保护酶SOD、CAT活性低于正常生长苗。SNP诱导处理的幼苗质膜相对透性和MDA含量显著低于正常生长苗;脯氨酸含量显著高于正常生长苗;SOD、CAT活性均高于CK,接近正常生长苗的水平。同CK相比,SNP各处理组均达到显著水平(P < 0.05)。其中,C500处理的幼苗差异最显著。表明SNP诱导处理的幼苗在干旱胁迫结束,恢复正常供水后,能更快地恢复到正常水平(表 1)。
|
|
本试验结果表明:外源NO处理降低了干旱胁迫下核桃叶片细胞膜的膜相对透性及丙二醛的积累。说明外源NO对细胞膜具有良好的保护或修复作用,可减轻或防止细胞膜系统的伤害。这可能是外源NO缓和了膜相变化,从而缓解了膜透性增大和离子外渗,进一步证明了NO对细胞膜结构的保护作用。
许多研究表明,NO可以通过调节植物体内的活性氧(ROS)代谢来减轻胁迫伤害。例如外源NO供体SNP可以通过提高小麦叶片的抗氧化能力来缓解盐胁迫条件下的氧化损伤(阮海华等,2001)。本试验结果表明,外源NO处理能显著提高水分胁迫下核桃幼苗SOD和CAT的活性,并使其维持在较高的水平上。在小麦、玉米盐胁迫研究中也得到了类似的试验结果。
研究表明,外源NO缓解膜脂过氧化、提高保护酶系活性,主要在于:一方面NO通过抑制顺乌头酸酶等含非血红素铁类酶活性来参与植物抗性生理反应。植物胞质顺乌头酸酶同工酶被NO氧化失活后,可能转变为铁调节蛋白(iron-regulatory protein,IRP),进而调节体内铁稳态来影响与植物抗性有关的·OH生成(Naverre et al., 2000)。另一方面,NO还可能影响CAT、APX和COX等含血红素铁的酶活性来参与植物体内的生理代谢(马向丽等,2005)。从本试验结果来看,外源NO提高核桃幼苗抗旱性与其抑制幼苗细胞质膜相对透性升高、缓解膜质过氧化、促进脯氨酸积累及提高SOD、CAT等保护酶的活性有关。
脯氨酸积累是植物对干旱胁迫的一种重要的防护机制,脯氨酸不仅作为渗透调节物质,还在消除ROS、提高抗氧化能力、稳定大分子结构、降低细胞酸性以及解除氨毒等方面起重要作用(侯彩霞等,1999)。阮海华等(2001)报道了NO能提高盐胁迫下小麦叶片中的脯氨酸含量,并认为NO通过促进脯氨酸的积累而缓解盐胁迫造成的氧化损伤。本试验研究发现,外源NO处理的幼苗在水分胁迫下其脯氨酸含量增加明显高于对照,脯氨酸能维持细胞的结构和渗透势,使植物具有一定抗性。本试验结果较好地反映了外源NO可缓解水分胁迫对核桃幼苗造成的伤害。
由于NO是植物体内正常代谢的副产物,如果能从调节体内NOS和NR等NO合成酶的活性入手,适当提高内源NO的水平,对有效缓解干旱胁迫对植物的伤害将更具有实践意义。
4 结论外源NO处理降低了干旱胁迫下核桃幼苗质膜相对透性及膜脂过氧化产物丙二醛的积累;3 d的恢复生长后,SNP处理组质膜相对透性及丙二醛含量恢复较对照苗快。其中500 μmol·L-1的SNP处理对细胞膜保护作用最为显著(P < 0.05)。说明外源NO缓和了膜相变化,从而缓解了膜透性增大和离子外漏。外源NO处理可以提高干旱胁迫下1年生核桃叶片SOD和CAT的活性,并使其维持在较高的水平上。幼苗恢复正常生长以后,外源NO处理的幼苗细胞膜透性和膜保护酶活性恢复较对照快。说明外源NO处理的核桃幼苗,受干旱胁迫损伤较轻,细胞膜的修复较快,其中以SNP 500 μmol·L-1处理的幼苗效果显著(P < 0.05)。
外源NO可显著诱导脯氨酸的积累(P < 0.05),表明外源NO可通过调节渗透物质代谢缓解干旱胁迫对核桃幼苗造成的伤害。
曹慧, 兰彦平, 王孝威, 等. 2001. 果树水分胁迫研究进展. 果树学报, 18(2): 110-114. |
侯彩霞, 汤章城. 1999. 细胞相容性物质的生理功能及其作用机制. 植物生理学通讯, 35(1): 1-7. |
胡学俭, 孙明高, 夏阳, 等. 2005. NaCl胁迫对无花果与海棠膜脂过氧化作用及保护酶活性的影响. 西北植物学报, 25(5): 937-943. DOI:10.3321/j.issn:1000-4025.2005.05.016 |
刘开力, 韩航如, 徐颖洁, 等. 2005. 外源一氧化氮对盐胁迫下水稻根部脂质过氧化的缓解作用. 中国水稻科学, 19(4): 333-337. DOI:10.3321/j.issn:1001-7216.2005.04.009 |
刘开力, 凌腾芳, 刘志兵, 等. 2004. 外源一氧化氮供体浸种对盐胁迫下水稻幼苗生长的影响. 植物生理学通讯, 40(4): 419-422. |
骆洪义, 丁方军. 1995. 土壤学实验. 成都: 成都科技大学出版社.
|
马向丽, 魏小红, 龙瑞军, 等. 2005. 外源一氧化氮提高一年生黑麦草抗冷性机制. 生态学报, 25(6): 1269-1274. DOI:10.3321/j.issn:1000-0933.2005.06.006 |
彭立新, 李德全, 束怀瑞. 2002. 园艺植物水分胁迫生理及耐旱机制研究进展. 西北植物学报, 22(5): 1275-1281. DOI:10.3321/j.issn:1000-4025.2002.05.037 |
阮海华, 沈文飚, 叶茂炳, 等. 2001. 一氧化氮对盐胁迫下小麦叶片氧化损伤的保护效应. 科学通报, 46(23): 1993-1997. DOI:10.3321/j.issn:0023-074X.2001.23.015 |
阮海华, 沈文飚, 徐朗莱. 2004. 一氧化氮调节盐胁迫下小麦幼苗根部质膜H+-ATPase和焦磷酸酶活性提高耐盐性. 植物学报, 46(4): 415-422. DOI:10.3321/j.issn:1672-9072.2004.04.005 |
王伟. 1998. 植物水分亏缺的某些生理变化. 植物生理学通讯, 34(5): 388-393. |
赵丽英, 邓西平, 山仑. 2005. 活性氧清除系统对干旱胁迫的生理响应. 西北植物学报, 25(2): 413-418. DOI:10.3321/j.issn:1000-4025.2005.02.034 |
赵世杰. 1998. 植物生理学试验指导. 北京: 中国农业科技出版社.
|
Akio U, Andre T J, Takashi H, et al. 2002. Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice. Plant Sci, 163: 515-523. DOI:10.1016/S0168-9452(02)00159-0 |
Beligni M V, Lamattina L. 2001. Nitric oxide:a non-traditional regulator of plant growth. Trends Plant Sci, 6: 508-509. DOI:10.1016/S1360-1385(01)02156-2 |
Beligni M V, Lamattina L. 1999. Is nitric oxide toxic or protective?. Trends Plant Sci, 4: 299-310. DOI:10.1016/S1360-1385(99)01451-X |
Bogdan C. 2001. Nitric oxide and the regulation of gene expression. Trends Cell Biol, 11: 66-75. DOI:10.1016/S0962-8924(00)01900-0 |
Garcia-Mata C, Lamattina L. 2001. Nitric oxide induces stomatal closure and enhances the adaptive plant responses against drought stress. Plant Physiol, 126(3): 1196-1204. DOI:10.1104/pp.126.3.1196 |
Naverre D A, Wendehenne D, Durner J, et al. 2000. Nitric oxide modulates the activity of tobacco aconitase. Plant Physiol, 122: 573-582. DOI:10.1104/pp.122.2.573 |
 2007, Vol. 43
2007, Vol. 43