文章信息
- 许秀玉, 施季森, 席梦利, 陈建新, 沈烈英, 戴永梅.
- Xu Xiuyu, Shi Jisen, Xi Mengli, Chen Jianxin, Shen Lieying, Dai Yongmei.
- 墨西哥落羽杉离体培养及再生体系的建立
- In Vitro Culture and Plant Regeneration System of Taxodium mucronatum
- 林业科学, 2007, 43(10): 40-44.
- Scientia Silvae Sinicae, 2007, 43(10): 40-44.
-
文章历史
- 收稿日期:2006-08-29
-
作者相关文章
2. 广东省林业科学研究院 广州 510520;
3. 上海市林业站 上海 200072
2. Guangdong Forest Research Institute Guangzhou 510520;
3. Shanghai Forestry Management Station Shanghai 200072
墨西哥落羽杉(Taxodium mucronatum)为半常绿树种,冠形雄伟秀丽;木材纹理直,极耐腐蚀;能耐低温,耐水淹,耐干旱瘠薄,抗台风,抗病虫害,是平原水网地区优良的园林绿化、用材及防护林树种(汪企明等,1999;Krauss et al., 1999)。目前,国内外对落羽杉属树种的研究多是集中在引种试验,种源、家系选育,杂交育种,无性扦插繁殖,种子处理、育苗技术,遗传变异及其分子生物学,生理生化等方面(汪企明等,1999;周玉珍等,2006a;2006b;张玉梅等,2005;尹晓明等,2002;陈云鹏等,2002),对落羽杉属树种组织培养方面的研究尚未见报道。此外,墨西哥落羽杉在原产地为秋季开花,但引种到我国后在春季开花,数十年生大树往往只见开雄花和雌花,却不见结实。由于这些原因,墨西哥落羽杉未在我国得到大面积推广。植物组织培养技术是快速繁殖木本植物,尤其是繁殖优良树种的理想途径,同时也是通过遗传操作获得转基因植物,从而改良树种的前提条件(王明庥,2001;黄健秋等,1995)。其离体培养及再生体系的建立将大大推进墨西哥落羽杉在我国的推广应用,并为以后的遗传改良、遗传转化研究工作奠定基础。
1 材料与方法 1.1 材料以1.5~2 cm长幼苗作为建立试管无性系的初始外植体。
1.2 方法 1.2.1 外植体处理切下的幼苗先用无菌水冲洗3~5次,然后投入0.5% NaClO(出厂含氯5%~6%的消毒液,使用时稀释10倍)中,浸泡6 min,无菌水冲洗5次。将幼苗倾斜插入诱导与分化培养基中。
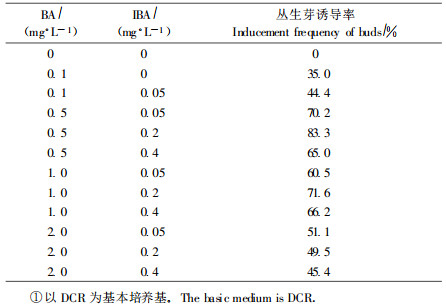
1.2.2 丛生芽的诱导与分化由于高盐的MS培养基对多数针叶树的器官分化不利(黄健秋等,1994),本试验选择DCR为基本培养基,以DCR0(不加任何植物激素)为对照,附加BA 0.1、0.5、1.0、2.0 mg·L-1,IBA 0.05、0.2、0.4 mg·L -1,去除BA浓度低于IBA的植物激素组合,另附加蔗糖30 mg·L-1,琼脂6.2 g·L-1,调节pH值为5.8,在121 ℃下高压灭菌16 min,培养温度为(25±3) ℃,光照时间16 h·d-1,光照度2 000 lx左右。培养25~30 d后统计各处理丛芽诱导率,并观察小植株生长状况。
1.2.3 试管苗的伸长选择DCR为基本培养基,以DCR0为对照,分别添加G ln(谷氨酰胺)、GA3(赤霉素)、NAA等植物生长调节物质,对比不同生长调节物质对试管苗伸长的影响。在预备试验基础上,选择各生长调节物质的最佳浓度。培养条件同上。培养30~40 d后检测各处理的平均苗高,并观察小植株生长状况。
诱导出的丛生芽转入伸长培养基中继代培养时,要连同外植体(幼苗)一起继代,并剪去外植体基部老化的组织。诱导分化出的丛生芽在伸长培养基中培养40~60 d,即可长至2~6 cm,这时可将较长(4~6 cm)的芽切下转入生根培养基中诱导生根,将较小(2~3 cm)的芽切下转入分化培养基中继续诱导分化丛生芽,如此循环培养,以建立试管无性系。
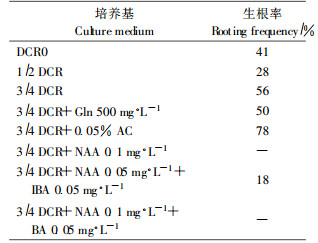
1.2.4 试管苗的生根与移栽以DCR、1/2 DCR(大量元素为原来的1/2)、3/4 DCR(大量元素为原来的3/4)为基本培养基,不添加任何植物生长调节物质或附加A C(活性炭)0.05%、Gln 500 mg·L-1,以及不同浓度的IBA、BA、NAA等,另附加蔗糖20 mg·L-1,琼脂6.2 g·L-1,培养条件同上。
当诱导出的根长至2~4 cm时即可进行试管苗的移栽。移栽前将已生根的完整小植株先炼苗3~7 d,取出苗用清水洗去琼脂,移植于以体积比1:1的珍珠岩和蛭石混合的基质中,浇足水置于温室中,适度遮荫,保持湿度。
2 结果与分析 2.1 芽的诱导与分化将幼苗接种于诱导分化培养基中7 d以后,基部就开始膨大,培养14 d后,这些膨大部位开始出现黄色瘤状突起,继续培养,黄色瘤状突起逐渐转绿,最终发育成肉眼可见的小芽。培养25~30 d后,平均每个外植体可诱导出2~5个芽,平均芽长0.3~0.5 cm。
BA 0.1~2.0 mg·L-1和IBA 0.05~0.4 mg·L-1的各种组合都能诱导分化出丛生芽(表 1),外植体在DCR0中未见有芽的分化,在含有BA 0.1 mg·L-1的培养基中诱导分化率达35%,这表明BA的加入促进了芽的诱导分化。当BA浓度达到1.0 mg·L-1时,植株针叶卷曲、发脆,幼苗基部还会产生大量红色愈伤组织,大部分分化出的小芽被愈伤组织包围,随着时间的推移逐渐转化为透明、多水的玻璃化芽,只有通过及时去除培养基中的植物激素才可使其恢复正常生长。当BA浓度达到2.0 mg·L-1时,诱导率大大降低,且诱导出的芽玻璃化,甚至形成白化芽、球状芽,即使去除培养基中的植物激素也很难使其恢复正常生长。
|
|
试验结果表明,墨西哥落羽杉芽的诱导对细胞分裂素浓度变化较为敏感,适宜浓度的分裂素与生长素配合使用能够提高外植体的诱导分化率,促进丛生芽的进一步发育,其中在DCR+ BA 0.5 mg·L-1+IBA 0.2 mg·L-1的培养基上外植体的诱导率最高,达83.3%,且小芽发育正常,生长旺盛(图 1)。

|
图 1 丛生芽的诱导 Fig. 1 Buds inducement |
诱导出的丛生芽在DCR0或含有Gln培养基中都能够正常生长,叶色浓绿,植株健壮(图 2)。其中在DCR+Gln 500 mg·L-1的培养基中生长最为迅速,平均苗高可达5.4 cm(表 2),这表明Gln能够促进试管苗的伸长生长。NAA的加入不能有效促进芽的伸长,培养15d后,丛生芽开始玻璃化。GA3的存在则明显抑制了芽的伸长生长,导致其生理状态大大降低,逐渐干枯死亡。

|
图 2 不定芽的伸长 Fig. 2 Adventitious buds enlongation |
|
|
选择4~6 cm高、叶色正常、茎干粗壮的试管苗用以生根。试管苗在生根培养基中培养40~ 60 d后,基部可萌发出1~3条灰白色的根(图 3),不同的植物生长调节物质对试管苗生根效果不一(表 3)。

|
图 3 试管苗的生根 Fig. 3 Plantlet rooting |
|
|
试管苗在含有不同浓度NAA、IBA以及BA等植物激素的培养基中生根效果较差,生根率低,且培养20 d后,在试管苗基部会产生大量灰褐色或淡红色愈伤组织,根从愈伤组织处萌发,这样形成的根在移栽的过程中容易脱落,大大降低移栽成活率。
试管苗在不添加任何植物生长调节物质的DCR0、1/2DCR、3/4DCR基本培养基中,或附加0. 05%AC、Gln 500 mg·L-1的3/4 DCR培养基中都可以不产生愈伤组织而从试管苗基部直接诱导生根,其中以3/4 DCR+0.05%AC培养基诱导生根效果最好,生根率可达78%。
根长达2~4 cm时开瓶炼苗3~7 d后即可进行移栽(图 4)。移栽成活率较低,约20%左右。

|
图 4 试管苗的移栽 Fig. 4 Transplanting of plantlets |
针叶树种离体快繁时,通常使用BA与IBA,或BA与NAA的组合来诱导不定芽(唐巍等,1997)。对于墨西哥落羽杉来说,丛生芽的诱导对激素较为敏感,适宜分化的激素浓度范围很窄,其中以0.5 mg·L-1 IBA与0.2 mg·L-1 NAA配合诱导效果最好。较低浓度BA (0.1 mg·L-1)诱导率低,诱导出的芽苗纤弱,较高浓度BA(≥1.0 mg·L- 1 )诱导出的芽多玻璃化,甚至形成白化芽、球状芽,严重影响后期的伸长生长。诱导出丛生芽后,需要及时去除培养基中的植物激素,否则这些诱导出的芽紧密簇生在一起,不利于伸长生长或极易形成玻璃化芽。
3.2 试管苗伸长过程中的“亲体效应”试验发现:墨西哥落羽杉芽增殖、伸长过程中,如果单独把诱导出的未伸长的芽从亲体(外植体)上切割下来进行伸长培养,这些芽通常不能实现伸长生长,培养一定时间以后,芽苗枯黄,逐渐死亡;而将这些芽连同亲体(外植体)一起转入伸长培养基中伸长培养,这些芽通常能实现伸长生长,笔者把这种现象称为“亲体效应”,即亲体组织对于芽的存活和生长起着重要作用。对于“亲体效应”产生的原因和克服的方法还有待于进一步研究。在本研究中,将诱导出的丛生芽连同外植体一起转入伸长培养基中,生长效果不错,经过1~2次继代可长至2~6 cm长,这时可将较长的芽剪下用于生根,将较小的芽丛连同外植体继续培养,20~30 d后又可切割其上伸长的嫩枝。
3.3 “有效芽”与“无效芽”由于杉科(Taxodiaceae)树种的生物学特点,墨西哥落羽杉具有2种不同形态的小枝,一种为具有潜伏芽的有芽小枝,另一种为无潜伏芽的“无芽小枝”,后者实际上为羽状复叶的一种特殊类型,为枝叶发育的最顶端形态,已失去了再分化的能力,许多学者忽视了这点,因此在杉科植物组织培养中受到挫折。笔者认为,墨西哥落羽杉组织培养中存在2种不同的芽。一种芽伸长后节间较长,针叶在茎干上呈螺旋状排列,抽长后的小枝直立生长,有较强的顶端优势,这种芽暂且称为“有效芽”。用“有效芽”来进行针叶基潜伏芽的诱导,诱导分化率高,诱导效果好,在生根诱导时,能诱导出根的试管苗都是这种芽发育而来的。另一种芽伸长后节间较短,针叶在茎干上呈羽状2列排列,抽长的小枝倾斜生长,甚至表现为匍匐生长,位置效应明显,且生长到一定长度后就停止生长,这种芽为“无效芽”。“无效芽”几乎不能诱导分化针叶基潜伏芽,在进行生根诱导时极易干枯死亡,无论在什么培养基中这种芽都不能诱导生根。
“有效芽”与“无效芽”在发育最初阶段在形态上没有什么差异,肉眼上无法区分开来,只有当它们抽长至2.5~3.0 cm以上时才能分辨出来。试验发现,虽然不附加任何植物激素的培养基也能诱导腋芽抽梢,并使腋芽伸长生长,但是这些芽多是“无效芽”,“有效芽”所占的比例较小,并且随着继代次数的增加,“无效芽"所占比例随之增加;而附加低浓度植物激素的培养基诱导腋芽抽梢后形成“有效芽"的比例大大提高。由此可以推测:最初发育阶段的“有效芽"与“无效芽"不是绝对的,二者是可以转换的,植物激素在一定程度上可以提高“有效芽"所占的比例。本试验以刚萌发幼苗为外植体诱导出的针叶基潜伏芽,“有效芽"占90%以上。
3.4 不同植物生长调节物质对试管苗伸长的影响一般针叶树组织培养中芽形成后,往往也是需要更换培养基,才能促进芽的茎叶的进一步伸长(Okamura et al., 1995;Becwar et al., 1990)。在白皮松(Pinus bungeana)成熟胚培养中添加活性炭和GA3对不定芽生长具有明显促进作用(黄健秋等,1994),但在墨西哥落羽杉试管苗伸长培养时使用GA3不仅不能促进其伸长,而且还会对其造成毒害作用,表现为在相同培养条件下,诱导出的丛生芽在附加GA3的培养基中培养20 d后小芽从基部向上逐渐变褐、死亡,而在不添加任何生长调节物质的对照中(DCR0),丛生芽伸长较为迅速,发育正常。
谷氨酰胺(Gln)常用于针叶树种直接器官发生(唐巍等,1997)或体胚发生过程中胚性愈伤组织的诱导、保持和增殖(吕守芳等,2005;黄健秋等,1995),大量证据表明Gln是一种条件性必需氨基酸,中性无毒,容易通过细胞膜,是氨的主要运输形式,又是合成含氮生物物质的氮源(张军民等,1999)。本研究中,诱导出的丛生芽在DCR+Gln 500 mg·L -1的培养基中长势最为旺盛,这可能是由于谷氨酰胺这类含氮化合物能够调节墨西哥落羽杉某些生理生化过程,对芽的发育极为有利。
3.5 试管苗的生根试验发现,试管苗的生长状态、生理代谢状态与能否生根有密切关系。选择节间较长、生长旺盛、茎干较粗壮的小苗诱导生根过程往往容易完成。NAA和IBA是植物组织培养中广泛应用于诱导不定根的生长素(Prehn et al., 2003;Saborio et al., 1997;Schestibratov et al., 2003)。但对墨西哥落羽杉来说,利用植物激素诱导生根效果不好,易在根茎相接处形成愈伤组织,影响试管苗移栽成活率。活性炭在针叶树种组织培养中应用已很普遍,它的参与对植物器官发生、体细胞胚发生产生着正效应或负效应(李林等,2005;阙国宁等,1999)。本研究中,活性炭(AC)有利于提高墨西哥落羽杉试管苗生根率。其作用机制一般认为是通过吸附作用而发生(陈永勤等,1999),并为根的形成提供了黑暗的生长环境。
陈永勤, 朱蔚华, 吴蕴祺. 1999. L-谷氨酰胺和桂皮酸对云南红豆杉愈伤组织生长的影响. 中草药, 30(7): 542-544. DOI:10.3321/j.issn:0253-2670.1999.07.032 |
陈云鹏, 潘士华, 张建军, 等. 2002. 利用RAPD检测技术推测杂交落羽杉群落间的亲缘关系. 复旦学报, 41(6): 641-645. DOI:10.3969/j.issn.0427-7104.2002.06.010 |
黄健秋, 卫志明. 1994. 松属树种的组织培养和原生质体培养. 植物学通报, 11(1): 34-42. |
黄健秋, 卫志明, 许智宏. 1995. 马尾松成熟合子胚的体细胞胚胎发生和植株再生. 科学通报, 40(1): 73-75. |
李林, 黄忠良, 唐德瑞, 等. 2005. 蔗糖、活性炭对美国黄松不定芽增殖和生长的影响. 福建林学院学报, 25(3): 260-263. DOI:10.3969/j.issn.1001-389X.2005.03.016 |
吕守芳, 张守攻, 齐力旺, 等. 2005. 日本落叶松体细胞胚胎发生的研究. 林业科学, 41(2): 48-53. |
阙国宁, 房建军, 葛万川, 等. 1999. 火炬松、湿地松、晚松组培繁殖研究. 林业科学研究, 10(3): 227-232. |
唐巍, 欧阳藩, 郭仲琛. 1997. 针叶树体细胞无性系研究和应用进展. 生物工程进展, 17(4): 2-9. |
王明庥. 2001. 林木遗传育种学. 北京: 中国林业出版社, 278-286.
|
汪企明, 王伟. 1999. 落羽杉. 南京: 南京出版社, 1-65.
|
尹晓明, 殷云龙, 陈永辉, 等. 2002. 中山杉302和墨西哥落羽杉及其回交一代的同工酶分析. 植物资源与环境学报, 11(3): 59-61. DOI:10.3969/j.issn.1674-7895.2002.03.013 |
张军民, 高振川. 1999. 谷氨酰胺营养生理研究进展. 氨基酸和生物资源, 21(2): 52-55. |
张玉梅, 谭宁华, 黄火强, 等. 2005. 墨西哥落羽杉中三个活性双黄酮研究. 云南植物研究, 27(1): 107-110. DOI:10.3969/j.issn.2095-0845.2005.01.014 |
周玉珍, 李火根, 李博, 等. 2006a. 墨西哥落羽杉优良单株选择及无性繁殖. 南京林业大学学报, 30(4): 29-32. |
周玉珍, 李火根, 张燕梅, 等. 2006b. 墨西哥落羽杉无性系RAPD指纹图谱的构建. 南京林业大学学报, 30(5): 29-33. |
Becwar M R, Nagmani R, Wann S R. 1990. Initiation of embryogenic culture and somatic embryo development in loblolly pine. Can J For Res, 20: 810-817. DOI:10.1139/x90-107 |
Krauss K W, Chambers J I, Allen J A, et al. 1999. Root and shoot responses of Taxodium distichum seedlings subjected to saline flooding. Environmental and Experimental Botany, 41(1): 15-23. DOI:10.1016/S0098-8472(98)00051-3 |
Okamura M, Kondo T. 1995. Manual for tissue culture of pine. Bulletin of the National Forest Tree Breeding Center, 13: 139-143. |
Prehn D, Serrano C, Mercado A, et al. 2003. Regeneration of whole plants from apical meristems of Pinus radiata. Plant Cell Tiss Org Cult, 73: 91-94. DOI:10.1023/A:1022615212607 |
Saborio F, Dvorak W, Donahue J, et al. 1997. In vitro regeneration of plantlets from mature embryos of Pinus ayacahuite. Tree Physiol, 17: 787-796. DOI:10.1093/treephys/17.12.787 |
Schestibratov K A, Mikhailov R V, Dolgov S V. 2003. Plantlet regeneration from subculture nodular callus of Pinus radiate. Plant Cell Tiss Org Cult, 72: 139-146. DOI:10.1023/A:1022296028951 |
 2007, Vol. 43
2007, Vol. 43