文章信息
- 柯世省, 金则新.
- Ke Shisheng, Jin Zexin.
- 干旱胁迫对夏腊梅叶片脂质过氧化及抗氧化系统的影响
- Effects of Drought Stress on Lipid Peroxidation and Antioxidant System in Leaves of Calycanthus chinensis
- 林业科学, 2007, 43(10): 28-33.
- Scientia Silvae Sinicae, 2007, 43(10): 28-33.
-
文章历史
- 收稿日期:2006-10-18
-
作者相关文章
 ) and content of hydrogen peroxide (H2O2), membrane permeability of leaf cells and malondialdehyde (MDA) content increased, while net photosynthetic rate (Pn), maximal photochemistry efficiency (Fv/Fm) and apparent quantum yield (AQY) decreased to different extents. The present conclusion is that C. chinensis growth could be inhibited by enhancing lipid peroxidation under severe and extremely severe drought stress.
) and content of hydrogen peroxide (H2O2), membrane permeability of leaf cells and malondialdehyde (MDA) content increased, while net photosynthetic rate (Pn), maximal photochemistry efficiency (Fv/Fm) and apparent quantum yield (AQY) decreased to different extents. The present conclusion is that C. chinensis growth could be inhibited by enhancing lipid peroxidation under severe and extremely severe drought stress. 活性氧包括超氧阴离子(
夏腊梅(Calycanthus chinensis)是浙江省特有的被列为国家二级保护的第三纪孑遗濒危物种,在我国是夏腊梅属的唯一代表,仅间断分布于浙江省临安市西部狭小的范围内和浙江省天台县大雷山(郑朝宗,2005)。夏腊梅花朵美丽,分类地位独特,分布区狭窄,居群数目少。从该种被发现以来的近40年间,人们在形态解剖、分类地位、染色体、植物化学及遗传多样性等少数几方面进行过研究(周世良等,2002;Lasseigne et al., 2001;李林初,1986;刘洪谔等,1996;Vogel, 1998;徐耀良等,1997;Li et al., 2006)。在分布地的生长季节,夏腊梅会受到季节性、短时和程度不等的干旱胁迫,并表现出一定的抗旱性(张宏伟等,1997),但未见干旱胁迫对夏腊梅生理特性影响的研究报道。本文采用盆栽控水法,模拟不同程度的土壤水分状况,研究土壤干旱对夏腊梅叶片脂质过氧化及抗氧化体系的影响,为夏腊梅的保护和培育提供理论依据。
1 材料与方法 1.1 试验材料及设计试验材料为盆栽的夏腊梅2年生实生苗,平均株高32.6 cm,分枝3~4条,每枝条4~5对叶片,生长状况良好一致。盆栽用塑料花盆上口和下口直径分别为23 cm和15 cm,高度23 cm,每盆定植苗木1株。盆栽用土采自校内树木园表层土(0~15 cm),有效氮、磷、钾的含量分别为164、62、75 mg·kg-1,pH 6.3,有机质含量3.5%,土壤饱和含水量29.3%。每个花盆均匀埋入4根内径0.5 cm玻璃管作为补水孔,玻璃管下端埋入土层1/3。设置5个水平干旱处理:对照(土壤含水量为饱和含水量的75%~80%,下同)、轻度胁迫(60%~6 5%)、中度胁迫(50%~55%)、重度胁迫(35%~40%)和深度胁迫(25%~30%),分别用C K、W1、W2、W3和W4表示,每种胁迫水平处理3盆。为避免太阳曝晒给试验结果带来的影响,将盆栽置于一层黑色遮阳网覆盖的防雨棚下(透光率约为全光照的30%)。7月初开始按试验设计进行水分处理,浇透水后使土壤水分自然消耗,每天下午6:00称整个花盆的质量,计算土壤相对含水量,达到某个设定标准后,用称质量补水法控制土壤相对含水量在设定范围内。深度干旱胁迫下,夏腊梅叶片在午间明显萎蔫。达到轻度、中度、重度和深度水分胁迫标准分别约需4 d、7 d、11 d和15 d,全部干旱处理达到设定标准再持续10~12 d后测定顶叶下数第3对成熟叶各项指标。干旱处理(包括对照)期间夏腊梅高度没有明显变化,也没有新叶长出。
1.2 研究方法叶片相对含水量(RWC)用饱和含水量法测定(Gindaba et al., 2004);按中国科学院植物生理研究所等(1999)的方法测定超氧阴离子产生速率、抗坏血酸含量、质膜相对透性、丙二醛(MDA)含量、游离脯氨酸含量、类胡萝卜素含量。超氧化物歧化酶(SOD)活性用NBT法测定(Giannopolitis et al., 1977),以单位时间内抑制氮蓝四唑光化还原50%为一个酶活性单位(U);过氧化氢含量的测定采用林植芳等(1988)的方法;还原型谷胱甘肽的测定采用DTNB比色法(黄爱缨等,1999);愈创木酚比色法测定过氧化物酶(POD)活性(Wu et al., 2002),以每分钟A470变化值表示酶活性大小;过氧化氢酶(CAT)活性采用比色法测定(Türkan et al., 2005),以每分钟A240的变化值表示酶活性大小。另外,为排除因叶片含水量不同而造成的比较误差,在测定叶片含水量后,将上述指标统一换算为单位干质量含量。
叶片净光合速率(Pn)和表观量子效率(AQY)在实验室控制条件下连体测定(柯世省等,2002),用LCA4型光合作用仪(ADC,UK)控温装置控制叶室温度为(30±1) ℃,在光合有效辐射为(600±20) μmol·m-2s-1下测定净光合速率;调节光合有效辐射为0~300 μmol·m-2s-1,梯度为20~30 μmol·m-2s-1,每梯度光照持续3 min至仪器读数稳定,测得从低到高一系列光合有效辐射下叶片的净光合速率,从净光合速率-光合有效辐射曲线的初始斜率求得表观量子效率。日出前,以OS30P型叶绿素荧光测定仪(OPTI-sciences,USA)采用快速动力学法测定光系统Ⅱ(PSⅡ)最大光化学效率(Fv/Fm),光强模式设为Mod 2,测定前将叶片夹入暗适应夹2 h。
1.3 数据的统计分析试验设3个重复,对试验结果进行方差分析,差异显著性运用Duncan's检验法进行多重比较。
2 结果与分析 2.1 干旱胁迫对叶片相对含水量的影响叶片相对含水量常用来表示植株所受干旱胁迫的程度。在不同程度的干旱胁迫下,夏腊梅叶片相对含水量(RWC)明显降低(图 1),RWC与Hsiao(1973)划分水分胁迫程度的标准相符。
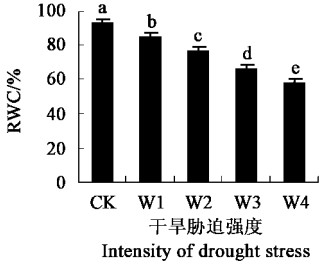
|
图 1 干旱胁迫对叶片相对含水量(RWC)的影响 Fig. 1 Effects of drought stress on relativewater content (RWC) of leaves CK:对照Control; W1:轻度胁迫Mild stress; W2:中度胁迫Moderate stress; W3:重度胁迫Severe stress; W4:深度胁迫Extremely severe stress.不同的小写字母代表干旱胁迫之间差异显著(P<0.05,Duncan's检验) Different small letters show s ignificant difference among drought stresses (P<0.05,Duncan's test).下同The same below. |
图 2表明,随着干旱胁迫的加重,夏腊梅叶片超氧阴离子(

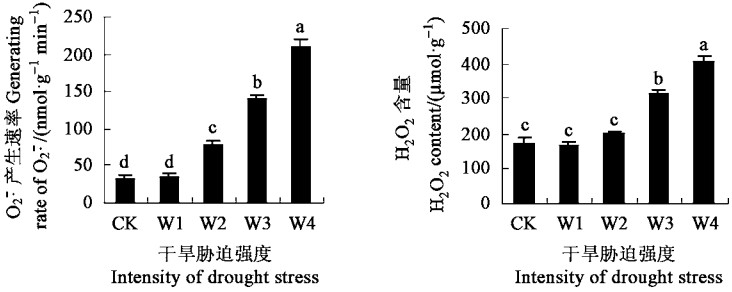
|
图 2 干旱胁迫对  |
MDA是植物遭受逆境伤害时膜脂过氧化的产物(Hodges et al., 1999),可使蛋白质和核酸变性,导致膜流动性降低,膜透性增强,细胞功能下降,严重时导致细胞死亡。所以,MDA含量是判断细胞遭受胁迫程度大小的常用指标。夏腊梅受到重度及以上程度干旱胁迫时,由于细胞中活性氧大量积累,加速了膜脂过氧化作用,使过氧化产物增多,MDA含量显著提高,膜相对透性增大(图 3)。
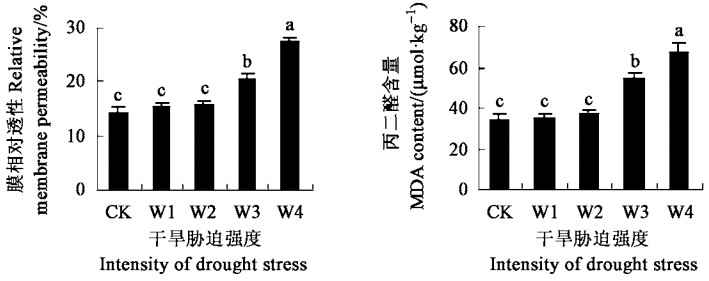
|
图 3 干旱胁迫对膜相对透性和丙二醛含量的影响 Fig. 3 Effects of drought stress on relative membrane permeability and MDA content |
植物体内抗氧化体系可分为保护酶和非酶促的抗氧化剂两大类。当植物受到水分胁迫时,体内产生大量的活性氧,此时抗氧化剂含量和保护酶的活性便会发生相应的变化。
2.3.1 干旱胁迫对抗氧化剂含量的影响如图 4所示,在轻度和中度干旱胁迫下,抗坏血酸(Vc)、还原型谷胱甘肽(GSH)含量上升;而在重度和深度胁迫下,两者含量下降。随着干旱胁迫的加重,类胡萝卜素(Car)含量一直下降,而游离脯氨酸(Pro)含量一直升高。
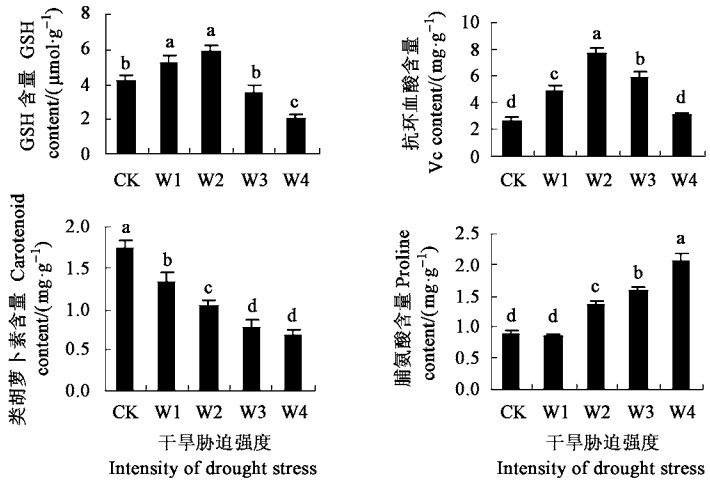
|
图 4 干旱胁迫对抗氧化剂含量的影响 Fig. 4 Effects of drought stress on antioxidant contents |
从图 5看出,在重度及以下程度干旱胁迫下,SOD、POD活性随着胁迫加重而升高,但在深度胁迫下,两者活性均有所降低,表明一定强度的干旱胁迫可诱导SOD、POD基因增加表达,酶活性上升,但严重的干旱胁迫则抑制了SOD、POD活性。CAT活性随着干旱胁迫的加重而显著地降低。
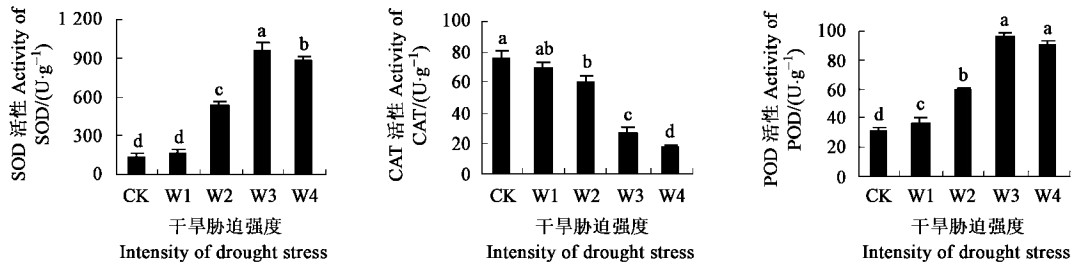
|
图 5 干旱胁迫对保护酶活性的影响 Fig. 5 Effects of drought stress on activities of cell defense enzymes |
干旱胁迫严重影响植物的光合作用,而光合作用的抑制则增加了激发能的过剩,提高了活性氧水平,加剧膜脂的过氧化作用。光合量子效率是植物光合机构每吸收1 mol光量子所同化CO2的量,表观光合量子效率(AQY)是以照射到光合机构上的光量子数计算,可以准确反映光合机构光合功能的变化。Fv/Fm(PSⅡ最大光化学效率)反映PSⅡ反应中心的光能转换效率(Lima et al., 2002)。图 6表明,中度干旱胁迫下,夏腊梅净光合速率明显降低,但表观量子效率和Fv/Fm没有发生明显变化,暗示中度干旱胁迫可能还未对光合机构造成损伤,这是由于此时尽管超氧阴离子产生速率增加,但植物的抗氧化能力也随之增强,体内活性氧的毒害作用没有明显加重。中度干旱胁迫下净光合速率的降低只是夏腊梅对干旱环境的正常响应,如干旱引起叶片气孔部分关闭以减轻蒸腾作用,同时使进入叶肉组织的CO2的量减少,导致净光合速率降低,如果及时补充水分,净光合速率就可能恢复到正常水平。而在重度和深度干旱胁迫下,夏腊梅净光合速率、表观量子效率和Fv/Fm都明显降低,表明由于活性氧的大量积累导致了光合机构的损伤,光合作用受到严重抑制。
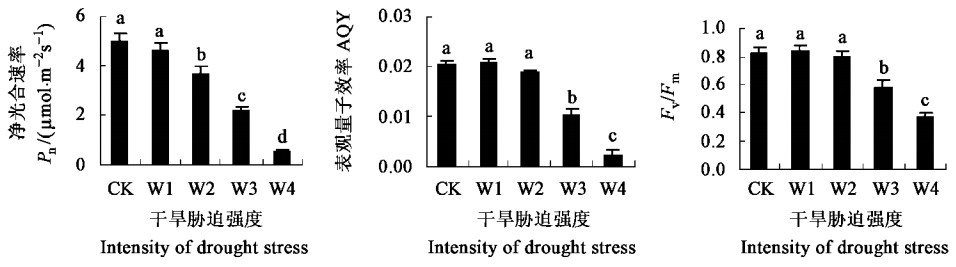
|
图 6 干旱胁迫对光合作用的影响 Fig. 6 Effects of drought stress on photosynthesis |
关于植物的抗旱机制,自由基引起的膜伤害学说(Mehdy,1994)日益受到人们的重视。SOD、CAT和POD是细胞内清除活性氧的主要保护酶,SOD歧化超氧阴离子成为H2O2,CAT和POD将H2O2转变为H2O而起到解毒作用。在植物正常生长的条件下,它们彼此协调,使生物体内活性氧维持在较低水平,不会引起植物损伤。当处于水分胁迫时,植物体内活性氧产生和清除的平衡遭到破坏,从而加速活性氧的积累,当其浓度超过一定阈值时,就会使植物细胞内的大分子物质发生过氧化,影响植物的正常生长。因此,对活性氧的清除能力是决定细胞对胁迫抗性的关键因素(夏新莉等,2000)。植物细胞内活性氧的有效清除还需要抗氧化剂共同作用。抗坏血酸不仅可以在Hallwell-Asada循环中作为抗坏血酸过氧化物酶的底物,还可以作为抗氧化剂直接清除活性氧,在减少膜脂过氧化方面有重要作用。还原型谷胱甘肽中含有巯基,容易与有害的氧化剂作用,保护含巯基的蛋白。类胡萝卜素存在于叶绿体内,一方面阻止激发态叶绿素分子的激发能从反应中心向外传递,另一方面也保护叶绿素分子免遭光氧化损伤,类胡萝卜素含量降低,对过剩激发能的耗散减弱,使活性氧增加。脯氨酸是水溶性最大的氨基酸,被认为是有效的渗透调节物质,有助于提高植物细胞或组织的持水能力以增强抗旱性。Smirnoff(1993)证实外源脯氨酸对活性氧具有清除作用,植物体内脯氨酸的积累被认为很可能是植物抗氧化胁迫的一种反应(蒋明义等,1997)。
试验结果表明,干旱胁迫引起夏腊梅净光合速率下降,CO2同化减少,导致吸收的光能过剩,结果加速形成活性氧。活性氧可破坏光合机构和电子传递,抑制光合作用,降低表观量子效率和最大光化学效率。夏腊梅在中度干旱胁迫下,净光合速率和类胡萝卜素含量降低,超氧阴离子产生速率增大,同时SOD活性上升,由超氧阴离子转化为H2O2的量必然增多,但随着POD活性升高和强抗氧化剂还原型谷胱甘肽及抗坏血酸含量的增加,植物对H2O2的清除能力增强,使H2O2等活性氧的含量没有出现明显的同步升高,因此MDA含量、质膜透性、光合作用的表观量子效率和最大光化学效率都没有发生明显的变化。在重度胁迫下,超氧阴离子产生速率继续增大,SOD活性也进一步上升,而CAT活性和还原型谷胱甘肽及抗坏血酸含量大幅下降,尽管POD活性上升明显,但活性氧的增加超出了细胞的清除能力,导致活性氧积累增加,使得膜脂过氧化作用加重,MDA含量升高,膜透性增大,净光合速率、表观量子效率和最大光化学效率大幅降低。在深度胁迫下,植物体内的代谢趋于混乱,从而抑制了SOD和POD基因的表达,使SOD和POD活性下降,膜脂过氧化作用进一步加重。从上述分析可以看出,SOD和POD活性的变化较好地反映了夏腊梅所受的干旱胁迫状况,对植株活性氧的清除和抗旱性的增强具有重要作用,但活性氧的有效清除还需其他抗氧化成分的协同作用。所以,在本试验条件下,中度胁迫是干旱对夏腊梅产生伤害的转折点,这在夏腊梅的栽培管理中具有实际的指导作用。
黄爱缨, 吴珍龄. 1999. 水稻谷胱甘肽过氧化物酶的测定法. 西南农业大学学报, 21(4): 324-327. |
蒋明义, 郭邵川, 张学明. 1997. 氧化胁迫下稻苗体内积累的脯氨酸的抗氧化作用. 植物生理学报, 23(4): 347-352. DOI:10.3321/j.issn:1671-3877.1997.04.007 |
柯世省, 金则新. 2002. 七子花幼苗光合特性的温度响应. 热带亚热带植物学报, 10(4): 328-334. DOI:10.3969/j.issn.1005-3395.2002.04.006 |
李林初. 1986. 夏蜡梅核型的研究. 广西植物, 6(3): 221-224. |
林植芳, 李双顺, 林桂珠. 1988. 过氧化氢在衰老叶片和叶绿体中的积累及其与脂质过氧化的关系. 植物生理学报, 14(1): 16-22. |
刘洪谔, 张若蕙, 黄少甫, 等. 1996. 8种蜡梅的染色体研究. 浙江林学院学报, 13(1): 28-33. |
孙国荣, 彭永臻, 阎秀峰, 等. 2003. 干旱胁迫对白桦实生苗保护酶活性及脂质过氧化作用的影响. 林业科学, 39(1): 165-167. DOI:10.3321/j.issn:1001-7488.2003.01.027 |
夏新莉, 郑彩霞, 尹伟伦. 2000. 土壤干旱胁迫对樟子松针叶膜脂过氧化、膜脂成分和乙烯释放的影响. 林业科学, 36(3): 3-12. |
徐耀良, 张若蕙, 周骋. 1997. 夏蜡梅的群落学研究. 浙江林学院学报, 14(4): 355-362. |
张宏伟, 翁东明, 徐荣章. 1997. 夏蜡梅生态生物学特性的研究. 浙江林业科技, 17(1): 15-17. |
郑朝宗. 2005. 浙江种子植物检索鉴定手册. 杭州: 浙江科学技术出版社, 92-93.
|
中国科学院植物生理研究所, 上海市植物生理学会. 1999. 现代植物生理学实验指南. 北京: 科学出版社, 96-97, 301-316.
|
周世良, 叶文国. 2002. 夏腊梅的遗传多样性及其保护. 生物多样性, 10(1): 1-6. DOI:10.3321/j.issn:1005-0094.2002.01.001 |
Asada K. 1999. The water-water cycle in chloroplasts: scavenging of active oxygens and dissipation of excess photons. Annu Rev Plant Physiol Plant Mol Biol, 50: 601-639. DOI:10.1146/annurev.arplant.50.1.601 |
Demmig-Adams B. 1990. Carotenoids and photoprotection in plants: a role for the xanthophyll zeaxanthin. Biochim Biophys Acta, 1020: 1-24. DOI:10.1016/0005-2728(90)90088-L |
Giannopolitis C N, Ries S K. 1977. Superoxide dismutase Ⅱ. Purification and quantitative relationship with water-soluble protein in seedlings. Plant Physiol, 59: 315-318. DOI:10.1104/pp.59.2.315 |
Gindaba J, Rozanov A, Negash L. 2004. Response of seedlings of two Eucalyptus and three deciduous tree species from Ethiopia to severe water stress. For Ecol Manage, 201: 119-129. DOI:10.1016/j.foreco.2004.07.009 |
Hodges D M, Delong J M, Fomey C F, et al. 1999. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds. Planta, 207: 604-611. DOI:10.1007/s004250050524 |
Horling F, Lamkemeyer P, Konnig J, et al. 2003. Divergent light-, ascorbate-, and oxidative stress-dependent regulation of expression of the peroxiredoxin gene family in Arabidopsis. Plant Physiol, 131: 317-325. DOI:10.1104/pp.010017 |
Hsiao T C. 1973. Plant responses to water stress. Ann Rew Plant physiol, 24: 519-570. DOI:10.1146/annurev.pp.24.060173.002511 |
Jiang Mingyi, Zhang Jianhua. 2001. Effect of abscisic acid on active oxygen species, antioxidative defence system and oxidative damage in leaves of maize seedlings. Plant Cell Physiol, 42: 1265-1273. DOI:10.1093/pcp/pce162 |
Keles Y, Öncel I. 2002. Response of antioxidative defence system to temperature and water stress combinations in wheat seedlings. Plant Science, 163: 783-790. |
Lasseigne F T, Fantz P R, Raulston J C, et al. 2001. Sinocalycalycanthus raulstonii (Calycanthaceae): A new intergeneric hybrid between Sinocalycanthus chinensis and Calycanthus floridus. Hortscience, 36: 765-767. DOI:10.21273/HORTSCI.36.4.765 |
Lawlor D H. 1995. The effects of water deficit on photosynthesis//Smirnoff N. Environment and plant metabolism-flexibility and acclimation. Oxford: BIOS Scientific Publishers, 129-156
|
Li Junmin, Jin Zexin. 2006. High genetic differentiation revealed by RAPD analysis of narrowly endemic Sinocalycanthus chinensis Cheng et S. Y. Chang, an endangered species of China. Biochemical Systematics and Ecology, 34: 725-735. DOI:10.1016/j.bse.2006.06.010 |
Lima A L S, DaMatta F M, Pinheiro H A. 2002. Photochemical responses and oxidative stress in two clones of Coffea canephora under water deficit conditions. Environmental and Experimental Botany, 47: 239-247. DOI:10.1016/S0098-8472(01)00130-7 |
Marabottini R, Schraml C, Paolacci A R, et al. 2001. Foliar antioxidant status of adult Mediterranean oak species (Quercus ilex L. and Q. pubescens Willd.) exposed to permanent CO2-enrichment and to seasonal water stress. Environmental Pollution, 113: 413-423. |
Mehdy M C. 1994. Active oxygen species in plant defense against pathogens. Plant Physiol, (105): 467-472. |
Reddy A R, Chaitanya K V, Jutur P P, et al. 2004. Differential antioxidative responses to water among five mulberry (Morus alba L.) cultivars. Environmental and Experimental Botany, 52: 33-42. DOI:10.1016/j.envexpbot.2004.01.002 |
Schwanz P, Polle A. 2001. Differential stress responses of antioxidative systems to drought in pendunculate oak (Quercus robur) and maritime pine (Pinus pinaster) grown under high CO2 concentrations. Journal of Experimental Botany, 52: 133-143. |
Smirnoff N. 1993. The role of active oxygen in the response of plants to water deficit and desiccation. New Phytol, 25(1): 27-58. |
Souza R P, Machado E C, Silva J A B, et al. 2004. Photosynthetic gas exchange, chlorophyll fluorescence and some associated metabolic changes in cowpea (Vigna unguiculata) during water stress and recovery. Environmental and Experimental Botany, 51: 45-56. DOI:10.1016/S0098-8472(03)00059-5 |
Türkan, Bor M, Özdemir F, et al. 2005. Differential responses of lipid peroxidation and antioxidants in the leaves of drought-tolerant P. acutifolius Gray and drought-sensitive P. vulgaris L. subjected to polyethylene glycol mediated water stress. Plant Science, 168: 223-231. DOI:10.1016/j.plantsci.2004.07.032 |
Vogel S. 1998. Remarkable nectaries: Structure, ecology, organophyletic perspectives Ⅱ. Nectarioles. Flora Jena, 193: 1-29. DOI:10.1016/S0367-2530(17)30812-5 |
Wu Yuexuan, von Tiedemann A. 2002. Impact of fungicides on active oxygen species and antioxidant enzymes in spring barley (Hordeum vulgare L.) exposed to ozone. Environmental Pollution, 116: 37-47. DOI:10.1016/S0269-7491(01)00174-9 |
 2007, Vol. 43
2007, Vol. 43
