文章信息
- 王贞, 高健洲, 刘燕.
- Wang Zhen, Gao Jianzhou, Liu Yan.
- 玻璃化保存扶芳藤茎尖再生苗夏季适应性研究
- The Adaptability of Plantlets Regenerated from Cryopreserved Shoot-Tips of Euonymus fortunei cv.'Yuanban' in Summer
- 林业科学, 2007, 43(9): 150-154.
- Scientia Silvae Sinicae, 2007, 43(9): 150-154.
-
文章历史
- 收稿日期:2007-01-25
-
作者相关文章
近20年来发展起来的超低温保存技术由于可以实现种质的“长久”保存而倍受重视,其中的玻璃化法超低温保存技术已被广泛应用,并被证实是冻存植物茎尖和分生组织的良好途径。从1989年开始,完全玻璃化法冻存的植物材料已涉及茎尖(Leunufna et al., 2003)、芽(Maruyama et al.,1997)、顶端分生组织(Matsumoto et al., 1994)、愈伤组织(Panis et al., 1996)、悬浮细胞(Tsukazaki et al.,2000)、胚状体(Touchell et al., 2002)、幼苗(刘燕,2000)、须根(Jung et al.,2001)等。目前国内外这方面的研究工作基本集中在依据植物种类和基因型研究玻璃化保存技术程序,包括玻璃化技术中各步骤使用的溶液筛选、处理方法,并依据液氮冻融后成活率选择出最佳组合。另外,通过RAPD(Ahuja,2002)、PFLP(Menuhr et al.,1997)等分析技术验证超低温保存后的基因稳定性、发育能力,通过超低温方法对植物进行脱毒也有一些报道(Helliot et al.,2002;2003;Wang et al.,2003),并对超低温保存过程中细胞所发生的一系列超微结构变化进行了电镜观察(蔡祖国等,2006)以及再生(吴黎明等,2006)研究进行了探讨;而对超低温保存再生植物的生长发育状况研究很少。
扶芳藤(Euonymus fortunei)属卫矛科(Celastraceae)卫矛属(Euonymus),常绿藤本状灌木,可用于立体绿化、中药原料、牧草、茶饮等。我国拥有丰富的扶芳藤资源,亟待人们对其进行研究、开发和利用。本文以扶芳藤为材料,研究了其超低温保存后再生苗的夏季生长适应性,探讨了玻璃化保存后种质的可利用状况。
1 材料与方法 1.1 ‘圆瓣扶芳藤’组培苗茎尖的超低温保存2003年3月从北京北林科技苗圃取‘圆瓣扶芳藤’实生苗的带芽茎段,截成1.5 cm的小段,用消毒液处理15 min,在自来水下流水冲洗30 min后,于超净工作台上,将带芽茎段用75%酒精消毒30 s,再用0.1%的HgCl2消毒7 min,然后用无菌水冲洗10遍,接种于添加1.0 mg·L-16-BA和0.1 mg·L-1NAA的MS固体培养基上,5 d后芽开始萌动,45 d后进行继代培养,以继代培养30 d生长健壮的组培苗为材料进行超低温保存。培养条件:光照为40~60 umol·m-2s-1, 温度为23~25 ℃。
扶芳藤茎尖超低温保存较适宜的程序为:切取继代30 d生长旺盛的扶芳藤组培苗茎尖2~3 mm,室温下用2 M甘油+0.4 M乙二醇处理20 min,再用PVS2溶液0 ℃条件下处理50 min,换新PVS2溶液,快速浸入液氮,保存1 d后取出在40 ℃水浴中解冻70 s,用MS+1.2 mol·L-1蔗糖液体培养基洗涤2次,每次10 min,然后转入MS + 6-BA 2.0 mg·L-1的固体再生培养基上进行培养,成活率可达75%。
1.2 ‘圆瓣扶芳藤’超低温保存苗的移栽茎尖于再生培养基生长3个月,于1/2 MS + NAA 0.1 mg·L-1 +蔗糖30 g·L -1+琼脂6 g·L-1培养生根,40 d后,2005年10月中旬,将再生苗和长势一致的生根试管苗(对照)移栽到5 cm×5 cm的穴盘中进行栽培,栽培50 d后幼苗株高至10 cm,移栽到直径为16 cm的花盆中进行正常的栽培管理,栽培基质为草碳:珍珠岩=3:1。次年春季(2006年4月中旬)将液氮再生苗与对照一起移栽到苗圃地进行露地栽培。
试验采用对比法设计,10株单行小区,3个重复,每个小区均与对照相邻,株行距15 cm×15 cm。移栽初期对其进行遮荫,避免阳光直射,移栽后1个月幼苗恢复生长,去掉遮荫网进行正常的肥水管理。
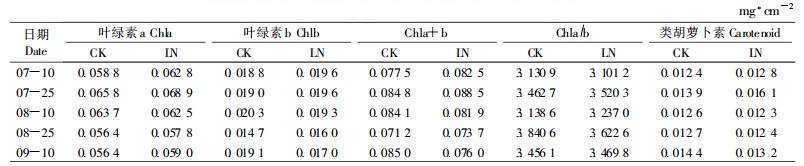
1.3 试验地概况试验地位于北京市北林科技股份有限公司苗圃,2006年温度、降水情况如图 1所示。
|
图 1 2006年5月-10月温度、降水量情况 Fig. 1 Temperature and precipitation from May to Oct.of 2006 |
夏季生长适应性研究在幼苗移栽恢复生长后的5—10月进行,包括生长性状测量与生理指标测定2方面。生长性状的测定,随机选取再生苗与对照各15株作为重复,根据扶芳藤的生长节律,定期测量再生苗的株高、叶片数、分枝总长以及叶片数变化,结果为15株的平均值,测量工具为精准度0.5 cm的卷尺。生理指标测定,分别于7月10日—9月8日,每隔15 d随机采取再生苗与对照植株上部成熟叶片,进行电导率、叶片色素、脯氨酸含量生理指标的测定。
膜相对透性的测定采用李锦树(1983)方法。采取功能叶片,流水冲洗,再用蒸馏水冲洗3次,滤纸洗干,用手持打孔机打成直径0.7 cm的小圆片,放入试管内,注入15 mL蒸馏水,用循环真空泵抽气3次,室温静置2 h,测定电导值R,再将其置入沸水浴中煮沸20 min,测定杀死对照电导值R0,计算膜相对透性(伤害率)=R/R0×100%。
光合色素含量测定参考Arnon(1949)的方法,略有修改。选择植株上部成熟叶片,用直径为0.7 cm的打孔器打取叶圆片,混匀,随意抽取12片,以80%丙酮于黑暗处提取至叶片变成白色,用UV-4802型分光光度计分别在663、646和470处测定吸光度(OD)值,按下列公式计算叶绿素和类胡萝卜素的含量。叶绿素含量(mg·cm-2)=(色素浓度×提取液体积×稀释倍数)/样品面积。本文稀释倍数为1。
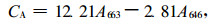
|
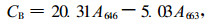
|

|
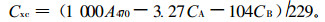
|
脯氨酸含量测定采用酸性茚三酮法(李合生,2000)。选择植株上部成熟叶片0.3 g,加5 mL质量分数为3%的磺基水杨酸水溶液5 mL,研磨提取,匀浆液转入离心管中,沸水浴中浸提10 min,冷却后以5 000 r·min-1离心10 min,吸取上清液2 mL,加入2 mL冰乙酸和4 mL酸性茚三酮显色液,于沸水浴中加热30 min,冷却,加入5 mL甲苯,充分振荡,静置分层后吸取上层红色甲苯层,以甲苯为对照,在520 nm波长下比色,计算脯氨酸含量。样品的质量分数=(X×V)/W,X为2 mL测定液中脯氨酸含量(μg·g-1),通过标准曲线得出,V为提取液的总体积5 mL,W为样品鲜质量。
上述测定均重复5次,求平均值,数据处理采用SPASS13.0数据分析软件对所得数据进行配对样本T检验分析。
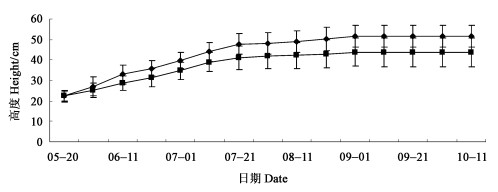
2 结果与分析 2.1 超低温保存再生苗生长性状1) 株高 株高测定从5月20日起,每10 d测量一次,直到9月高生长停止。在相同的自然环境条件和肥水管理条件下,扶芳藤超低温再生苗的生长规律与对照相似,见图 2。主茎高增长期在5月下旬到7月下旬,进入8月高生长速度放慢,9月上旬高生长停止。在整个生长过程中,超低温再生苗主茎高度最初与对照相似,后期主茎生长速率低于对照,差异显著且株高差距随着时间的延续而增加。
|
图 2 扶芳藤夏季株高变化 Fig. 2 Plant height variation of E.fortunei |
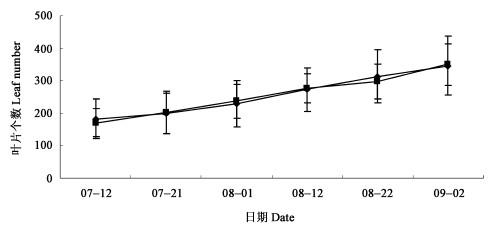
2) 叶片数 在扶芳藤生长旺盛的7—9月,对再生苗叶片数进行跟踪测量。结果表明,再生苗叶片数的增长没有因高温天气而受到抑制,7—9月扶芳藤再生苗叶片数增加趋势与对照一致(见图 3),呈直线上升,差异不显著。
|
图 3 扶芳藤叶片个数变化 Fig. 3 Variation in leaf number of E.fortunei |
3) 分枝总长 分枝总长与叶片数测量相同,在7—9月进行,分枝总长为各分枝长度之和。测量结果表明,再生苗的生长趋势与对照几乎完全一致,且差异不显著(见图 4)。分枝总长的增长速率比较一致,呈直线均匀增长,说明扶芳藤再生苗在整个夏季的生长并没有因为高温天气而受到影响,低温保存并没有影响“再生苗”对北方夏季的适应性。

|
图 4 扶芳藤分枝总长变化 Fig. 4 Variation in branch length of E.fortunei |
4) 分枝数变化 分枝数的测量从7月中旬开始到11月初终止。结果表明,再生苗7、8月份分枝数增加缓慢,而在植株主茎停止生长后的9月,侧枝的生长速度明显加快,侧枝个数增加较多,增长趋势与对照相同。原因可能是主茎停止生长,顶端优势不复存在,营养充分供给侧枝,从而促进侧枝萌发。从图 5可以看出最初再生苗的分枝数与对照差别不大,而在侧枝明显增多的9月,对照的侧枝数要稍高于再生苗,但二者并没有显著差异。

|
图 5 扶芳藤分枝数变化 Fig. 5 Variation in branch number of E.fortunei |
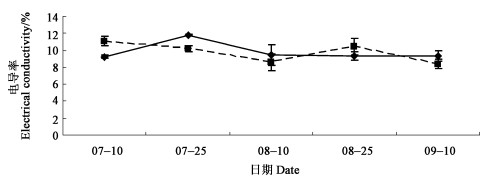
细胞质膜是细胞与外界环境交换信息的屏障,是细胞内许多生化反应的场所。植物在遭受不良环境胁迫时,原生质膜的选择性透性受到影响,盐类或有机物从细胞中渗出,进入周围组织中,使周围环境电导率增加,通过测定外渗液电导率的变化,可反映出质膜受损伤的程度(梅俊学,2004)。夏季高温气候条件下,定期测定再生苗的电导率,测定值见图 6,对测定值进行分析表明,夏季再生苗在叶片的膜相对透性与对照没有显著差异。
|
图 6 扶芳藤夏季叶片电导率测定 Fig. 6 The electrolyte leakage of E.fortunei |
叶绿素含量高低,决定着光合单位的多少、光合速率的快慢和光合积累的丰缺。不同种类叶绿素在总叶绿素中的含量高低,决定着叶片对各色光的吸收和利用程度。光合色素与植物的生长有着密切的关系。夏季不同时期扶芳藤叶片光合色素含量显示见表 1。结果表明,扶芳藤再生苗叶片叶绿素a、b、a/b以及类胡萝卜素含量在7—9月均没有一定的变化规律,再生苗叶片色素含量与对照差异不显著。
|
|
植物在遭受到逆境胁迫时,体内会累积大量的脯氨酸,其积累量的大小影响着渗透调节能力,渗透调节能力的大小与抗性之间有着密切的关系。在7—9月期间,扶芳藤再生苗叶片内脯氨酸含量较少且变化趋势不明显,而在气温较低的9月有较大幅度的增加,这一变化趋势与对照相同且差异不显著,如图 7。说明在夏季炎热的月份,扶芳藤再生苗对夏季高温环境的适应性并没有因为低温保存而发生改变。

|
图 7 扶芳藤脯氨酸含量变化 Fig. 7 Variation of proline of E. fortunei |
春季,扶芳藤再生苗从花盆移栽到露地,经过近1个月的缓苗期,进行正常的栽培管理。5—7月主茎的高生长比较迅速,进入8月以后生长速度变缓,侧枝生长迅速,侧枝数增加较多,直到10月侧枝生长才变缓,总分枝长与叶片个数在7—9月均呈直线增长状态,再生苗在2006年整个夏季生长迅速,长势较好,栽培当年就可以达到绿化效果。
植物在高温、干旱等胁迫下,生理生化过程会发生不同程度的变化,通过测定植物体内的一些生理生化指标变化过程可以研究植物体对外界环境适应能力的强弱。色素、游离脯氨酸、细胞膜透性的动态变化都是研究植物抗性的重要生理指标。通过测定扶芳藤再生苗游离脯氨酸、色素含量以及膜透性发现,除游离脯氨酸受环境影响较大,在气温较低的9月呈增加趋势外,色素与膜透性均没有明显的变化趋势。说明在气温较高的夏季,扶芳藤再生苗的生长受环境影响较小,能够适应夏季的高温以及大气干旱等不利环境因素。
在超低温保存研究中,有关再生苗后期生长适应性的研究很少,本试验通过测量再生苗的生长性状和测定相关生理生化指标发现,除株高与对照存在显著差异外,分枝数、总分枝长、叶片个数以及电导率、脯氨酸和色素含量均与对照差异均不显著。再生苗对夏季高温的适应能力强,生长状况良好。进一步验证了玻璃化超低温保存方法是较理想的植物种质保存方法。对再生苗在株高上与对照之间所表现的差异,目前原因不是很清楚,是否超低温保存过程对茎尖所造成的损伤会影响植株后期的生长有待进一步的研究和探讨。
蔡祖国, 徐小彪, 赵一鹏, 等. 2006. 猕猴桃茎尖超低温保存过程中超微结构观察. 西北植物学报, 26(8): 1600-1604. DOI:10.3321/j.issn:1000-4025.2006.08.014 |
李合生. 2000. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 258-260.
|
李锦树, 王洪春, 王文英. 1983. 干旱对玉米叶片细胞透性及膜脂的影响. 植物生理学通讯, 9(3): 223-228. |
刘燕, 高荣孚, 周晓阳. 2001. 玻璃化超低温保存中拟南芥幼苗细胞膜ATPase的变化. 北京林业大学学报, 23(5): 1-5. DOI:10.3321/j.issn:1000-1522.2001.05.001 |
梅俊学. 2000. 逆温下发菜脯氨酸含量及膜透性的变化与含水量的关系. 山东师范大学学报:自然科学版, 15(2): 178-181. |
吴黎明, 曾继吾, 彭抒昂, 等. 2006. 香蕉茎尖的玻璃化法超低温保存及其植株再生. 园艺学报, 33(3): 501-506. DOI:10.3321/j.issn:0513-353X.2006.03.009 |
Angelika S M, Schumacher H M, Gunda M W. 1997. Long-term storage of old patato varieties by cryopreservation of shoot-tips in liquid nitrogen. Plant Genetic Resource News letter, (111): 19-24. |
Arnon, D I. 1949. Copper enzymes in isolated chloroplasts: Polyphenoloxidase in Beta vulagris. Plant Physiology, 24: 1-15. DOI:10.1104/pp.24.1.1 |
Helliot B, Panis B, Poumay Y, et al. 2002. Cryopreservation for the elimination of cucumber mosaic and banana streak viruses from banana (Musa spp.).. Plant Cell Reports, 20: 1117-1122. DOI:10.1007/s00299-002-0458-8 |
Helliot B, Swennen R, Poumay Y, et al. 2003. Ultrastructural changes associated with cryopreservation of banana (Musa spp.) highly proliferating meristems.. Plant Cell Reports, 21: 690-698. |
Touchell D H, Ching V L, Tsai C J. 2002. Cryopreservation of embryogenic cultures of Picer mariana (black spruce) using vitrification. Plant Cell Reports, (21): 118-124. |
Da W J, Chung K S, Kaori T, et al. 2001. Cryopreservation of Hyoscyamus niger adventitious roots by vitrification. Plant Physiology, 158: 801-805. DOI:10.1078/0176-1617-00180 |
Tsukazaki H, Mii M, Tokuhara K, et al. 2000. Cryopreservation of Doritaenopsis suspension culture by vitrification. Plant Cell Reports, 19: 1160-1164. DOI:10.1007/s002990000255 |
Maruyama E, Kinoshita I, Ishii K., et al. 1997. Gemplasm conservation of Guazuma crinita, a useful tree in peru-Amazon, by the cryopreservation of in vitro-cultured multiple bud clusters. Plant Cell Tissue and Organ Culture, 43(3): 161-163. |
Matsumoto T, Sakai A, Yamada K. 1994. Cryopreservation of in vitro-grown apical meristems of wasabi (Wasabia japonica) by vitrification and subsequent high plant regeneration. Plant Cell Reports, 13: 442-446. |
Panis B, Tott N, Van N K, et al. 1996. Cryopreservation of banana (Musa spp.) meristem cultures after preculture on sucrose.. Plant Science, 121: 95-106. DOI:10.1016/S0168-9452(96)04507-4 |
Wang Q C H, Mawassi M, Li P, et al. 2003. Elimination of grapevine virus A (GVA) by cryopreservation of in vitro-grown shoot tips of Vitis vinifera L. Plant Science, 165: 321-327. DOI:10.1016/S0168-9452(03)00091-8 |
Leunufna S E, Keller R J. 2003. Investigating a new cryopreservation protocol for yams (Dioscorea spp.).. Plant Cell Peports, 21: 1159-1166. DOI:10.1007/s00299-003-0652-3 |
Ahuja S, Mandal B B, Dixit S, et al. 2002. Molecular, phenotypic and biosynthetic stability in Dioscorea floribunda plants derived from cryopreserved shoot tips. Plant Science, 163: 971-977. DOI:10.1016/S0168-9452(02)00246-7 |
Wellburn A R, Lichtenthaler H. 1984. Formulate and program to determine total carotenoid and chlorophyll a and b of leaf extracts in different solvents//Advance Photosynthesis Research. The Hague: Martinus Nijhoff, 9-12
|
 2007, Vol. 43
2007, Vol. 43