文章信息
- 吕晋慧, 吴月亮, 孙磊, 张启翔.
- Lü Jinhui, Wu Yueliang, Sun Lei, Zhang Qixiang.
- AP1基因转化地被菊品种‘玉人面’的研究
- Genetic Transformation of Chrysanthemum morifolium cv. 'Yu Ren Mian' with AP1 Gene Mediated by Agrobacterium tumefaciens
- 林业科学, 2007, 43(9): 128-132.
- Scientia Silvae Sinicae, 2007, 43(9): 128-132.
-
文章历史
- 收稿日期:2006-09-19
-
作者相关文章
2. 山西农业大学林学院 太谷 030801
2. College of Forest, Shanxi Agricultural University Taigu 030801
地被菊(Chrysanthemum morifolium)是重要的地被植物,目前的主栽品种大都属短日照敏感型品种,花期集中在秋季,靠人工措施实现周年生产,生产成本高,花的品质差。利用基因工程改变短日照敏感型地被菊品种的花期有重大意义。从对拟南芥(Arabidopsis thaliana)、金鱼草(Antirrhinum majus)花发育的研究中发现花发育在进化上具有保守性(安利忻等,2001),控制花分生组织特征基因LEAFY(LFY)、APETALA1(AP1)等在不同植物中的表达,可以缩短植物营养生长期,促使植物早开花,类似研究已经在欧洲山杨(Populus tremula)、柑橘(Citrus reticulata)、矮牵牛(Petunie hybrida)、水稻(Oryza sativa)等上获得成功(Weigel et al.,1995;Leandro,2001;安利忻等, 2001;He et al.2000),其中转LFY基因的欧洲山杨开花期由8~20年缩短到7个月,而地被菊上还未见相关报道。本研究旨在建立地被菊‘玉人面’(C.morifolium ‘Yu Ren Mian’)品种的遗传转化体系,并对转化植株的开花特性进行研究,为通过基因工程结合传统育种培育早花期地被菊新品种奠定基础。
1 材料与方法 1.1 材料以地被菊品种‘玉人面’为试材。选取20~25 d苗龄的无菌苗中上部充分展开的幼嫩叶片为外植体,在近主脉的部位横切2~3次,接种于培养基上。含花分生组织特征基因AP1的PZEROBLUNT ⅡToPo克隆载体由澳大利亚Elliot Meyerowitz博士惠赠。根癌农杆菌菌株(Agrobacterium tumefaciens)EHA105、LBA4404和表达载体pBI-121由北京林业大学安新民博士后提供。植物表达载体pBI-AP1由本实验室构建和保存,质粒携带有NPTⅡ和AP1基因(图 1)。

|
图 1 双元载体pBI-AP1图谱 Fig. 1 The binary vector of pBI-AP1 |
培养条件:温度(24±2) ℃,光强2 000~2 400 lx, 光照时间为16 h·d-1。分化培养基:MS+6-BA 1 mg·L-1 + NAA 0.1 mg·L-1;共培养培养基:1/2MS+NAA 0.1 mg·L-1+ AS 100 μmol·L-1;筛选培养基:MS+6-BA 1 mg·L-1+NAA 0.1 mg·L-1+ Cef 250 mg·L-1+ G418(5~10)mg·L-1;生根培养基1/2MS+ Kan 20 mg·L-1。不同培养基均附加蔗糖3.0%、琼脂0.5%。
1.3 试剂DIG High Prime DNA Labeling and Detection Starter Kit Ⅰ购自北京五洲东方科技发展有限公司(Roche公司生产);限制性内切酶、Taq酶购自北京拜尔迪生物技术有限公司(Takara产品)。卡那霉素(Kan)、G418、乙酰丁香酮(As)分别由Sigma、Genview、Sigma公司生产,购自北京鼎国生物技术有限责任公司。其他化学试剂为国产分析纯。
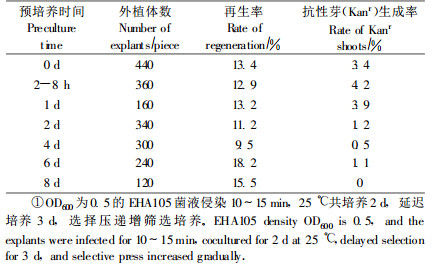
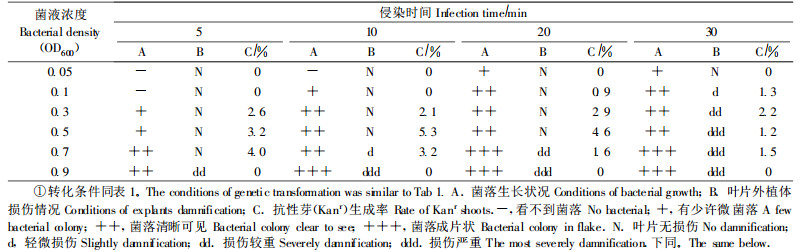
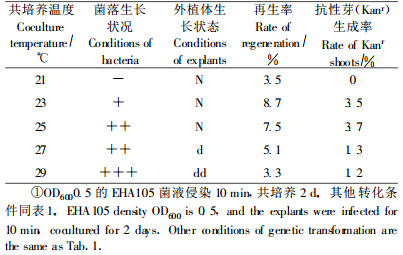
1.4 转化方法及影响遗传转化的因素筛选和优化转化采用根癌农杆菌介导的叶盘法(王关林等,2002)。根据前人的经验(蒋细旺,2003;洪波等,2005)和预试验的初步结果,在影响遗传转化的因子中(预培养时间、菌液浓度、侵染时间、共培养温度、选择压加入时间、选择压大小), 分别以某一因子做变量,其他因子保持一致(苏军等, 2002;蒋细旺, 2003), 50 d后观察每一因子对转化频率的影响,其中不同影响因子的不同处理见表 1~5。筛选过程中抗生素的使用采用3种不同处理:1)直接用10 mg·L-1 G418筛选培养;2)选择压递减:10 mg·L-1 G418(7~14 d)→7.5 mg·L-1 G418(14 d)→5 mg·L-1 G418(后期筛选);3)选择压递增:5 mg·L -1 G418(7~14 d)→7.5 mg·L-1 G418(14 d)→10 mg·L-1 G418(后期筛选)。
|
|
|
|
|
|
|
|
|
|
NPTⅡ基因的特异引物:5′端引物为5′-CGCATGATTGAA CAAGATGG-3′;3′端引物为5′-CGCTCAGAAGAACTCGTCAA-3′,由上海博雅生物有限公司合成。选抗性芽作PCR检测的材料,用CTAB法提取基因组DNA,以质粒pBI-AP1做阳性对照,未转化苗做阴性对照,进行PCR扩增。扩增反应在Touchgene Gradient梯度基因扩增仪上进行。NPTⅡ基因的PCR反应条件:预变性,94 ℃ 5 min;变性94 ℃ 30 s,复性5 5 ℃ 30 s;延伸72 ℃ 1 min 30 s,30个循环,最后在72 ℃条件下延伸10 min。扩增产物在0.8%琼脂糖凝胶中电泳。
转基因植株与对照基因组DNA用EcoRⅠ酶切消化,并用随机引物方法标记NPTⅡ基因片段(600 bp)作探针。引物标记、标记效率检测、Southern杂交均按DIG High Prime DNA Labeling and Detection Starter Kit Ⅰ操作说明书进行。
1.6 转AP1基因抗性株的性状分析转AP1基因植株和对照植株移栽到温室,从中选择繁殖量大、生长均匀一致的株系,对其营养生长和开花特性进行观察记录,比较转基因地被菊‘玉人面’植株的营养生长和花期变化。
2 结果与分析 2.1 影响遗传转化因素的筛选和优化1) 预培养时间对转化率的影响外植体不进行预培养或预培养2~8 h,抗性芽获得率高。而预培养1 d以上的叶片在农杆菌侵染后,叶片伤口处和叶表面易褐化,抗性芽获得率低,随预培养时间延长,褐化现象加重。预培养时间延长到6 d、8 d时,叶片伤口处有愈伤组织生成,叶片再生率提高,分别达到18.2%、15.5%,但在后期的筛选培养中逐渐白化死亡,最终没有提高转化率(表 1)。
2) 农杆菌浓度、侵染时间对转化率的影响试验结果表明用OD600为0.5的菌液侵染10 min、20 min,获得了较高的再生率,分别为5.3%、4.6%。菌液浓度低、侵染时间短时,共培养中没有明显的菌落形成,转化效率低或转化不成功。菌液浓度过高、侵染时间过长,如用OD600为0.7、0.9的菌液侵染20、30 min后,共培养时部分叶片受农杆菌毒害软腐死亡或呈水渍状,不定芽再生率低,且在筛选培养的后期抑菌困难容易造成农杆菌污染(表 2)。
3) 共培养时间和温度对转化率的影响对侵染后的叶片外植体进行共培养,试验结果表明共培养2 d,农杆菌能正常繁殖,抗性芽生成率高。不进行共培养或共培养时间短(1 d)时,农杆菌不能增殖或增殖量小,转化不成功。延长共培养时间,叶片伤口处褐化、影响抗性芽的生成。其中共培养6 d时农杆菌生长过度,部分叶片被包埋在农杆菌中,叶片软腐死亡或呈半透明水渍状,不定芽再生困难(表 3)。
对共培养温度进行筛选优化,结果显示:23 ℃、25 ℃处理下抗性芽再生率最高。而共培养温度过低、过高都影响抗性芽再生率,其中29 ℃下,农杆菌繁殖生长速度快,部分叶片被农杆菌包埋,叶片软腐死亡或呈水渍状坏死(表 4)。
4) 选择压对转化率的影响直接用10 mg·L-1 G418进行选择,不同延迟处理下叶片褐化死亡,没有抗性芽形成(数据未显示)。采用由高到低逐渐降低选择压进行筛选时,叶片仍然快速褐化死亡,抗性芽生成率低。而采用选择压递增进行筛选,在不同处理下效果不同(表 5)。其中不进行延迟培养的叶片没有获得抗性芽。延迟培养3 d进行筛选转化获得率高,为5.4%。同时观察到在叶片伤口处有少量颗粒状愈伤组织形成,但在后续培养中愈伤组织逐渐死亡未能分化出不定芽。延迟培养时间延长,叶片再生率提高,最高达13.5%,但大部分不定芽在随后的筛选培养中白化死亡,抗性植株生成率未随延迟培养时间的延长而增加。
2.2 转基因植株的获得及PCR、Southern blotting检测经农杆菌侵染后的叶片外植体伤口边缘有不定芽生成,部分抗性芽保持绿色,而其余的不定芽则白化死亡(图 2A)。待抗性芽长到1 cm左右时,将其切下转接到含选择压的生根培养基中,部分抗性芽生根,其余的白化死亡(图 2B)。经PCR扩增,其中抗性苗5~8、11~16、18和阳性对照在约800 bp处有特异DNA条带,未转化成功植株和阴性对照则没有特异条带(图 4)。

|
图 2 抗性(Kanr)芽生长情况 Fig. 2 Conditions of Kanr shoots growth A:分化培养基中抗性芽生长情况Conditions of Kanr shoots on differentiation culture medium;B:生根培养基中抗性芽生长情况Conditions of Kanr shoots on rooting culture medium. |
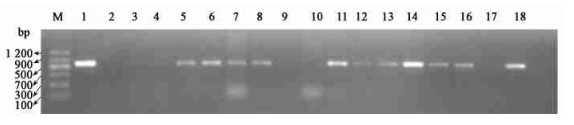
|
图 4 转AP1基因植株的PCR检测 Fig. 4 PCR detection of transformed plants of AP1 gene M:Marker Ⅱ;1: pBI-AP1阳性对照Positive control;2:阴性对照Negative control;3、4、9、10、17:未转化成功植株Untransformed plant;5~8、11~16、18:转化植株Transformed plant. |
对抗性植株杂交结果表明:转化植株有杂交信号(图 3),说明外源基因已经整合到菊花基因组中,其中1株为双拷贝,其余株系为单拷贝。不同株系外源基因插入位点不同,说明不同株系间是相对独立的转化植株。
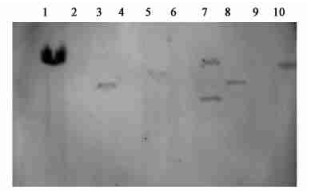
|
图 3 转基因菊花的Southern blotting杂交分析 Fig. 3 Southern blotting analysis of transgenic plants 1:pBI-AP1阳性对照Positive control;2:阴性对照Negative control;3、5、7、8、10:转化植株Transformed plant;4、6、9:未转化成功植株Untransformed plant. |
1) 转基因菊花的营养生长对转基因株系和对照植株的节间、冠幅和株高进行比较(表 6),其中A5株系冠幅小于其他株系,但不影响植株正常生长和开花。A1、A5株系株高比对照略有降低,经方差分析差异未达显著水平。
|
|
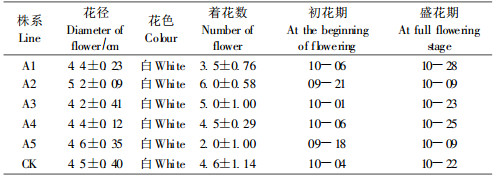
2) 转基因菊花开花特性转基因植株在花径、花色、着花数上与对照没有显著差异,着花位置、花形态构造也未发生改变,而不同株系花期有变化,其中A2、A5分别在9月21日、9月18日开始现花,于10月9日达到盛花期,而对照于10月4日开始现花,10月22日达到盛花期,比对照提前约15 d。其他株系与对照没有明显差异(表 7)。
|
|
本研究认为地被菊‘玉人面’品种叶片外植体不适宜做长时间预培养,钟名其等(2001)也认为桑(Morus alba)叶片经过预培养后叶片褐化严重、分化率下降,而杨广东等(2002)认为预培养可以减轻农杆菌侵染后外植体的腐烂褐化,洪波等(2005)认为预培养可以提高转化率。可能基因型的差异引起不同物种对预培养的反映不同。
农杆菌具有最强侵染力的生长温度并不是其最适生长温度。本研究认为23、25 ℃下共培养抗性芽再生率高,与蒋细旺(2003)、林拥军等(2002)的研究结果一致。共培养温度低时农杆菌的侵染活性高可能是因为当农杆菌处于快速生长繁殖状态时农杆菌中与侵染有关的基因表达受阻,侵染力下降。当农杆菌生长趋缓时,与其侵染有关的基因才能充分表达,有利于提高侵染力(林拥军等, 2002)。
确定选择压的强度及施加选择压的时间与材料对抗生素的敏感性、农杆菌对材料的侵染性和外源基因从转入到表达所用的时间不同等有关,在遗传转化中应灵活运用,本研究认为延迟培养结合选择压递增筛选培养适合‘玉人面’的遗传转化。
外源基因未改变转基因植株的营养生长特性,与Leandro (2001)研究结果类似,该研究使花分生组织特征基因AP1在柑橘中过量表达,转化植株营养生长正常。本试验中转化植株均能正常开花,其中有2株花期比对照提前约15 d,与相关研究比较花期变化较小,原因可能有以下几方面: 1)转基因植株花期变化与外源基因的表达水平有关。有研究认为35S启动子容易导致外源基因在转基因菊花中的低水平表达(Annadana et al.,2000;2001)。2)外源基因在宿主基因组中的整合位点、外源基因与内源基因的相互作用等多种因素都可能造成外源基因在转化植株中的低水平表达(王关林等,2002;Meyer, 1995)。3)高等植物的开花是一个十分复杂的过程,受一系列基因的调控,单一的外源AP1基因可能不足以使花期产生大的变异。4) “玉人面”是典型的短日照植物,控制菊属中短日照敏感性种或品种开花过程的基因调控网络系统尚不清楚,对调控其开花的关键基因的分离、功能鉴定及遗传转化等的研究是今后工作的目标之一。
安利忻, 刘荣维, 陈章良, 等. 2001. 花分生组织决定基因AP1转化矮牵牛的研究. 植物学报, 43(1): 63-66. |
洪波, 张常青, 李邱华, 等. 2005. 根癌农杆菌介导的转录因子DREB1A基因在地被菊花中的遗传转化. 农业生物技术学报, 13(3): 304-309. DOI:10.3969/j.issn.1674-7968.2005.03.007 |
蒋细旺.2003.根癌农杆菌介导的Bt与GNA基因转化菊花品种的研究.华中农业大学博士学位论文
|
林拥军, 陈浩, 曹应龙. 2002. 农杆菌介导的牡丹江8号高效转基因体系的建立. 作物学报, 28(3): 294-300. DOI:10.3321/j.issn:0496-3490.2002.03.002 |
苏军, 段榕琦, 胡昌泉, 等. 2002. 小白菜再生和农杆菌介导转化体系的建立. 福建农业学报, 17(4): 241-243. DOI:10.3969/j.issn.1008-0384.2002.04.012 |
王关林, 方宏筠. 2002. 植物基因工程. 北京: 科学出版社, 344-346.
|
杨广东, 朱祯, 李燕娥, 等. 2002. 大白菜高效遗传转化体系的建立. 农业生物技术学报, 10(2): 127-132. DOI:10.3969/j.issn.1674-7968.2002.02.007 |
钟名其, 楼程富, 谈建中. 2001. 桑树遗传转化技术中抗生素的浓度优化研究. 汕头大学学报, 16(2): 1-6. |
Annadana S, Rademaker W, Ramanna M, et al. 2000. Response of stem explants to screening and explant source as a basis for methodical advancing of regeneration protocols for Chrysanthemum. Plant Cell, Tissue and Organ Culture, 62: 47-55. DOI:10.1023/A:1006483414260 |
Annadana S, Mlynarova L, Udayakumar M, et al. 2001. The potato Lhca3.st.1 promoter confers high and stable transgene expression in Chrysanthemum, in constrast to CaMV based promoters. Mol Breed, 8: 335-344. |
He Zuhua, Zhu Qun, Tsegaye D, et al. 2000. Transformation of rice with the Arabidopsis floral regulator LEAFY causes early heading. Transgenic Reseach, 9: 223-227. DOI:10.1023/A:1008992719010 |
Leandro Pena. 2001. Constitutive expression of Arabidopsis LEAFY and APETALA1 genes in citrus reduces their generation time. Nat Biotechnol, 19(3): 263-267. DOI:10.1038/85719 |
Meyer P. 1995. Variation of transgene expression in plants. Euphytica, 85: 359-366. DOI:10.1007/BF00023968 |
Weigel D, Nilsson O. 1995. Developmental switch sufficient for flower initiation in diverse plants. Nature, 377: 495-500. DOI:10.1038/377495a0 |
 2007, Vol. 43
2007, Vol. 43