文章信息
- 王广利, 迟德富.
- Wang Guangli, Chi Defu.
- 天牛化学通讯及其在害虫综合治理中的应用
- The Chemical Communication and Their Application in Integrated Pest Management in the Cerambycidae (Coleoptera)
- 林业科学, 2007, 43(9): 88-95.
- Scientia Silvae Sinicae, 2007, 43(9): 88-95.
-
文章历史
- 收稿日期:2006-11-28
-
作者相关文章
天牛是鞘翅目昆虫中一种重要的蛀干害虫,主要以幼虫蛀食树干和成虫补充营养危害树木。20世纪80年代后期,南非咖啡3年生产量的25%损失于咖啡墨天牛(Monochamus leuconotus)幼虫的危害(Schoeman et al., 1998)。天牛的危害不仅对当地社会和经济造成损失,而且许多外来入侵种也对当地的林业健康和生物多样性产生重要影响。外来入侵种光肩星天牛(Anoplophora glabripennis)已对亚洲和欧洲一些国家造成危害(Nowak et al., 2001)。
天牛目前已成为世界性害虫,考虑对生态环境的保护,天牛化学通讯中使用的信息化学物质在害虫综合治理中具有很大的开发潜力。利用天牛的信息素、引诱剂、驱避剂、拒食剂等信息化学物质能够调控天牛行为的特性进行防虫和虫情监测日益受到重视。这些信息化学物质主要为天牛自身释放的信息素和植物源挥发物,在害虫综合治理中要充分有效利用这些物质,必须清楚了解这些化合物的自身特性及其对昆虫的特殊行为作用。
1 天牛信息化学物质Allison等(2004)综述了天牛的化学生态学,其中引诱性物质包括了花的挥发物、烟挥发物、树干和枝叶挥发物以及信息素,这些物质往往为类单萜和酚酯类化合物;对天牛具有驱避作用的物质通常是一些非寄主植物的挥发油类;天牛自身的代谢物以及一些植物的挥发物及其次生代谢物能够抑制天牛取食或产卵,如川楝素、生物碱和萜烯类等物质。
1.1 天牛性信息素和聚集信息素Allison等(2004)、江望锦等(2005)、周琳等(2004)对天牛信息素的研究概况做了比较全面的阐述。其中,灭字脊虎天牛(Xylotrechus quadripes)的性信息素化学组成在原来1种化合物组分(主要成分为(S)-2-羟基-3-癸酮),(Rhainds et al., 2001)的基础上又补充了2种组分,3-羟基-2-癸酮和(S, S)-2, 3-二羟基辛烷(Hall et al., 2006),至此灭字脊虎天牛的性信息素是3种化合物的混合物。厚垫黄带蜂天牛(Megacyllene caryae)的接触性信息素主要组分最近被鉴定为(Z)-9-29碳烯(Ginzel et al.,2006)。天牛成虫雌雄两性都可以产生性信息素,其中短距离性信息素一般是雌虫产生的带有甲基支链的表皮烃,长距离性信息素主要是雄性产生的由6~10个碳组成的α-羟基酮和(α, β)-二醇,这些物质的化学结构见图 1(Allison et al., 2004)。从这些化合物的化学结构上可看出,短距离性信息素的碳链较长(C>20),挥发性低,有效作用距离短,长距离的性信息素则与之相反(C≤10)。另外有2种天牛的性信息素较特殊,巴西中南部地区的主要害虫Migdolus fryanus的性信息素是由雌虫产生的2种异亮氨酸衍生物的混合物(Leal et al., 1994),Vesperus xatari的性信息素是一种氧化的类单萜——(S)-10-oxoisopiperitenone(俗名:巴比妥)(Boyer et al., 1997)。天牛聚集信息素的报道较少,仅2004年首次发表了新荣天牛属(Neoclytus)的Neoclytus acuminatus acuminatus的聚集信息素是由雄性产生的(2S, 3S)-己二醇(Lacey et al., 2004)。
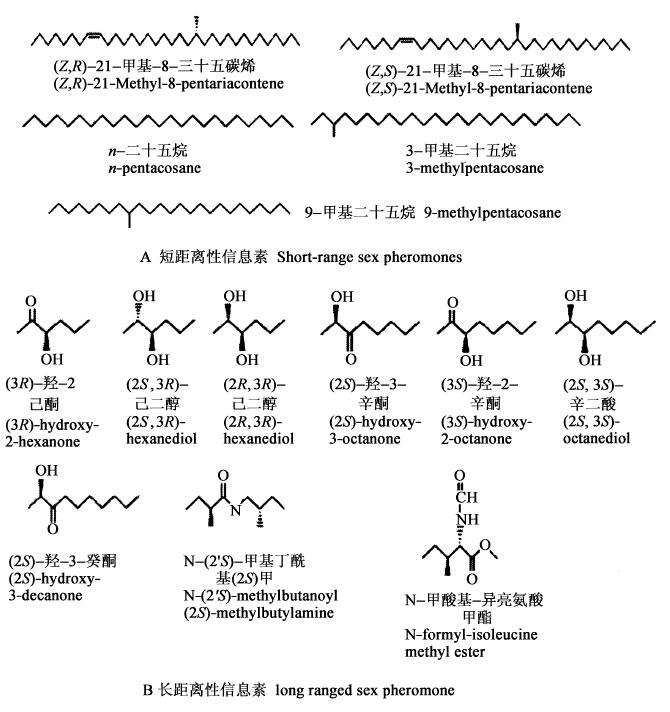
|
图 1 天牛长距离性信息素和短距离性信息素的化学结构 Fig. 1 Chemical structure of long ranged and short ranged sex pheromone in longicorn beetles |
天牛信息素的产生部位,从目前信息素鉴定的材料中可知天牛的鞘翅、胸部及其表皮是产生信息素的主要部位,但加州锯天牛(Prionus californicus)信息素的产生可能特殊,其雌虫能够释放引诱雄虫的挥发性信息素。在求偶行为中,雌虫有时在伸出的产卵器收回之前能从产卵器背面向外翻卷出一种膜质、圆筒状的囊。这种囊状(eversible sac)结构在天牛科中从没有报道过,它可能与信息素的产生和释放有关(Barbour et al., 2006)。Cervantes等(2006)通过实验室和田间试验,进一步证明了加州锯天牛的产卵器能够释放挥发性信息素,在一定距离内能够引诱雄虫,这是首次论证原始种类的天牛能产生挥发性信息素。
1.2 植物源挥发物 1.2.1 引诱剂和驱避剂天牛寄主和非寄主植物的挥发性气味一般是醇类、醛类、萜烯类和一些酯类物质,在化学通讯中能够调控天牛的寄主定向、取食、交配和产卵等行为。一般寄主植物的气味能够引诱天牛,有些物质也是天牛性信息素引诱剂的增效剂(周琳等,2006;汪永俊,1992)。光肩星天牛寄主植物所释放的挥发性物质在其寄主定向中起着关键作用,正常生长的复叶槭(Acer negundo)能够明显引诱光肩星天牛,但损伤后的植株在一定时间表现出驱避活性(李建光,2001;李继泉等,2003)。侧柏(Platycladus orientalis)树皮的挥发油对双条杉天牛(Semanotus bifasciatus)具有引诱作用,其活性成分主要是一些烯烃(蔡世民等,1989)。柳杉纹虎天牛(Anaglyptus subfasciatus)是日本柳杉(Cryptomeria japonia)和日本扁柏(Chamaecyparis obtusa)最严重的害虫。柳杉纹虎天牛的性信息素(R)-3-羟基-2-己酮和(R)-3-羟基-2-辛酮(Leal et al., 1995)与植物源引诱剂乙酸苯甲酯以125:1的比例混合,能捕获比单独使用性信息素或植物源引诱剂更多的害虫(Nakamuta et al., 1997)。(+)-顺-3-蒎烯-2-醇能够引诱松墨天牛(Monochamus alternatus)的雄虫(Sakai et al., 1991),松树挥发物(+)-刺柏醇和(+)-海松醛相混合对松墨天牛也有引诱作用(Sakai et al., 1990)。主要成分为萜烯、乙醛、丙酮和有机溶剂的M99-1引诱剂对松墨天牛成虫的引诱性最强,从而在监测其成虫种群密度及其携带松材线虫(Bursaphelenchus xylophilus)数量和防治天牛危害方面具有重要作用(赵锦年等,2000)。松墨天牛在日本优先取食马尾松(Pinus massoniana),其次为雪松(Cedrus deodara)和黑松(Pinus thunbergii)。这3种植物小枝挥发物中的α-蒎烯、樟脑萜、d-柠檬烯、β-水芹烯、长叶烯和β-丁子香烯在浓度上有重要差异。其中马尾松释放的α-蒎烯最高,而黑松释放的柠檬烯最高,因此认为а-蒎烯和柠檬烯在成虫寄主取食的选择和接受中发挥重要作用。另外,天牛取食之初,这类化合物的浓度不同, 其作用效果也不同。当浓度升高至一定阈值时可抑制松墨天牛的取食活性(Fan et al., 2006)。单独使用乙醇可以引诱天牛和小蠹科昆虫(Montgomery et al., 1983)。卡罗林墨天牛(Monochamus carolinensis)和硬叶松脂象(Pachylobius picivorus)能够被寄主植物释放的松节油所引诱,南美松墨天牛(M. titillator)和黑脂大小蠹(Dendroctonus terebrans)对松节油的反应由于添加了乙醇而增强,因此松节油和乙醇可作为这些昆虫的引诱剂(Phillips et al., 2001)。
非寄主植物的气味往往具有驱避作用,但这方面的研究相对较少。桑天牛(Apriona germari)、黄星桑天牛(Psacothea hilaris)和松墨天牛的非寄主植物柠檬桉(Eucalyptus citriodora)和蓝桉(E. globulus)的叶部挥发的一些精油对这些天牛具有驱避活性(严敖金等,1998)。臭椿嫩枝叶和幼果的提取物对光肩星天牛具有明显的驱避作用(曹兵等,2004)。Trans-Conophthorin能够明显降低小蠹烯醇、甲基-丁烯醇和α-蒎烯的混合物对M. galloprovincialis雄虫的诱捕量,因此也可作为该天牛的驱避剂(Ibeas et al., 2007)。
1.2.2 拒食剂和产卵抑制剂在植物与昆虫的长期的协同进化过程中,使大多数植物都具有抵制昆虫取食的化合物,主要是倍半萜烯内酯类、异类黄酮、苦木素类化合物和柠檬苦素类植物次生代谢物(Koul et al., 1994)。目前天牛科仅有川楝素和Imidacloprid对光肩星天牛和木棉织目天牛(Plectrodera scalator)有拒食剂作用(Poland et al., 2006; Wang B O et al., 2005)。川楝素的浓度不同,作用效果也不同。例如,当浓度为10 μg·mL-1时,对云斑白条天牛(Batocera horsfieldi)无拒食影响,当浓度达到50 μg·mL-1时才产生强烈的拒食作用(巨云为等,2003)。
天牛的产卵抑制剂研究较少,这些化合物通常是一些植物挥发物以及昆虫自身代谢物。双稠哌啶类生物碱(黄华碱和野靛碱)能够降低桑天牛的产卵量和卵孵化率,印楝提取物也能够抑制天牛产卵量及卵孵化率(嵇保中等,1998;赵博光等,2001)。松墨天牛在涂有其雌虫生殖腺提取物的产卵场所不但不产卵,而且还选择离开这一场所,这表明松墨天牛对产卵场所的选择与否与雌虫生殖器官内某种化学物质的作用有关(Anbutsu et al., 2001)。进一步的研究指出,用松墨天牛幼虫粪便的己烷提取物处理后的地方产卵痕迹少、卵粒少,说明提取物中有抑制剂存在。经气相色谱-质谱联用分析,这些化合物被鉴定为α-蒎烯、β-蒎烯、3-蒈烯、柠檬烯、长叶烯和二叔丁对甲酚。其中合成的单萜类和二叔丁对甲酚的混合物具有抑制产卵的活性(Anbutsu et al., 2002;Li et al., 2006)。另外,将绿叶挥发物(E)-2-己烯-1-醇和(E)-2-己烯醛与矿物油(1:1:2)混合涂在火烧过的松树皮上,能够减少暗梗天牛(Arhopalus tristis)产卵达98.5%(Suckling et al., 2001)。研究天牛和其寄主玉蕊科(Lecythidaceae)植物Couratari stellata和Gustavia hexapetala之间的关系发现,这2种植物能够释放一种有恶臭的气味,其中C. stellata的挥发物近15 %为硫黄化合物,从木材样品中分离得到的S-甲基甲硫氨酸似乎是这种特殊气味的主要组分,推测此种有恶臭的气味是天牛寻找产卵场所的抑制剂(Berkov et al., 2000)。桑天牛(Apriona germari)喜欢在寄主植物周围杂草遮蔽下的树枝或树干上产卵,当除去这些杂草时,产卵量明显下降,产卵高度也有明显的变化,说明除掉寄主周围的杂草对该天牛的产卵行为有抑制作用(Esaki, 2006)。此外,异种昆虫的卵和幼虫也能阻止天牛产卵,产卵地点的颜色有时也会产生影响。如白点墨天牛(Monochamus scutellatus)在有其他昆虫卵和幼虫的地方,雌虫多数把卵产在空白处,其同种天牛的卵对其产卵行为没有影响,但产卵处有同种天牛幼虫存在时,该天牛还是喜欢将卵产在其他空白处。当产卵痕迹为褐色时,可能标记此处已被产卵,从而抑制天牛产卵行为,对现有虫卵起到保护作用(Peddle et al., 2002)。
2 天牛生殖生物学研究 2.1 天牛的交配行为机制昆虫的交配行为机制一般包括雌雄两性的相遇、抱对、交尾次数、交尾持续时间、交尾的生理节奏、交尾后的行为以及产卵活性等。采用野外观察或实验室研究的方法,目前对天牛的交配行为机制已有初步的了解。天牛的交配行为很少使用长距离的性信息素来启动,多数应用短距离或接触性信息素。新西兰的柠檬奥天牛(Oemona hirta)在实验室条件下,雄虫的交配活性高,在随机爬行中接触雌虫后才试图交尾。每次交尾持续时间较长(50 min),最后一次交尾时间最长,交尾结束后雄虫仍停留在雌虫背上一段时间以保护配偶免受其他雄性的干扰(Wang Q et al., 2005a)。灰黄锦天牛(Acalolepta luxuriosa)、黄星桑天牛、白斑星天牛(Anoplophora malasiaca)、光肩星天牛、橘褐天牛(Nadezhdiella cantori)、厚垫黄带蜂天牛和麻点豹天牛(Coscinesthes salicis)雌雄相遇时,一般是雄虫通过触角直接接触来识别雌虫,在抱握和爬上雌虫背部期间,雄虫经常用触角和下唇须或颚须接触雌虫的鞘翅和前胸背板,并伴有曲腹行为,最终发生交配,故这些天牛雌虫的性信息素为接触型,交配行为由雌虫体表的接触性信息素来启动(Kuboki et al., 1985;Yokoi, 1989;Fukaya et al., 1999;李德家, 1999;Wang et al., 2002;Ginzel, 2006;胡江等,2006)。胡桃胭脂天牛(Megacyllene caryae)、刺槐巨虎天牛(Megacyllene robiniae)、Neoclytus mucronatus mucronatus和Plectrodera scalator的接触性信息素在交尾体系中也起着关键作用(Ginzel et al., 2003c)。目前已鉴定出的接触性信息素主要是一些表皮烃和酮类物质,如黄星桑天牛的接触性信息素为(Z)-21-甲基-8-三十五碳烯和(Z)-9-二十三碳烯(Fukaya et al., 1996),光肩星天牛、刺槐黄带星天牛(Megacyllene robiniae)以及粗虎天牛(Xylotrechus colonus)的接触性信息素结构与之类似(Zhang et al., 2003;Ginzel et al., 2003a;2003b)。胸斑星天牛(Anoplophora malasiaca)的接触性信息素为(18Z, 21Z, 24Z)-二十七烷-18, 21, 24-三亚乙基四胺-10-酮(Fukaya et al., 1999)。上述这些使用接触性信息素的天牛,在同一株植物上,雌虫体表的接触性信息素在雄虫寻找交配对象及交尾地点中发挥着重要作用。另外,菊小筒天牛(Phytoecia rufiventris)的交尾行为比较特殊,在没有性识别的情况下雄虫也会爬到另一个体上试图交尾。当雄虫爬到另一头个体时,只有其腹部接触到这头虫体腹部末端第五尾板时才识别其性别。当雄虫遇到可接受他的雌虫即可发生交尾,而不表现出任何的求偶反应,但遇到的雌虫不接受雄虫时,雄虫才会展示求爱行为,在这种天牛上没有发现性信息素。在1.5~5.5 cm范围内,菊小筒天牛个体移动所产生的振动可能是引起雄虫与其接触并试图交尾的一个重要信号(Wang et al., 1996)。
但是,有些天牛的交配行为并不由性信息素介导,而是寄主植物的挥发性气味在两性聚集上发挥主导作用,为交尾创造条件。如Zorion guttigerum,雌虫和雄虫分别独立地到达花上,一种性别天牛的到达并不提高其异性到达的可能性(Wang Q et al., 2005b)。
2.2 交配行为的生理节奏及保护配偶现象天牛的交尾活性通常有一定的生理节奏。橘褐天牛的生殖行为1天中有2个活动高峰,首个高峰发生在日落前3 h,第2个则在日落后的2~3 h,天牛飞走时意味着交尾结束。橘褐天牛的交尾生理节奏和产卵紧密相关,在抱对期间交尾和产卵交替发生,交尾时间通常较短(< 60 s)(Wang et al., 2002)。新西兰本地的一种访花天牛成虫求偶行为在10:00—20:00之间有2个高峰,第1个求偶高峰发生在11:00—14:00,另一个则在16:00—18:00(Wang et al., 2005c)。黄星桑天牛交配行为通过日本田间桑树上观察和实验室研究表明:雄虫积极寻找雌虫,其交配高峰发生在早上和下午。但雌雄两性的交尾活性开始时间不同步,有些雄虫刚羽化出来就交尾,但大多数是5 d后开始交尾,而雌虫有50%在羽化10 d后开始交尾(Yokoi, 1989)。灰黄锦天牛的交配行为分析表明,雌虫对雄虫的应答反应在其羽化后6 d达高峰,而雄虫对于雌虫的引诱在其羽化后10 d达到高峰(Akutsu et al., 1983a),同时雌虫性信息素对雄虫引诱活性的有效期较长,能够在雌虫死后保持17 d(Akutsu et al., 1983b)。
抱对和延长交尾是天牛保护配偶的一种方式。在接触性信息素启动交配行为的天牛中,雄虫的好斗行为可阻止其他雄性竞争。柠檬奥天牛、桉嗜木天牛(Phoracantha semipunctata)(Hanks et al., 1996)、白点墨天牛(Hughes, 1981)和星天牛通过延长交尾时间以保护配偶的现象。Zorion guttigerum保护配偶的方式表现在抱对的雄性用触角鞭打入侵者(Wang B O et al., 2005)。
2.3 天牛交配行为的影响因子天牛交配行为与嗅觉、视觉、虫体颜色、形状、大小以及虫体体表的信息化学物质有关。光肩星天牛的交配行为一般是在雌虫对雄虫的视觉作用下启动,苎麻天牛(Paraglenea fortunei)成功交尾的重要决定因素是其多彩的体色(陆群等,1994;李德家,1999;Wang et al., 1990)。Zorion guttigerum暗蓝色的雄性个体较之黄褐色个体具有成功交尾的优势,同时雄性也喜欢选择个体大的雌性以及具有很长触角的暗蓝色雌性交尾(Wang,2002)。白斑星天牛雄虫在实验室条件下寻找雌虫时,嗅觉和视觉具有短距离定向作用,同时面对涂有雌虫提取物的黑色、白色和透明玻璃棒时,天牛显著趋向于黑色(Fukaya et al., 2004)。因此当两性在同一株植物上相遇时,视觉在小范围内寻找和识别配偶中起着重要作用。黄星桑天牛雄虫的交配行为强烈取决于雌虫的形状和体积大小,与颜色无关。其中虫体大小是影响交配行为的最重要因子,交配的最佳虫体体积与野外雌性的平均水平近于相等(Fukaya et al., 1996)。天牛体表不同部位的提取物能引起天牛不同的行为反应,黄星桑天牛雄虫对雌虫前胸表面提取物产生冲撞行为,而整个体表提取物则诱导产生曲腹行为(Fukaya et al., 1995)。另外,大小不同的雄性天牛交尾几率在不同环境中也有所不同。Trachyderes mandibularis个体大的雄虫在交配体系中往往比小个体更占有优势。尽管如此,小个体的雄虫在仙人掌(Saguaro cactus and Cereus giganteus)果实上依然能够成功找到配偶,主要在于个体小的雄虫通过混乱爬行避免了直接与个体大的雄虫发生竞争,另一部分原因是有比虫口更多的仙人掌果实,在这样的条件下,个体大的雄虫不可能垄断雌虫。在沙漠金雀花(Baccharis sarothroides)上,小个体的雄虫却很少能够成功交配,主要在于这种植物上分泌树液的地点少从而被个体大的雄虫所独占(Goldsmith et al., 1993)。
3 天牛信息化学物质在害虫综合治理中的应用将天牛信息化学物质,尤其是将信息素整合到害虫综合治理项目中,用以虫情监测和防治是目前研究和关注的热点问题之一。新西兰已立项在全国普查外来入侵蛀干害虫情况,应用信息素和利他素诱捕法,针对当地大量针叶树和本地特有森林的害虫进行虫情监测。2002—2005年建立旨在探测新定居种的早期预警体系,测试不同诱饵对已定居种和新入侵种诱捕的有效性,研究诱捕器位置和寄主树木远近对诱捕量的效果,从而不断改进诱捕技术。应用α-蒎烯和乙醇,β-蒎烯和乙醇,1, 5-二甲基6,8-二氧双环(3.2.1)-辛烷(frontalin)和乙醇或小蠹二烯醇制成的诱捕器放置在新西兰重要港口、国际机场以及森林附近等害虫高发区。在2002—2004年调查中共捕获27 000头害虫,其中51%~88%为小蠹亚科和天牛科害虫,但大多数是梗天牛属天牛Arhopalus ferus、松红毛林小蠹(Hylurgus ligniperda)和欧洲根小蠹(Hylastes ater),其中以α-蒎烯和乙醇为诱饵对这3种害虫的引诱性最强。试验结果表明:这一项目有助于早期预测任何新入侵及定居的物种,从而提高成功防除害虫的机会(Brockerhoff et al., 2006)。在野外用蔷薇(Rosa multifora)作诱饵树捕杀云斑天牛的效果也非常明显(高瑞桐等,1995)。将松墨天牛的引诱剂与其松饵木搭配使用,具有方便、安全、成本低的优点,大面积应用可降低松墨天牛种群密度,减少松材线虫传播机会,但单独使用则达不到防治松材线虫病的目标(梁细弟等,2000)。
小蠹烯醇和小蠹二烯醇通常被小蠹虫作为信息素,同时也可作为其他蛀干害虫的利他素。在南美单独或混合使用这2种信息素都能够引诱南美松墨天牛和相关的松树蛀干害虫,但随不同地理位置作用范围发生变化:在佛罗里达州、路易斯安那州、乔治亚州和北卡罗来纳州,2种信息素均能提高南美松墨天牛的诱捕量;在佛罗里达州和北卡罗来纳州,2种信息素能够增强对长角天牛属天牛Acanthocinus obsoletus的引诱,而在乔治亚州只有小蠹烯醇对这种害虫具有引诱活性;在佛罗里达州2种信息素对硬叶松脂象有活性,但在路易斯安那州只有小蠹二烯醇有效。在佛罗里达州,应用2种信息素捕获南美松墨天牛、A.obsoletus和硬叶松脂象有效的。在路易斯安那州,小蠹烯醇能够增加吉丁科昆虫Chalcophora virginiensis的诱捕量。2种信息素混合使用对上述4种害虫均有效,同时成本相对较低(Miller et al., 2005)。单独使用小蠹烯醇可引诱樟子松墨天牛(Monochamus galloprovincialis),与其寄主挥发物α-蒎烯和乙醇混用还可增强其引诱性(Pajares et al., 2004)。樟子松墨天牛也能够被小蠹虫的信息素和其寄主挥发物的混合物所引诱,同时小蠹烯醇、马鞭烯酮和甲基-丁烯醇还可作为其增效剂(Ibeas et al., 2007)。在田间诱捕试验中,单独使用小蠹烯醇或与α-蒎烯混用对Monochamus scutellatus scutellatus和Monochamus notatus均有效。小蠹二烯醇与Frontalin混用或单独使用frontalin都能诱捕到许多的Monochamus mutator (Groot et al.,2004)。Frontalin、小蠹烯醇、小蠹二烯醇和三甲基-2-环己烯-1-酮(MCH)的混合物与寄主挥发物混用可诱捕到更多的M.clamator、钝角墨天牛(M.obtusus)、M.notatus和白点墨天牛。在英国哥伦比亚,单独使用上述混合物或(Z/E)7-乙基-5-甲基-6, 8-二氧杂二环(3.2.1)辛烷(exo/endo-brevicomin)、(Z)-马鞭烯醇,(E)-马鞭烯醇和马鞭烯酮的混合物也能诱捕到白点墨天牛和M.clamator,说明在没有寄主植物挥发物的情况下,这些天牛使用与其生态分布区重叠的蛀干害虫的信息素物质作为它们寻找寄主的利他素(Allison et al., 2001)。
4 结束语应用信息化学物质调控昆虫行为的特性防治害虫,将产生巨大的经济、生态和社会效益,从而在害虫综合管理中具有很大的开发潜力。对于使用长距离信息素的天牛,集中诱杀可作为重要的防治策略,而那些使用短距离或接触性信息素的天牛,产卵抑制剂的应用以及寄主挥发物与性信息素的复合使用可能在防治中占主导地位。深入了解天牛的生殖生物学,不仅有助于确定化学通讯中使用的信息素类型及来源,为信息素的鉴定提供基础依据,同时能够准确把握天牛活动的时辰节律,使用引诱性的信息化学物质进行大面积诱捕,从而实现有效监测、预防和控制害虫的目的,减小潜在的经济损失。目前信息化学物质在田间应用主要以大面积诱杀为主,但随着其他类型信息化学物质的鉴定,驱避剂、抑制剂等信息化学物质与诱饵的结合使用可能更有效的调控天牛的行为,从而更好地保护树木及木材资源。
目前天牛化学通讯的研究尚处于信息化学物质的鉴定阶段,与鳞翅目昆虫的化学通讯研究进展还有一段差距。目前已鉴定出350多种鳞翅目昆虫的性信息素(王荫长,2001),同时在嗅觉机制上对气味结合蛋白的研究已取得一定成果(王桂荣等,2002;修伟明等,2005),近年来开始在分子水平上进一步探索信息素生物合成激活神经肽(pheromone biosynthesis activating neuropepide, PBAN)的生理功能及其基因表达(杨惠等,2004)。对天牛这一领域的研究目前还处于空白。最近在昆虫信息素鉴定上又开发出了具有双气相色谱系统的新技术——GC-GC/TOFMS(two-dimensional gas chromatography using a time-of-flight mass spectometic detector),这一技术提供了物质分析的高敏感性和选择性(Kalinová et al., 2006)。相信随着气质联机、核磁共振(nuclear magnetic resonance, NMR)等分析技术的普遍采用和生测、诱捕技术的不断改进以及分子生物学的飞速发展,天牛化学通讯的研究将会迈上新的台阶,在害虫综合管理中将发挥更大的作用。
蔡世民, 黄一平, 黄竞芳. 1989. 侧柏提取物对双条杉天牛引诱作用的初步研究(Ⅰ)——提取物引诱活性测定. 北京林业大学学报, 11(3): 71-78. |
曹兵, 李治中, 姬学龙, 等. 2004. 臭椿提取物对光肩星天牛的驱避作用. 南京林业大学学报:自然科学版, 28(1): 47-49. |
高瑞桐, 王宏乾, 徐邦新, 等. 1995. 云斑天牛补充营养习性及与寄主树关系的研究. 林业科学研究, 8(6): 619-623. |
胡江, 陈树琼, 李义龙, 等. 2006. 雌性信息素在麻点豹天牛成虫交尾行为中的作用. 昆虫知识, 43(2): 251-254. DOI:10.3969/j.issn.0452-8255.2006.02.029 |
嵇保中, 赵博光, 吴如其. 1998. 印楝提取物及双稠派啶类生物咕对桑天牛成活及生殖的影响. 南京林业大学学报, 22(1): 83-86. |
江望锦, 嵇保中, 刘曙雯, 等. 2005. 天牛成虫信息素及嗅觉感受机制研究进展. 昆虫学报, 48(3): 427-436. DOI:10.3321/j.issn:0454-6296.2005.03.019 |
巨云为, 赵博光, 成量, 等. 2003. 印楝提取物对云斑天牛成虫选择取食的影响. 南京林业大学学报:自然科学版, 27(5): 85-87. |
李德家. 1999. 光肩星天牛成虫交配行为机制研究. 北京林业大学学报, 21(4): 33-36. DOI:10.3321/j.issn:1000-1522.1999.04.007 |
李继泉, 樊慧, 金幼菊. 2003. 光肩星天牛对损伤后复叶槭植株的行为反应. 北京林业大学学报, 25(5): 42-46. DOI:10.3321/j.issn:1000-1522.2003.05.010 |
李建光. 2001.光肩星天牛对寄主植物挥发性物质的行为反应及作用机理的研究.北京林业大学博士论文 http: //cdmd.cnki.com.cn/Article/CDMD-10022-2005103897.htm
|
梁细弟, 朱建国, 周关校, 等. 2000. 几种诱杀松墨天牛方法的效果比较及评价. 林业科学研究, 13(4): 366-369. DOI:10.3321/j.issn:1001-1498.2000.04.005 |
陆群, 张玉凤, 章海波. 1994. 对光肩星天牛性信息素的探讨. 内蒙古林业科技, 4: 35-37. |
王桂荣, 郭予元, 吴孔明. 2002. 昆虫触角气味结合蛋白的研究进展. 昆虫学报, 45(1): 131-137. DOI:10.3321/j.issn:0454-6296.2002.01.023 |
王荫长. 2001. 昆虫生物化学. 北京: 中国农业出版社.
|
汪永俊. 1992. 天牛科昆虫的性引诱剂和性信息素. 江苏林业科技, 1: 42-43. |
修伟明, 董双林, 王荫长. 2005. 昆虫信息素结合蛋白及其分子运输机制和生理功能研究进展. 昆虫学报, 48(5): 778-784. DOI:10.3321/j.issn:0454-6296.2005.05.021 |
严敖金, 谭青安. 1998. 桉叶精油对三种天牛的忌避效果. 南京林业大学学报, 22(1): 87-90. |
杨惠, 张金桐. 2004. 昆虫PBAN家族神经肽研究进展. 寄生虫与医学昆虫学报, 11(2): 121-127. DOI:10.3969/j.issn.1005-0507.2004.02.013 |
赵博光, 李小平, 陈小平. 2001. 印楝提取物对桑天牛产卵量及卵孵化率的影响. 林业科学, 37(1): 96-100. DOI:10.3321/j.issn:1001-7488.2001.01.014 |
赵博光, 杨雪云. 1999. 植物源昆虫拒食剂的研究与应用前景. 南京林业大学学报, 23(5): 70-74. DOI:10.3969/j.issn.1000-2006.1999.05.016 |
赵锦年, 蒋平, 吴沧松, 等. 2000. 松墨天牛引诱剂及引诱作用研究. 林业科学研究, 13(3): 262-267. DOI:10.3321/j.issn:1001-1498.2000.03.006 |
周琳, 马志卿, 冯岗, 等. 2006. 天牛性信息素、引诱植物和植物性引诱剂的研究与应用. 昆虫知识, 43(4): 433-438. DOI:10.3969/j.issn.0452-8255.2006.04.001 |
Akutsu K, Kuboki M. 1983a. Mating behavior of the udo longicorn beetle, Acalolepta luxuriosa Bates (Coleoptera: Cerambycidae). Japanese Journal of Applied Entomology and Zoology, 27(3): 189-196. DOI:10.1303/jjaez.27.189 |
Akutsu K, Kuboki M. 1983b. Analysis of mating behavior of Udo longicorn beetle, Acalolepta luxuriosa Bates (Coleoptera: Cerambycidae). Japanese Journal of Applied Entomology and Zoology, 27(4): 247-251. DOI:10.1303/jjaez.27.247 |
Allison J D, Borden J H, Mcintosh R L, et al. 2001. Kairomonal response by four Monochamus species (Coleoptera: Cerambycidae) to bark beetle pheromones. Journal of Chemical Ecology, 27(4): 633-646. DOI:10.1023/A:1010353315939 |
Allison J D, Borden J H, Seybold S J. 2004. A review of the chemical ecology of the Cerambycidae (Coleoptera). Chemoecology, 14: 123-150. |
Anbutsu H, Togashi K. 2001. Oviposition deterrent by female reproductive gland secretion in Japanese pine sawyer, Monochamus alternatus. Journal of Chemical Ecology, 27(6): 1151-1161. DOI:10.1023/A:1010363912326 |
Anbutsu H, Togashi K. 2002. Oviposition deterrence associated with larval frass of the Japanese pine sawyer, Monochamus alternatus (Coleoptera: Cerambycidae). Journal of Insect Physilogy, 48(4): 459-465. DOI:10.1016/S0022-1910(02)00067-7 |
Barbour J D, Cervantes D E, Lacey E S, et al. 2006. Calling behavior in the primitive longhorned beetle Prionus californicus Mots. Journal of Insect Behavior, 19(5): 623-629. DOI:10.1007/s10905-006-9050-3 |
Berkov A, Meurer-Grimes B, Purzycki K L. 2000. Do Lecythidaceae specialists (Coleoptera, Cerambycidae) shun fetid tree species?. Biotropica, 32(3): 440-451. DOI:10.1111/j.1744-7429.2000.tb00491.x |
Boyer F D, Malosse C, Zagatti P, et al. 1997. Identification and synthesis of vesperal, the female sex pheromone of the longhorn beetle Vesperus xatarti. Bull Soc Chim Fr, 134: 757-764. |
Brockerhoff E G, Jones D C, Kimberley M O, et al. 2006. Nationwide survey for invasive wood-boring and bark beetles (Coleoptera) using traps baited with pheromones and kairomones. Forest ecology and management, 228(1/3): 234-240. |
Cervantes D E, Hanks L M, Lacey E S, et al. 2006. First documentation of a volatile sex pheromone in a longhorned beetle (Coleoptera: Cerambyicidae) of the primitive subfamily Prioninae. Annals of the Entomological Society of America, 99(4): 718-722. DOI:10.1603/0013-8746(2006)99[718:FDOAVS]2.0.CO;2 |
Esaki K. 2006. Deterrent effect of weed removal in Zelkova serrata nursery on oviposition of Apriona japonica Thomson (Coleoptera: Cerambycidae). Applied Entomology and Zoology, 41(1): 83-86. DOI:10.1303/aez.2006.83 |
Fan J T, Sun J H. 2006. Influences of host volatiles on feeding behaviour of the Japanese pine sawyer, Monochamus alternatus. Journal of Applied Entomology, 130(4): 238-244. DOI:10.1111/j.1439-0418.2006.01045.x |
Fukaya M, Akino T, Yasuda T, et al. 1999. Mating sequence and evidence for synergistic component in female contact sex pheromone of the white-spotted longicorn beetle, Anoplophora maiasiaca (Thomson) (Coleoptera: Cerambycidae). Entomological Science, 2(2): 183-187. |
Fukaya M, Akino T, Yasuda T, et al. 2004. Visual and olfactory cues for mate orientation behaviour in male white-spotted longicorn beetle, Anoplophora malasiaca. Entomologia Experimentalis et Applicata, 111(2): 111-115. DOI:10.1111/j.0013-8703.2004.00147.x |
Fukaya M, Honda H. 1995. Reproductive biology of the yellow-spotted longicorn beetle, Psacothea hilaris (Pascoe) (Coleoptera: Cerambycidae). Ⅱ. Evidence for two pheromone components with different functions. Applied Entomology and Zoology, 30(3): 467-470. DOI:10.1303/aez.30.467 |
Fukaya M, Honda H. 1996. Reproductive biology of the yellow-spotted longicorn beetle, Psacothea hilaris (Pascoe) (Coleoptera: Cerambycidae) Ⅳ. Effects of shape and size of female models on male mating behaviors. Applied Entomology and Zoology, 31(1): 51-58. |
Fukaya M, Yasuda T, Wakamura S, Honda H. 1996. Reproductive biology of the yellow-spotted longicorn beetle, Psacothea hilaris (Pascoe) (Coleoptera: Cerambycidae). Ⅲ. Identification of contact sex pheromone on female body surface. Journal of Chemical Ecology, 22: 259-270. DOI:10.1007/BF02055097 |
Ginzel M D, Blomquist G J, Millar J G, et al. 2003a. Role of contact pheromones in mate recognition in Xylotrechus colonus. Journal of Chemical Ecology, 29(3): 533-5451. DOI:10.1023/A:1022894419521 |
Ginzel M D, Millar J G, Hanks L M. 2003b. (Z)-9-Pentacosene-contact sex pheromone of the locust borer, Megacyllene robiniae. Chemoecology, 13: 135-1411. DOI:10.1007/s00049-003-0239-z |
Ginzel M D, Hanks L M. 2003c. Contact pheromones as mate recognition cues of four species of longhorned beetles (Coleoptera: Cerambycidae). Journal of Insect Behavior, 16(2): 181-187. DOI:10.1023/A:1023911701159 |
Ginzel M D, Moreira J A, Ray A M, et al. 2006. (Z)-9-nonacosene-major component of the contact sex pheromone of the beetle Megacyllene caryae. Journal of Chemical Ecology, 32(2): 435-451. DOI:10.1007/s10886-005-9010-y |
Goldsmith S K, Alcock J. 1993. The mating chances of small males of the cerambycid beetle Trachyderes mandibularis differ in different environments (Coleoptera: Cerambycidae). Journal of Insect Behavior, 6(3): 351-360. DOI:10.1007/BF01048116 |
Groot P, Nott R W. 2004. Response of the whitespotted sawyer beetle, Monochamus s.scutellatus, and associated woodborers to pheromones of some Ips and Dendroctonus bark beetles. Journal of Applied Entomology, 128(7): 483-487. DOI:10.1111/j.1439-0418.2004.00877.x |
Hall D R, Cork A, Phythian S J, et al. 2006. Identification of components of male-produced pheromone of coffee white stemborer, Xylotrechus quadripes. Journal of Chemical Ecology, 32(1): 195-219H. DOI:10.1007/s10886-006-9360-0 |
Hanks L M, Millar J G, Paine T D. 1996. Mating behavior of the eucalyptus longhorned borer (Coleoptera: Cerambycidae) and the adaptive significance of long "horns". Journal of Insect Behavior, 9: 383-393. DOI:10.1007/BF02214017 |
Hughes A L. 1981. Differential male mating success in the whitespotted sawyer Monochamus scutellatus (Coleoptera: Cerambycidae). Ann Entomol Soc Am, 74: 180-184. DOI:10.1093/aesa/74.2.180 |
Ibeas F, Gallego D, Diez J J, et al. 2007. An operative kairomonal lure for managing pine sawyer beetle Monochamus galloprovincialis (Coleoptera: Cerymbycidae). Journal of Applied Entomology, 131(1): 13-20. DOI:10.1111/j.1439-0418.2006.01087.x |
Koul O, Smirle M J. 1994. Allomones in insect plant interactions. Gujar G T//Recent Alvances of Insect Physiology and Toxidagy. New Delui, India Agricde Publishing Academy, 14-40
|
Kalinová B, Jiroá P, Zd'árek J, et al. 2006. GC GC/TOF MS technique—A new tool in identification of insect pheromones: Analysis of the persimmon bark borer sex pheromone gland. Talanta, 69: 542-547. DOI:10.1016/j.talanta.2005.10.045 |
Kuboki M, Akutsu K, Sakai A, et al. 1985. Bioassay fo the sex pheromone of the udo longicorn beetle, Acalolepta luxuriosa Bates (Coleoptera: Cerambycidae). Applied Entomology and Zoology, 20(1): 88-89. DOI:10.1303/aez.20.88 |
Lacey E S, Ginzel M D, Millar J G, et al. 2004. Male-produced aggregation pheromone of the cerambycid beetle. Journal of Chemical Ecology, 30(8): 1493-1507. DOI:10.1023/B:JOEC.0000042064.25363.42 |
Leal W S, Bento J M S, Vilela E F, et al. 1994. Female sex pheromone of the longhorn beetle Migdolus fryanus Westwood: N-(2'S)-methylbutanoyl 2-methylbutylamine. Experientia, 50: 853-856. DOI:10.1007/BF01956471 |
Leal W S, Shi X W, Nakamuta k, et al. 1995. Structure stereochemistry, and thermal isomerization of the male sex pheromone of the longhorn beetle Anaglyptus subfasciatus. Proc Natl Sci USA, 92(4): 1038-1042. DOI:10.1073/pnas.92.4.1038 |
Li S Q, Zhang Z N. 2006. Influence of larval frass extracts on the oviposition behaviour of Monochamus alternatus (Coleoptera: Cerambycidae). Journal of Applied Entomology, 130(3): 177-182. DOI:10.1111/j.1439-0418.2006.01039.x |
Miller D R, Asaro C. 2005. Ipsenol and ipsdienol attract Monochamus titillator (Coleoptera: Cerambycidae) and associated large pine woodborers in Southeastern United States. Journal of Economic Entomology, 98(6): 2033-2040. DOI:10.1093/jee/98.6.2033 |
Montgomery M E, Wargo P M. 1983. Ethanol and other host-derived volatiles as attractants to beetles that bore into hardwoods. Journal of Chemical Ecology, 9(2): 181-190. DOI:10.1007/BF00988035 |
Nakamuta K, Leal W S, Nakashima T, et al. 1997. Increase of trap catches by a combination of male sex pheromones and floral attractant in longhorn beetle, Anaglyptus subfasciatus. Journal of Chemical Ecology, 23(6): 1635-1640. DOI:10.1023/B:JOEC.0000006427.56337.6c |
Nowak D J, Pasek J E, Sequeira R A, et al. 2001. Potential effect of Anoplophora glabripennis (Coleoptera: Cerambycidae) on urban trees in the United States. Journal of Economic Entomology, 94: 116-122. DOI:10.1603/0022-0493-94.1.116 |
Pajares J A, Ibeas F, Diez J J, et al. 2004. Attractive responses by Monochamus galloprovincialis (Col.: Cerambycidae) to host and bark beetle semiochemicals. Journal of Applied Entomology, 128: 633-638. |
Peddle S, Grootf P, Smith S. 2002. Oviposition behaviour and response of Monochamus scutellatus (Coleoptera: Cerambycidae) to conspecific eggs and larvae. Agricultural and Forest Entomology, 4: 217-222. DOI:10.1046/j.1461-9563.2002.00145.x |
Phillips T W, Wilkening A J, Atkinson T H, et al. 2001. Synergism of turpentine and ethanol as attractants for certain pine-infesting beetles (Coleoptera). Environ Entomol, 17(3): 456-462. |
Poland T M, Haack R A, Petrice T R, et al. 2006. Laboratory evaluation of the toxicity of systemic insecticides for control of Anoplophora glabripennis and Plectrodera scalator (Coleoptera: Cerambycidae). Journal of Economic Entomology, 99(1): 85-93. DOI:10.1603/0022-0493(2006)099[0085:LEOTTO]2.0.CO;2 |
Rhainds M, Lan C C, King S, et al. 2001. Pheromone communication and mating behaviour of coffee white stem borer, Xylotrechus quadripes Chevrolat (Coleoptera: Cerambycidae). Appl Entomol Zool, 36: 299-309. DOI:10.1303/aez.2001.299 |
Sakai M, Toruyamasaki T. 1991. (+)-cis-3-Pinen-2-ol: Attractant for male cerambycid beetle, Monochamus alternatus hope. Journal of Chemical Ecology, 17(4): 757-765. DOI:10.1007/BF00994198 |
Sakai M, Yamasaki T. 1990. (+)-Juniperol and (+)-pimaral: Attractants for the cerambycid beetle, Monochamus alternatus Hope. Journal of Chemical Ecology, 16(12): 3383-3392. DOI:10.1007/BF00982105 |
Schoeman P S, van Hamburg H, Pasques B P. 1998. The morphology and phenology of the white coffee stem borer, Monochamus leuconotus (Pascoe) (Coleoptera: Cerambycidae), a pest of Arabica coffee. Arican Entomol, 6: 83-89. |
Suckling D M, Gibb A R, Daly J M, et al. 2001. Behavioral and electrophysiological responses of Arhopalus tristis to burnt pine and other stimuli. Journal Chemical Ecology, 27(6): 1091-1104. DOI:10.1023/A:1010355710509 |
Wang B O, Gao R T, Mastro V C, et al. 2005. Toxicity of four systemic neonicotinoids to adults of Anoplophora glabripennis (Coleoptera: Cerambycidae). Journal of Economic Entomology, 98(6): 2292-2300. DOI:10.1093/jee/98.6.2292 |
Wang Q. 2002. Sexual selection of Zorion guttigerum Westwood (Coleoptera: Cerambycidae: Cerambycinae) in relation to body size and color. J Insect Behav, 15: 675-687. DOI:10.1023/A:1020747907490 |
Wang Q, Chen L Y, Li J S, et al. 1996. Mating behavior of Phytoecia rufiventris Gautier (Coleoptera: Cerambycidae). Journal of Insect Behavior, 9(1): 47-60. DOI:10.1007/BF02213723 |
Wang Q, Davis L K. 2005a. Mating behavior of Oemona hirta (F.) (Coleoptera: Cerambycidae: Cerambycinae) in laboratory conditions. Journal of Insect Behavior, 18(2): 187-191. |
Wang Q, Chen L Y. 2005b. Mating behavior of a flower-visiting longhorn beetle Zorion guttigerum (Westwood) (Coleoptera: Cerambycidae: Cerambycinae). Naturwissenschaften, 92: 237-241W. DOI:10.1007/s00114-005-0615-3 |
Wang Q, Zeng W Y, Li J S. 1990. Reproductive behaviour of Paraglenea fortunei (Coleoptera: Cerambycidae). Ann Entomol Soc Am, 83: 860-866. DOI:10.1093/aesa/83.4.860 |
Yokoi N. 1989. Observations on the mating behaviour of the yellow-spotted longicorn beetle, Psacothea hilaris Pascoe (Coleoptera: Cerambycidae). Japanese Journal of Applied Entomology and Zoology, 33(4): 175-179. DOI:10.1303/jjaez.33.175 |
Zhang A J, James E, Oliver K, et al. 2003. Evidence for contact sex recognition pheromone of the Asian longhorned beetle, Anoplophora glabripennis (Coleoptera: Cerambycidae). Naturwissenschaften, 90: 410-413. DOI:10.1007/s00114-003-0452-1 |
 2007, Vol. 43
2007, Vol. 43

