文章信息
- 陈月异, 史敏晶, 田维敏.
- Chen Yueyi, Shi Minjing, Tian Weimin.
- 印度紫檀营养贮藏蛋白质的主要特性
- Main Characteristics of Vegetative Storage Proteins in Pterocarpus indicus
- 林业科学, 2007, 43(9): 13-17.
- Scientia Silvae Sinicae, 2007, 43(9): 13-17.
-
文章历史
- 收稿日期:2006-08-21
-
作者相关文章
自20世纪80年代中期以来,在不同类群树木的营养器官中发现一类专门的贮藏蛋白质,称为营养贮藏蛋白质(vegetative storage proteins, VSPs)(Stepien et al., 1994)。对营养贮藏蛋白质的季节变化已有大量的研究报道,充分肯定了营养贮藏蛋白质的氮素贮藏功能(Wetzel et al., 1989;1991;田维敏等,2000;2001;田维敏,2003;Peng et al., 2004),并且以杨树为模式植物对营养贮藏蛋白质的细胞学、生物化学和分子生物学进行了系统而深入地研究(Sauter et al., 1990;Wetzel et al., 1991;Stepien et al., 1992;1994)。但是,得到分离鉴定的树木营养贮藏蛋白质不多(Greenwood et al., 1986;Wetzel et al., 1991;彭方仁等,2001;Tian et al., 2003;Wisniewski et al., 2004;王旭初等,2004),大多限于细胞学研究。这些研究表明树木VSPs的细胞学和生化性质具有多样性。印度紫檀(Pterocarpus indicus),一种热带亚热带植物,蝶形花科(Fabaceae)紫檀属,落叶大乔木。本文对印度紫檀VSPs进行分离鉴定,旨在加深对树木VSPs的多样性和统一性的认识。
1 材料与方法 1.1 材料选用种植于海南岛西北部的华南热带农业大学校园内的印度紫檀为试验材料。分别于落叶期(2005年12月)和新梢发育期(2006年4月)采样,采样部位包括末端小枝条、2~3年生枝条、树干和大根的树皮和木质部。
荔枝(Litchi chinensis)22 ku、大叶桃花心木(Swietenia macrophylla)21 ku、巴西橡胶树(Hevea brasiliensis)67 ku VSPs的多克隆抗体由作者制备。用上述3种抗体分别对印度紫檀、荔枝、大叶桃花心木、无患子(Sapindus mukorossi)、巴西橡胶树的树皮可溶性总蛋白进行免疫印迹检测。
1.2 方法 1.2.1 光学显微镜观察材料制备以印度紫檀落叶期和新梢发育期的末端小枝条、2~3年生枝条、树干、大根的树皮和木质部为材料,标本用含4%戊二醛的0.1 mol·L-1磷酸缓冲液(pH7.5)在室温条件下固定24 h。经乙醇/正丁醇系列脱水,石蜡包埋。切片(厚度15 μm)用专一性显示蛋白质的汞-溴酚蓝法染色(Pearse, 1960)。
1.2.2 电子显微镜观察材料制备以落叶期的末端小枝为材料,标本用含6%戊二醛的0.1 mol·L-1磷酸盐缓冲液(pH7.2)在4 ℃条件下固定24 h,再用含2% OsO4的相同缓冲液后固定6 h。经乙醇系列脱水,环氧丙烷过渡后包埋于Epon812树脂中。用LKB-V超薄切片机切片,醋酸铀和柠檬酸铅染色,JEM100CX-11透射电镜观察。
1.2.3 可溶性蛋白质提取和SDS-PAGE可溶性蛋白质提取参照Tian等(2003)方法。2 g鲜质量的样品加5 mL提取液(0.1 mol·L-1 Tris碱,0.05 mol·L-1抗坏血酸,1%β-巯基乙醇,0.1% Triton X-100, 1 mmol·L-1 PMSF, 2%PVP, pH8.5),在冰浴条件下研磨成匀浆。在4 ℃及35 000 g条件下离心30 min后收集上清液。用Bradford (1976)方法测定上清液中蛋白质含量。SDS-PAGE电泳参照Tian等(2002)的方法。
1.2.4 免疫印迹技术免疫印迹技术参照Tian等(2003)的方法。
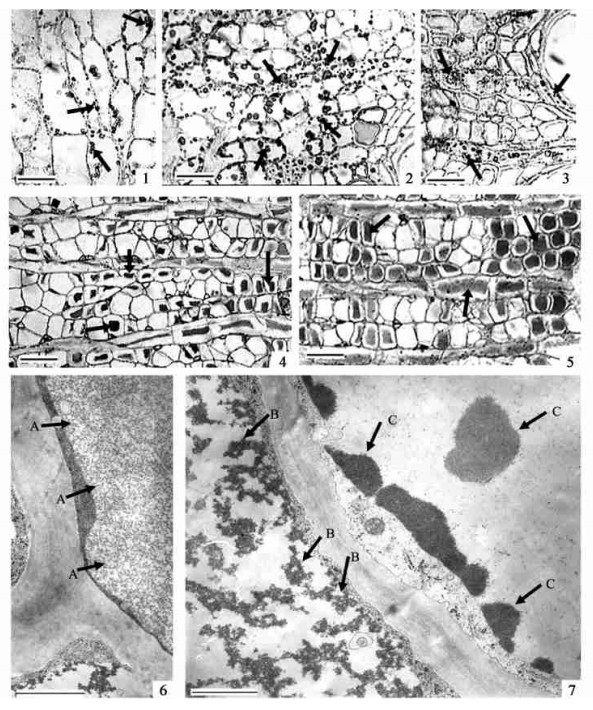
2 结果与分析 2.1 贮藏蛋白质细胞在经汞-溴酚蓝染色的石蜡切片中,观察到印度紫檀落叶期末端小枝的木薄壁细胞、木射线薄壁细胞、韧皮薄壁细胞、韧皮射线薄壁细胞、皮层薄壁细胞以及树干、大根的韧皮薄壁细胞、韧皮射线薄壁细胞中含有丰富的蓝色的液泡内含物(图版Ⅰ-1~5),这些蓝色的液泡内含物是蛋白质。这些液泡蛋白质内含物在不同的部位其形状及被染色的深浅程度不一,在末端枝条中呈深蓝色颗粒状(图版Ⅰ-1~3),在树干、大根中呈鲜蓝色块状(图版Ⅰ-4~5)。在新梢发育时期,积累在枝条中的液泡蛋白质内含物明显消失,但积累在树干和大根中的液泡蛋白质内含物和落叶期相比没有明显变化(图片未显示)。
|
图版Ⅰ 印度紫檀营养贮藏蛋白质的主要特性
Plate Ⅰ Main characteristics of vegetative storage proteins in Pterocarpus indicus
箭头示液泡蛋白质内含物。1~5. 印度紫檀落叶期横切面光镜照片, 示液泡蛋白质内含物的分布。1. 末端枝条皮层; 2. 末端枝条韧皮部; 3. 末端枝条木质部; 4. 树干韧皮部; 5. 大根韧皮部; 6, 7. 印度紫檀落叶期末端枝条横切面电镜照片, 示液泡蛋白质内含物的超微结构。A. 均一状; B. 絮状; C. 团块状。 Arrows indicate vacuolar protein inclusions. 1~5. Light micrographs of P. indicus in cross-section during leafless stage, show the distribution of vacuolar protein inclusions. 1. Cortex of terminal branch; 2. Phloem of terminal branch;3. Xylem of terminal branch; 4. Phloem of stem;5. Phloem of large root; 6, 7. Electron micrographs of terminal branch of P. indicus in cross-section, showing the ultrastructure of vacuolar inclusions. A. Homogeneous form; B. Floccular form; C. Nubbly form. 标尺 Bars: 25 μm (1, 2, 3); 50 μm (4, 5); 2 μm (6); 1.25 μm (7). |
电镜观察含液泡蛋白质内含物的末端枝条表明,在中央大液泡中有许多电子致密的颗粒,这些颗粒相当于光镜下观察到的液泡蛋白质内含物。这些液泡蛋白质内含物具有不同的形状,大致可以分为3种:电子致密的团块状、絮状和均一状(图版Ⅰ-6~7)。每个贮藏蛋白质细胞中只含有一种形状的液泡蛋白质内含物,即不同形状的液泡蛋白质内含物存在于不同的贮藏蛋白质细胞中。
2.2 主要蛋白质的分布及变化落叶期,在末端枝条、2~3年生枝条、树干、大根的树皮可溶性蛋白SDS-PAGE图谱上可以观察到4条相对含量高的蛋白谱带,分子量分别为33.5、28、21和19.5 ku,这4种蛋白质也存在于末端枝条、2~3年生枝条、树干和大根的木质部中,但在树干和大根木质部中的含量明显低于末端枝条、2~3年生枝条(图 1)。

|
图 1 印度紫檀落叶期可溶性蛋白质SDS-PAGE图谱 Fig. 1 SDS-PAGE polypeptide profiles of soluble protein from P.indicus during leafless stage 箭头示印度紫檀VSPs。Arrows indicate VSPs of P.indicus. S.标准蛋白质Standard proteins; 1.末端小枝皮Bark of terminal branch; 2. 2~3年生枝条皮Bark of 2~3-year-old branch; 3.树干皮Bark of trunk; 4.大根皮Bark of large root; 5.末端小枝木Xylem of terminal branch; 6. 2~3年生枝条木Xylem of 2~3-year-old branch; 7.树干木Xylem of trunk; 8.大根木Xylem of large root.分离胶浓度为14%,每槽上样量为20 μg总蛋白。Concentration of SDS-polyacrylamide gels was 14%, and totally 20 μg protein sample was loaded per lane. |
在新梢发育期,这4种蛋白质在末端枝条、2~3年生枝条的树皮组织中的含量明显减少,但在树干、大根的树皮组织中,其含量与落叶期相比没有明显变化(图 2)。
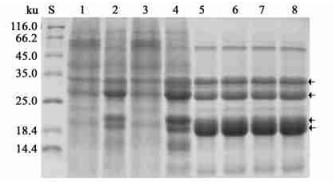
|
图 2 印度紫檀不同时期可溶性蛋白质SDS-PAGE图谱 Fig. 2 SDS-PAGE polypeptide profiles of soluble protein from P. indicus during different stages 箭头示印度紫檀VSPs。Arrows indicate VSPs of P.indicus. S.标准蛋白质Standard proteins; 1,3,5,7.分别为抽梢期末端小枝皮、2~3年生枝条皮、树干皮、大根皮Bark of terminal branch, 2~3-year-old branch, trunk, large root during new shoot development stage respectively. 2, 4, 6, 8.分别为落叶期末端小枝皮、2~3年生枝条皮、树干皮、大根皮Bark of terminal branch, 2~3-year-old branch, trunk, large root during leafless stage respectively.分离胶浓度为14%, 每槽上样量为20 μg总蛋白。Concentration of SDS-polyacrylamide gels was 14%, and totally 20 μg protein sample was loaded per lane. |
从5种热带树木树皮的可溶性总蛋白免疫印迹图谱上(图 3)可以看到,这3种抗体都与各自本身的抗原及VSPs发生免疫反应;印度紫檀33.5、28、21、19.5 ku VSP s与这3种多克隆抗体不发生免疫反应;荔枝22 ku多克隆抗体与无患子22.5 ku VSPs发生强免疫反应,与大叶桃花心木21 ku、橡胶树67 ku VSPs不发生免疫反应;大叶桃花心木21 ku多克隆抗体与荔枝22 ku、无患子22.5 ku、橡胶树67 ku VSPs不发生免疫反应;橡胶树67 ku VSPs的多克隆抗体与荔枝22 ku、大叶桃花心木21 ku、无患子22.5 ku VSPs亦不发生免疫反应。
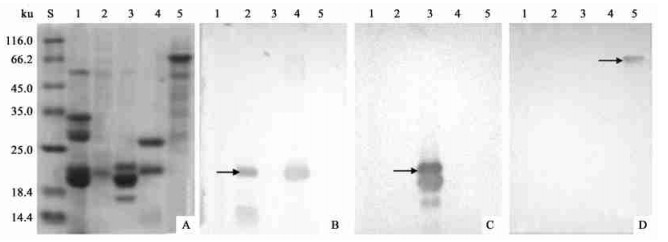
|
图 3 5种热带树木树皮可溶性蛋白质SDS-PAGE(A)和3种VSP抗体对它的免疫印迹图谱(B,C,D) Fig. 3 SDS-PAGE of soluble protein from bark of five tropical trees(A) and western immunoblot of its duplication by using three antiserum against different VSPs (B, C, D) B.荔枝22 ku VSP抗体(箭头) Antiserum against 22 ku VSP in L. chinensis(Arrow); C.大叶桃花心木21 ku VSP抗体(箭头) Antiserum against 21 ku VSP in S. macrophylla(Arrow); D.巴西橡胶树67 ku VSP抗体(箭头) Antiserum against 67 ku VSP in H. brasiliensis(Arrow);S.标准蛋白质Standard proteins. 1-5分别为印度紫檀、荔枝、大叶桃花心木、无患子、巴西橡胶树树皮可溶性蛋白质Soluble proteins of bark tissues from P. indicus, L. chinensis, S. macrophylla, S. mukorossii, H. brasiliensis respectively.分离胶浓度为12%,每槽上样量为20 μg总蛋白。Concentration of SDS-polyacrylamide gels was 12%, and totally 20 μg protein sample was loaded per lane. |
一般认为树木营养贮藏蛋白质具有以下特点:1)积累在液泡中;2)在贮藏组织的可溶性蛋白中相对含量高;3)有明显的季节变化,在休眠季节大量积累,在树木重新生长后消失(Clausen et al., 1991)。在落叶期,印度紫檀的枝条、树干、大根的树皮组织中存在相对含量高的4种可溶性蛋白质,分子量分别为33.5、28、21和19.5 ku,树木抽新梢后,随着新梢的发育,积累在枝条中的这4种蛋白质明显消失;这4种蛋白质与贮藏蛋白质细胞中的液泡蛋白质内含物的分布和变化一致,说明这4种蛋白质是液泡蛋白质内含物的主要成分。因此,这4种蛋白质应当是印度紫檀的营养贮藏蛋白质。
在不同类群树木中,液泡蛋白质内含物的超微结构存在明显差异。有的树木液泡蛋白质内含物的超微结构只有一种形状,有的树木液泡蛋白质内含物的超微结构有2~3种形状(Wu et al., 1987;Wetzel et al., 1989;Sauter et al., 1990;Hao et al., 1993)。印度紫檀的液泡蛋白质内含物的超微结构大致可以分为3种形状,不同形状的蛋白质内含物位于不同的贮藏蛋白质细胞中,具有细胞特异性(Wetzel et al., 1989;Hao et al., 1993),蛋白质超微结构的差异可能与VSPs的种类不同有关(Tian et al., 2002)。
在新梢生长发育时期,积累在枝条中的营养贮藏蛋白质明显消失,而积累在树干和根中的营养贮藏蛋白质与落叶期相比没有明显变化,说明枝条中的营养贮藏蛋白质是新梢生长发育所需氮素的主要来源。对大叶桃花心木年生长周期中VSPs季节变化规律的研究表明末端小枝(1~2年生)VSPs的消失和新梢生长同步,而树干和大根VSPs的消失滞后新梢的生长(Tian et al., 2003)。积累在树干和大根中的营养贮藏蛋白质将为这些部位各自的增粗生长所消耗(Tian et al., 2003)。
不同科的软材树种之间,营养贮藏蛋白质是免疫相关的。除无营养贮藏蛋白质的常绿树种巨杉(Sequoiadendron giganteum)外, 杉科(Taxodiaceae)植物落羽杉(Taxodium distichum)的35 ku蛋白质抗体能识别同一科植物水杉(Metasequoia glyptostroboides)的32 ku和34 ku蛋白质以及红豆杉科(Taxaceae)欧洲红豆杉(Taxus baccata)的34 ku和36 ku蛋白质(Harms et al., 1991)。但在不同科的硬材树种之间,营养贮藏蛋白质似乎缺乏免疫相关性。使用杨树32 ku蛋白质的抗体对包括杨柳科(Salicaceae)树木在内的6科11种温带落叶树木的树皮蛋白质进行了免疫印迹分析,结果表明,只在杨柳科树木的树皮可溶性蛋白质的SDS-PAGE图谱上检测到与该抗体发生免疫反应的蛋白质谱带(Wetzel et al., 1991)。本文采用免疫印迹技术,使用作者制备的荔枝(无患子科Sapindaceae)22 ku VSPs、大叶桃花心木(楝科Meliaceae)的21 ku VSPs和巴西橡胶树(大戟科Euphorbiaceae)67 ku VSPs的多克隆抗体对印度紫檀(蝶形花科)、大叶桃花心木(楝科)、巴西橡胶树(大戟科)、荔枝(无患子科)和无患子(无患子科)的营养贮藏蛋白质的免疫相关性进行交叉检测,结果表明,同属无患子科的荔枝和无患子的营养贮藏蛋白质存在免疫相关性,而不同科树木的营养贮藏蛋白质之间缺乏免疫相关性,这可能是硬材树种有别于软材树种的特点。树木营养贮藏蛋白质生化性质的多样性可能反映了生物学功能的多样性。
彭方仁, 郭娟, 徐柏森. 2001. 木本植物营养贮藏蛋白质研究进展. 植物学通报, 18(4): 445-450. DOI:10.3969/j.issn.1674-3466.2001.04.008 |
田维敏, 吴继林, 郝秉中, 等. 2000. 15科温带树木营养贮藏蛋白质的细胞学研究. 西北植物学报, 20(5): 835-841. DOI:10.3321/j.issn:1000-4025.2000.05.023 |
田维敏, 高政权, 孟春晓, 等. 2001. VSPs在热带树木中分布的细胞学研究. 热带作物学报, 12(4): 1-8. DOI:10.3969/j.issn.1000-2561.2001.04.001 |
田维敏. 2003. 树木营养贮藏蛋白质. 北京: 中国林业出版社.
|
王旭初, 史敏晶, 陈月异, 等. 2004. 无患子科树木细子龙营养贮藏蛋白质的分离鉴定. 热带作物学报, 25(4): 78-83. DOI:10.3969/j.issn.1000-2561.2004.04.016 |
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Clausen S, Apel K. 1991. Seasonal changes in the concentration of the major storage protein and its mRNA in xylem ray cells of poplar trees. Plant Mol Biol, 17: 669-678. DOI:10.1007/BF00037052 |
Greenwood J S, Stinissen H M, Peumans W J, et al. 1986. Sambucus nigra agglutinin is located in protein bodies in the phloem parenchyma of the bark. Planta, 167: 275-278. DOI:10.1007/BF00391426 |
Harms U, Sauter J J. 1991. Storage proteins in the wood of Taxodiaceae and of Taxus. J Plant Physiol, 138: 497-499. DOI:10.1016/S0176-1617(11)80530-4 |
Hao Bingzhong, Wu Jiling. 1993. Vacuole proteins in parenchyma cells of secondary phloem and xylem of Dalbergia odorifera. Trees, 8: 104-109. |
Pearse A G E. 1960. Histochemistry: theoretical and applied. J & A Churchill, LTD, London
|
Peng Fangren, Guo Juan, Wan Gaiping. 2004. Subcellular localization of vegetative storage protein of Ginkgo biloba. Acta Botanica Sinica, 46(1): 77-85. |
Sauter J J, Van Cleve B. 1990. Biochemical, immunochemical and ultrastructural studies of protein storage in poplar (Populus×canadensis 'robusta') wood. Planta, 183: 92-100. |
Stepien V, Martin F. 1992. Purification, characterization and localization of the bark storage proteins of poplar. Plant Physiol Biochem, 30: 399-407. |
Stepien V, Sauter J J, Martin F. 1994. Vegetative storage proteins in woody plants. Plant Physiol Biochem, 32: 185-192. |
Tian Weimin, Wu Jilin, Hao Bingzhong, et al. 2002. Vegetative storage proteins in Meliaceae. Acta Botanica Sinica, 44(2): 242-245. |
Tian Weimin, Wu Jilin, Hao Bingzhong, et al. 2003. Vegetative storage proteins in the tropical tree Swietenia macrophylla: seasonal fluctuation in relation to a fundamental role in the regulation of tree growth. Can J Bot, 81: 492-500. DOI:10.1139/b03-045 |
Wetzel S, Demmers C, Greenwood J S. 1989. Seasonally fluctuating bark protein are a potential form of nitrogen storage in three temperate hardwoods. Planta, 178: 275-281. DOI:10.1007/BF00391854 |
Wetzel S, Greenwood J S. 1991. The 32-kilodalton vegetative storage protein of Salfx microstachya turz characterization and immuno-localization. Plant Physiol, 97: 771-777. DOI:10.1104/pp.97.2.771 |
Wisniewski M, Bassett C, Arara R. 2004. Distribution and partial characterization of seasonally expressed proteins in different aged shoots and roots of 'Loring' peach (Prunus persica). Tree physiol, 24: 339-345. DOI:10.1093/treephys/24.3.339 |
Wu Jilin, Hao Bingzhong. 1987. Ultrastructure and differentiation of protein-storing cells in secondary phloem of Hevea brasiliensis stem. Ann Bot, 60: 505-515. DOI:10.1093/oxfordjournals.aob.a087473 |
 2007, Vol. 43
2007, Vol. 43

