文章信息
- 宋会兴, 钟章成, 王开发.
- Song Huixing, Zhong Zhangcheng, Wang Kaifa.
- 土壤水分和接种VA菌根对构树根系形态和分形特征的影响
- Effects of Soil Moisture and VAM Inoculation on Root Morphology and Fractal Character in Broussonetia papyrifera
- 林业科学, 2007, 43(7): 142-147.
- Scientia Silvae Sinicae, 2007, 43(7): 142-147.
-
文章历史
- 收稿日期:2006-03-31
-
作者相关文章
2. 曲阜师范大学生命科学学院 曲阜 273165;
3. 第三军医大学基础医学部 重庆 400038
2. School of Life Science, Qufu Normal University Qufu 273165;
3. College of Medicine, Third Military Medical University Chongqing 400038
石灰岩生态系统是一种脆弱的退化生态系统。由于岩石易水解形成溶蚀地貌,土壤水分难以保存,水土流失现象普遍,尤其原生植被破坏后,生境更加恶化,植被恢复非常困难(谢宗强等,1995)。改善植物根系形态和功能从而使植物体更加有效地吸收水分和矿质营养,对退化生态系统的植被恢复具有非常重要的意义(Folk et al., 1997)。近年来,越来越多的研究结果表明:泡囊状丛枝菌根(vesicular-arbuscular mycorrhiza,VA)可以通过营养物质获取、保持植株水分状态等显著提高宿主植物的抗逆性(Smith et al., 1997)。Atkinson等(2003)认为VA菌根对宿主根系的空间结构有重要的影响,而根系的空间结构又直接影响植物对土壤水分和矿质元素的吸收能力。因此VA菌根真菌在石灰岩生态系统植被恢复过程中具有重要的潜在应用价值。
目前对根系的研究主要集中于根系的形态学和拓扑学方面(Fitter, 1986;Costa et al., 2003)。根系长度、表面积、平均直径以及生物量是量化和评价根系特征的常用指标(Murphy et al., 1995)。然而,在胁迫条件下,这些指标在评价根系吸收能力方面的作用是有限的(Costa et al., 2003)。基于自相似理论的分形几何学则是研究根系结构的一个新手段,并受到越来越多的研究者的认可(杨培岭等, 1994;1999;王义琴等, 1998;Costa et al., 2003)。因此,本文拟以重庆石灰岩地区灌木群落的适生种群构树(Broussonetia papyrifera)为材料,通过分析根系在不同水分条件下接种VA菌根的形态反应,探讨VA菌根影响宿主抗旱性的机理,为石灰岩退化生态系统的生态恢复提供理论支持。
1 材料与方法 1.1 试验材料构树,也叫楮树,为桑科(Moraceae)桑亚科(Moroideae)构树族(Broussonetieae)的直立落叶小乔木,是重庆石灰岩地区灌木群落的适生种群,被认为是石灰岩山区绿化的好树种。本试验所用构树种子为贵州大学林学院提供。
供试VA菌根真菌为摩西球囊霉(Glomus mosseae) [中国丛枝菌根种质资源库编号:BGC XJ01,约300个孢子·(20g)-1],由北京市农林科学院植物营养与资源研究所提供。
1.2 试验处理自北碚鸡公山取黑色石灰土,掺入干净的河沙,按照体积1:1的比例均匀混合作为培养基质,在高压灭菌锅压力0.14 MPa, 124~126 ℃连续灭菌1 h备用。试验用土的理化性质为pH值6.77,全氮1.337 g·kg-1,速效磷2.095 mg·kg-1, 速效钾133.08 mg·kg-1,有机质含量为30.2 g·kg-1,田间持水量为18.7%。
2005年3月20日,选取籽粒饱满的构树种子,10%的H2O2内浸泡20 min,用无菌水冲洗数次后播种于灭菌的塑料花盆内。花盆规格为:上口内径27 cm,盆底内径23 cm,盆高26 cm,每盆装土4.150 kg。在出苗之后每盆定苗为1株,在植株长出2片真叶后在每盆植株根系周围埋菌种20 g,作为接种植株;未接种植株则在周围埋同等质量的灭菌菌种。1周后开始水分处理。
水分处理包括正常浇水、轻度干旱、中度干旱和重度干旱。正常浇水(well-watered,WW)保证盆钵中土壤含水量为田间持水量的80%~90%;轻度干旱(mild water stressed, MW)土壤含水量为田间持水量的65%~75%;中度干旱(moderate stressed, MS)土壤含水量为田间持水量的50%~60%;重度干旱(serious stressed,SS)土壤含水量为田间持水量的35%~45%。用称重法每天浇水,其他管理一致。每个处理10次重复,共80盆。试验在西南大学生态园遮雨棚完成,生态园海拔249 m。
1.3 指标测定水分处理2个月后测量植株各项指标。参照Green等(2005)的方法,将植株连同花盆浸入水中,小心冲掉土壤和沙砾,获取完整根系,截取最长的3个侧根分别放入根系盘内,通过数字化扫描仪(STD1600 Epsom USA)将完整的根系图像存入计算机,用WinRhizo(Version 410B)根系分析系统软件(Regent Instrument Inc, Canada)对根系总表面积、根总长、根系平均直径、根尖数量(根分枝数)等进行定量分析,同时进行根系分级。3个侧根的平均值作为该植株的根系特征。扫描后的侧根80 ℃烘干称质量,单位质量的根系长度记作比根长(special root length, SRL)。根系的分形特征采用计盒维数(box-counting dimension)度量:

|
式中:D为分形维数(盒维数); ε为划分尺度; N(ε)为对应于ε的非空格子数。
在本项研究中分形维数(盒维数)由Fractal Analysis System for Windows软件处理完成(日本NARO提供)。
同时将地上部分收获后在80 ℃烘干计算地上部分的生物量,用(接种植株生物量-未接种植株生物量)/未接种植株生物量计算菌根依赖性。参照Phillips等(1970)方法测定菌根侵染率。
数据处理利用Microsoft Excel和SPSS11.0完成,相同土壤水分条件下接种植株和未接种植株之间的比较采用2个独立样本的T检验,不同水分处理之间采用ANOVA分析和LSD多重比较, 并用字母标记法表示。
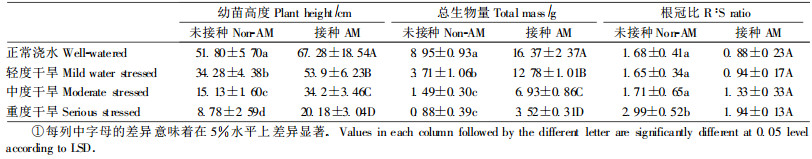
2 结果与分析 2.1 土壤水分与VA菌根接种对构树幼苗的影响构树根系侵染率统计结果表明:接种植株VA菌根侵染率在WW、MW、MS和SS条件下分别为(12.1±4.24)%,(18.7±6.55)%,(17.2±6.20)%和(14.8±8.11)%,差异不显著(P>0.05),而未接种植株侵染率低于2.0%,表明试验过程中可以忽略杂菌感染。
接种VA菌根与土壤水分状况都对构树幼苗的生长状况产生了显著的影响。构树幼苗高度、总生物量都随着土壤含水量的降低而显著降低。不论接种与否,植株高度、植株总生物量的最大值都出现在正常浇水下的WW处理组,最小值则出现在重度干旱SS处理组。在未接种VA菌根的处理中,正常浇水的植株总生物量为重度干旱植株的10倍以上;在接种摩西球囊霉的构树幼苗中,正常浇水处理组个体的平均生物量为重度干旱处理组的4.7倍。在相同的土壤水分条件下,接种摩西球囊霉的构树幼苗与未接种植株相比,接种植株无论在植株高度还是在总生物量上都显著高于未接种植株(表 1,P<0.05)。
|
|
在正常浇水、轻度干旱、中度干旱和重度干旱4种水分处理条件下,构树幼苗表现出的菌根依赖性分别为82.98%、244.61%、366.61%、299.63%,即构树幼苗存在对VA菌根真菌较强的菌根依赖性,并且这种依赖性随着土壤含水量的降低而升高,在中度干旱条件下达到最高值,在重度干旱条件下,这种菌根依赖性又呈下降趋势。
构树幼苗的根冠比也受到土壤含水量和菌根真菌接种的影响。构树幼苗的根冠比随着土壤含水量的降低表现出升高的趋势(表 1)。在相同水分条件下,接种植株的根冠比值显著低于未接种植株。在未接种植株中,重度干旱处理组的根冠比值显著高于其他3个处理组,而在接种植株中,4个处理组之间并没有显著性差异。
2.2 土壤水分与VA菌根接种对构树幼苗根系形态的影响在石灰土基质上,VA菌根真菌接种和土壤水分状况都使得构树根系的结构产生了显著的变化。随着土壤含水量的降低,构树幼苗根系质量、根系总长度、根系表面积、根系体积、根节数目、根系平均直径都表现出降低的趋势。在正常浇水的处理组和重度干旱处理组之间,它们差异显著(图 1a~g)。根系的根尖数目也随着土壤含水量的降低出现了减少的趋势,但是在处理组间并没有达到显著水平。在未接种处理组中,根系总长度和根节数目的最高值都出现在了轻度干旱的MW处理中;而在接种处理中,最高值均出现在了水分供应充足的WW处理组。

|
图 1 土壤水分和接种VA真菌对构树根系形态的影响 Fig. 1 Effects of VA fungi and soil moisture on root morphology in B. papyrifera WW:正常浇水Well-watered;MW:轻度干旱Mild water stressed;MS:中度干旱Moderate stressed;SS:重度干旱Serious stressed;柱形图上方字母的差异表示在5%水平上差异显著Values in each column followed by the different letter are significantly different at 0.05 level according to LSD.下同。The same below. |
构树幼苗根系的比根长(special root length, SRL)和根节平均长度则表现出与根系质量等不同的变化趋势。它们表现为随着土壤含水量的降低而升高。但是比根长SRL和根节平均长度在4个水分处理组之间差异不显著,在未接种处理组内尤为明显(图 1h, i)。
根系质量、根系总长度、根系表面积、体积、根尖数目、根节数接种植株都明显高于相同土壤水分条件下的未接种植株;而比根长和根节平均长度表现为未接种植株显著高于接种植株;根系平均直径则只有在土壤水分供应不足的轻度干旱、中度干旱、重度干旱处理组中在接种植株和未接种植株之间,差异显著,在水分供应充足的WW处理条件下,差异不显著(图 1)。
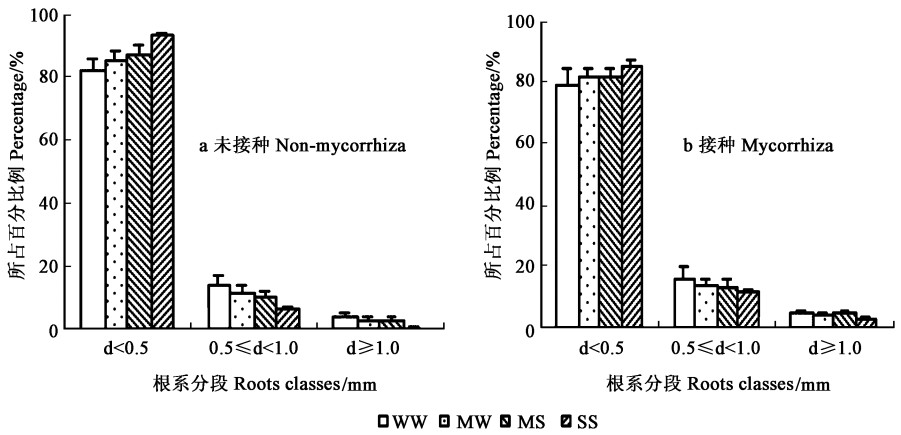
对不同水分条件下构树根系分级分析结果表明:直径小于0.5 mm的细根长度占整个根系长度的绝大部分;并且随着土壤含水量的降低,根系直径小于0.5 mm的细根长度所占整个根系的百分比例增加,而处于0.5~1.0 mm之间的细根长度所占整个根系的百分比例呈减少的趋势(图 2)。接种植株和未接种植株的变化趋势是一致的,二者的差异表现在,在相同水分条件下未接种植株似乎有更高比例的直径小于0.5 mm的细根长度(P>0.05)。
|
图 2 土壤水分和接种VA真菌对构树根系分级特征的影响 Fig. 2 Effects of VA fungi and soil moisture on diameter scale of root system in B. papyrifera |
计算得到的根系分形维数如图 3所示。结果表明:构树根系的分形维数D值在1.2~1.6之间。随着土壤含水量的降低,接种植株根系分形维数依次为1.505 3、1.473 3、1.430 8、1.349 9;未接种植株的根系分形维数依次为1.399 6、1.396 8、1.328 8、1.249 7,值表现出明显的随土壤水分下降而下降的趋势。2种处理植株(接种与未接种植株)正常浇水处理组与水分严重匮乏的重度干旱处理组之间D值差异显著;在同等的水分处理条件下,接种植株根系分形维数显著高于未接种植株,表现出与根系质量、根系总长度、根系表面积、体积、根节数目、根系平均直径等一致的变化趋势。

|
图 3 土壤水分和接种VA真菌对构树根系分形维数的影响 Fig. 3 Effects of VA fungi and soil moisture on fractal dimension of root system in B. papyrifera |
研究结果表明:构树幼苗生物量随着土壤含水量的降低而显著降低(表 1),土壤干旱抑制了构树幼苗的生长;而构树幼苗的根冠比随着土壤含水量的降低而呈升高趋势(表 1),表明干旱胁迫改变了植株生物量的配置格局,使得植株将更多的生物量分配到根系中以吸收水分(Stewart et al., 1993)。
在正常浇水、轻度干旱、中度干旱和重度干旱4种水分处理条件下,接种菌根真菌摩西球囊霉使构树幼苗总生物量较未接种植株分别高出82.98%、244.61%、366.61%、299.63 %,表明接种摩西球囊霉促进了构树幼苗在石灰土基质上的生长,增加了构树个体总生物量的积累,并且菌根真菌摩西球囊霉对构树幼苗生长的促进作用在土壤干旱条件下显得尤为明显(表 1)。这与前人对甘蔗(Saccharum officinarum)、绿豆(Phaseolus radiatus)、苹果(Malus domestica)、柑(Citrus unshiu)、橘(Poncirus trifoliata)、小麦(Triticum aestivun)、玉米(Zea mays)、番茄(Lycopersicon esculentum)和酸枣(Ziziphus jujuba)等的研究结果是一致的(吴强盛等,2004)。Cruz等(2004)等也发现,愈是在营养水平比较低的情况下,VA菌根对宿主生长的促进作用愈是明显。Ague(2001)认为:VA菌根真菌可能通过改善宿主对土壤水肥的吸收促进了宿主在干旱生境中的生长。
根系的大小与植株生活力的大小密切相关(Berntson et al., 2000)。在本研究中,所有测量根系大小的参数(如根系质量、根系总长度、根系表面积、根系体积、根尖数目和根节数目等)都对土壤水分状况和VA菌根真菌接种产生了一致的响应(图 1)。随着土壤含水量的降低,构树幼苗根系生物量降低,总长度、根系体积和根系表面积明显减小,正常浇水处理与严重干旱处理之间差异显著(P<0.05),根尖和根节的数量也表现出了类似的趋势。接种摩西球囊霉使得构树幼苗根系明显增大,如根系生物量分别由原来的5.488 4、2.216 6、0.907 9、0.445 1 g增加为7.462 5、6.168 3、3.907 1、2.323 6 g。根系总长度、根系表面积、体积等也表现出了相同的变化趋势。可见,接种摩西球囊霉和土壤水分改善都使得构树幼苗根系变大。而小根系是植物根系对资源匮乏生境的生态适应(Taub et al., 1996)。因此,随着土壤水分状况好转或者接种VA菌根使得植株能够更加有效地从土壤中获取营养物质(弓明钦等, 20006),植株将更多的生物量分配给地上部分,从而促进了植物地上部分的生长(Lambers et al., 1995)。构树幼苗根冠比对土壤水分和接种VA菌根的响应研究结果进一步证实了这一点。
根系平均直径,比根长和根节平均长度是反映根系吸收功效的参数。比较构树根系吸收功效发现,接种植株和未接种植株根系吸收功效差异明显(图 1g、i)。接种摩西球囊霉后,在相同的土壤水分条件下,根系平均直径升高,比根长和根节平均长度减小,同时根系平均直径和未接种植株的比根长SRL随着土壤含水量的降低表现出升高的趋势(图 1g、h)。Fitter(1994)认为:细根投入低,表面积大,寿命短;而粗根生长迅速,寿命长,但表面积相对小,因此在干旱环境中粗根对营养物质的吸收能力相比相同质量的细根要小。Trapeznikov等(2003)对异质生境条件下的小麦根系形态研究中发现,生长于水肥条件优越条件下的根节变短。因此,接种摩西球囊霉后构树根系平均直径升高,比根长和根节平均长度减小是与VA菌根改善了构树根系水肥的吸收有关;同时根系平均直径和未接种植株的比根长随着土壤含水量的降低表现出升高的趋势,是植株个体觅食行为的一种表现(董鸣,1996)。
然而根系吸收功效对土壤水分变化的响应并不一致。在接种植株中,根系比根长在4种土壤水分条件下依次为(4 417±1 703) cm·g-1,(3 772±872)cm·g-1,(3 869±947) cm·g-1,(4 849±463) cm·g-1,相互之间没有显著差异。Swan1)在对Centaurea maculosa和Rudbeckia hirta研究中也得出相同的结果。根节的平均长度则表现出随土壤含水量降低先降低再升高的趋势,在接种植株和未接种植株中都是如此(图 1i)。由此可见,植物根系对外界环境的响应,远比我们想象的要复杂。
1) Swan M C. 2004. Thesis for the Degree of Master of Science in Montana State University
由于植物根系每一级侧根的发育基本具有相同的分布特点与分枝规律,在一定尺度上具有明显的统计自相似特征,因此适合应用分形几何理论研究根系形态(Tatsumi et al., 1989)。本研究结果表明,构树根系分形维数的大小随着土壤含水量的降低而降低;接种摩西球囊霉后,同等土壤水分条件下接种植株的分形维数较未接种植株显著升高(图 3)。这与构树根系大小对土壤水分状况和VA菌根真菌接种的反应是一致的,而根系大小又决定了其对根基土壤空间的占据能力。由此可见,根系分形维数在定量反映根系对根基土壤空间的占据能力上具有一定的可靠性(Eghball et al., 1993)。
董鸣. 1996. 资源异质性环境中的植物克隆生长:觅食行为. 植物学报, 38(10): 828-835. |
弓明钦, 徐大平, 仲崇禄, 等. 2000. 菌根生物多样性及其应用研究. 北京: 中国林业出版社.
|
王义琴, 张慧娟, 杨奠安, 等. 1998. 大气CO2浓度倍增对植物幼苗根系生长影响的分形分析. 科学通报, 43(16): 1736-1738. DOI:10.3321/j.issn:0023-074X.1998.16.010 |
吴强盛, 夏仁学. 2004. VA菌根与植物水分代谢的关系. 园艺园林科学, 20(1): 188-192. |
谢宗强, 江喜明. 1995. 三峡地区石灰岩灌丛植被特征及其合理利用. 植物学通报, 12: 85-89. |
杨培岭, 罗远培. 1994. 冬小麦根系形态的分形特征. 科学通报, 39(20): 1911-1913. DOI:10.3321/j.issn:0023-074X.1994.20.026 |
杨培岭, 任树梅, 罗远培. 1999. 分形曲线度量与根系形态的分形表征. 中国农业科学, 32(1): 89-92. DOI:10.3321/j.issn:0578-1752.1999.01.016 |
Atkinson D, Black K E, Forbes P J, et al. 2003. The influence of arbuscular mycorrhizal colonization and environment on root development in soil. European Journal of Soil Science, 54: 751-757. DOI:10.1046/j.1351-0754.2003.0565.x |
Augé R M. 2001. Water relations, drought and vesicular-arbuscular mycorrhizal symbiosis. Mycorrhiza, 11: 3-42. DOI:10.1007/s005720100097 |
Berntson G M, Wayne P M. 2000. Characterizing the size dependence of resource acquisition within crowded plant populations. Ecology, 81: 1072-1085. DOI:10.1890/0012-9658(2000)081[1072:CTSDOR]2.0.CO;2 |
Costa C, Dwyer L M, Dutilleul P, et al. 2003. Morphology and Fractal dimension of root systems of maize hybrids bearing the leafy trait. Canadian Journal of Botany, 81: 706-713. DOI:10.1139/b03-058 |
Cruz C, Green J J, Watson C A, et al. 2004. Functional aspects of root architecture and mycorrhizal inoculation with respect to nutrient uptake capacity. Mycorrhiza, 14(3): 177-184. DOI:10.1007/s00572-003-0254-5 |
Eghball B, Settimi J R, Maranville J W, et al. 1993. Fractal analysis for morphological description of corn roots under nitrogen stress. Agronomy Journal, 85: 287-289. DOI:10.2134/agronj1993.00021962008500020023x |
Fitter A H. 1994. Architecture and biomass allocation as components of the plastic response of root systems to soil heterogeneity//Caldwell M M, Pearcy R W. Exploitation of Environmental Heterogeneity by Plants: Ecophysiological Processes above- and below-ground. Academic, San Diego, 305-323
|
Fitter A H. 1986. The topology and geometry of plant root systems: influence of watering rate on root system topology in Trifolium pratense. Annual of Botany, 58: 91-101. DOI:10.1093/oxfordjournals.aob.a087191 |
Folk R S, Grossnickle S C. 1997. Determining field performance potential with the use of limiting environmental conditions. New Forests, 13: 121-138. DOI:10.1023/A:1006514805052 |
Green J J, Baddeley J A, Cortina J, et al. 2005. Root development in the Mediterranean shrub Pistacia lentiscus as affected by nursery treatments. Journal of Arid Environments, 61: 1-12. DOI:10.1016/j.jaridenv.2004.09.001 |
Lambers H, Atkin O K, Scheurwater I. 1995. Respiratory patterns in roots in relation to their functioning//Waisel Y, Eschel A, Kafkafi K. Plant Roots, The Hidden Half. Dekker, New York, 263-279
|
Murphy S L, Smucker J M. 1995. Evaluation of video image analysis and line-intercept methods for measuring root systems of alfalfa and ryegrass. Agron J, 87: 865-868. DOI:10.2134/agronj1995.00021962008700050014x |
Phillip J M, Hayman D S. 1970. Improved procedures for cleaning and staining parasitic and vesicular arbuscular mycorrhizal fungi. Transactions of the British Mycological Society, 55: 158-161. DOI:10.1016/S0007-1536(70)80110-3 |
Smith S E, Read D J. 1997. Mycorrhizal Symbiosis. London: Academic Press.
|
Stewart J D, Lieffers V J. 1993. Preconditioning effects of nitrogen relative addition rate and drought stress on container-grown lodgepole pine seedlings. Canadian Journal of Forest Research, 23: 1663-1671. DOI:10.1139/x93-207 |
Tatsumi J, Yamauchi A, Kono Y. 1989. Fractal analysis of plants root systems. Annual of Botany, 64: 499-503. DOI:10.1093/oxfordjournals.aob.a087871 |
Taub D R, Goldberg D. 1996. Root system topology of plants from habitats differing in soil resource availability. Functional Ecology, 10: 258-264. DOI:10.2307/2389851 |
Trapeznikov V K, Ivanov I I, Kudoyarova G R. 2003. Effect of heterogeneous distribution of nutrients on root growth, ABA content and drought resistance of wheat plants. Plant and Soil, 252: 207-214. DOI:10.1023/A:1024734310214 |
 2007, Vol. 43
2007, Vol. 43