文章信息
- 王滑, 郝俊民, 王宝庆, 裴东.
- Wang Hua, Hao Junmin, Wang Baoqing, Pei Dong.
- 中国核桃8个天然居群遗传多样性分析
- SSR Analysis of Genetic Diversity of Eight Natural Walnut Populations in China
- 林业科学, 2007, 43(7): 120-124.
- Scientia Silvae Sinicae, 2007, 43(7): 120-124.
-
文章历史
- 收稿日期:2007-01-10
-
作者相关文章
2. 内蒙古农业大学林学院 呼和浩特 010019
2. College of Forestry, Inner Mongolia Agricultural University Hohhot 010018
核桃属(Juglans)植物约有20多种,我国现有12个种,其中分布广且栽培较多的是核桃(J. regia)和铁核桃(J. sigillata)(匡可任等,1979)。核桃目前是中国栽培范围最广的种,而铁核桃是我国特有种,分布在云南、贵州、四川等地(曲泽洲等,1990)。
1906年,Dode根据铁核桃的形态特点将其定为新种, 但长期以来存在争议(曲泽洲等,1990)。如杨自湘等(1989)用过氧化物同工酶分析研究后认为铁核桃与核桃种下的生态型平行, 不宜划为另一个种;匡可任等(1979)根据形态学、细胞学、地理分布等方面的研究将其作为核桃属的1个独立种。国外学者(Malvolti et al., 1993;1994;Fjellstrom et al., 1994)利用形态学、等位酶及RFLP标记对欧洲及亚洲的核桃居群作了分析比较,吴燕民等(2000)用RAPD标记研究了核桃属各个种之间的亲缘关系。但对中国的2个主要种——核桃和铁核桃天然居群的遗传多样性研究尚未见报道。SSR分子标记技术是近几年发展起来的、以PCR为基础的DNA多态性检测技术,具有共显性、稳定性好、多态性高和遗传信息量大的特点,能很好地满足对居群分析的要求,是较为理想的分子标记(邹喻萍等,2001)。
本研究旨在利用SSR标记揭示我国核桃和铁核桃天然居群的遗传多样性及遗传结构,为其遗传资源的保护、可持续利用和遗传改良提供科学依据。
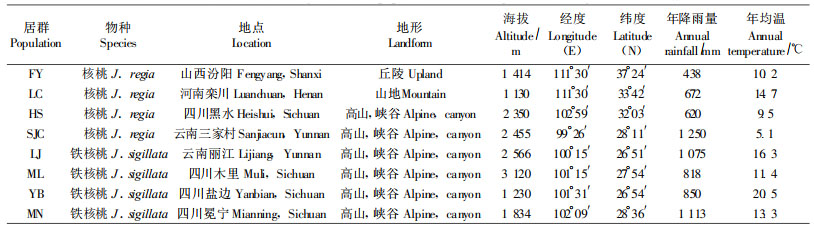
1 材料和方法 1.1 材料的采集与处理在广泛收集、调查文献资料的基础上,经过实地考察,分别在河南、山西等地采集了4个核桃居群,在云南、四川等地采集了4个铁核桃的居群(表 1)。区分2个种主要依据其形态学特征(郗荣庭等,1996)。按随机取样原则,每个群体取样35株,植株间距至少50 m。采集当年生嫩叶提取DNA,-20 ℃保存待用。
|
|
采用CTAB法提取总DNA (Lefort et al., 1999),用SmartSpecTM3000核酸蛋白仪测定DNA的浓度并稀释至10 ng·μL-1用于扩增反应。
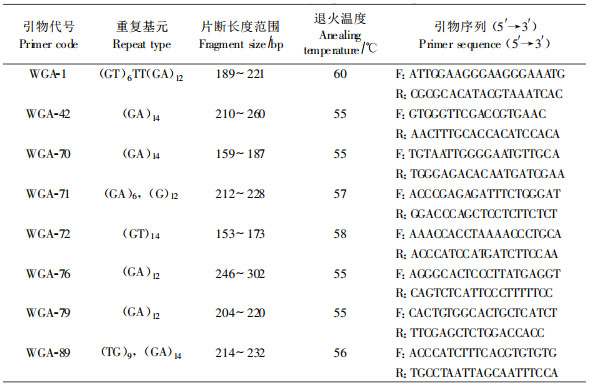
1.3 引物的筛选及PCR反应扩增反应在GeneAmp 9700 Thermal cyclers PCR扩增仪上进行。在Woeste等(2002)SSR扩增条件的基础上,试验了各种不同的扩增条件,获得了最佳扩增反应体系和步骤。反应体系:总体积15 μL,其中MgCl2 1.5 mmol·L-1,引物0.6 μmol·L-1,dNTP(Promega USA)各0.2 mmol·L-1,Tag酶(TaKaRa)0.9 U,DNA模板30 ng。扩增反应程序:94 ℃预变性3 min;94 ℃变性30 s,Tm℃退火(各引物具体退火温度见表 2) 30 s,72 ℃延伸45 s, 共30个循环;72 ℃延伸5 min。选用黑核桃(J. nigra) (Woeste et al., 2002;Foroni et al., 2005;Victory et al., 2006)的SSR引物进行扩增并筛选引物,筛选重复2次,选取条带清晰且稳定多态的8对SSR引物(表 2)用于本研究。
|
|
按照Wang等(2005)的方法进行聚丙烯酰胺凝胶电泳(以pUC18 DNA/Mspl标准分子量为参照)。电泳结束后按照Panaud等(1996)的程序进行银染。
1.5 数据处理根据银染结果判读每个个体的基因型,构建数据矩阵,用POPGENE version 1.32软件(Yeh et al., 1997b)分析居群遗传多样性及遗传结构。用GenAlEx6软件计算居群间遗传距离与地理距离的相关性,并进行Mantel检测(Peakall et al., 2006);用TFPGA软件对种间-种内、居群间-居群内的层次结构进行分析并进行显著性检验。
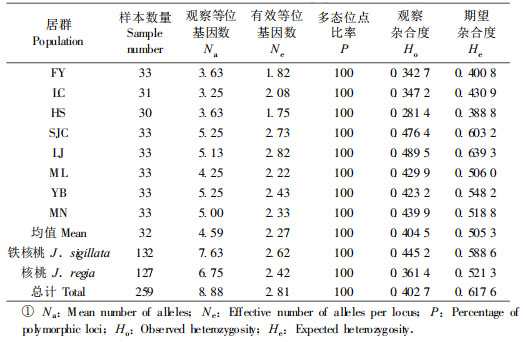
2 结果与分析 2.1 居群遗传多样性8对SSR引物共检测到71个等位基因,每个位点平均观察等位基因数(Na)为8.88,平均有效等位基因数(Ne)2.81。总多态位点百分率达100.0%。引物WGA-42检测到等位基因数最多,为11个,而引物WGA-79最少为6个。检测到的71个等位基因中,有54个为核桃与铁核桃的共有等位基因,7个等位基因为核桃特有,其他10个等位基因为铁核桃特有。
有效等位基因数(Ne)和杂合度(H)是目前应用较为广泛的遗传多样性指数,而杂合度(H)不仅是衡量居群遗传多样性最常用的指标,同时也反映居群中等位基因的丰富度和均匀程度。在8个居群中,各居群内的有效等位基因数介于1.75~2.82之间,平均2.27。各居群内观察杂合度(Ho)值变动范围为0.281~0.490,平均为0.404;期望杂合度(He)值变动范围为0.389~0.639,平均为0.505,说明各居群间的多态性水平差异较大。按检测到的有效等位基因数(Ne)和期望杂合度(He)作为标准,云南丽江铁核桃居群的遗传多样性最高,四川黑水核桃居群的遗传多样性水平最低(表 3)。
将核桃居群和铁核桃居群分别作为一个整体进行分析时,铁核桃总居群的等位基因数为7.63,有效等位基因数为2.62,Ho为0.445, He为0.589;核桃总居群的等位基因数为6.75,有效等位基因数为2.42,Ho为0.361, He为0.521(表 3)。说明2个种的遗传多样性都处于中等水平。
|
|
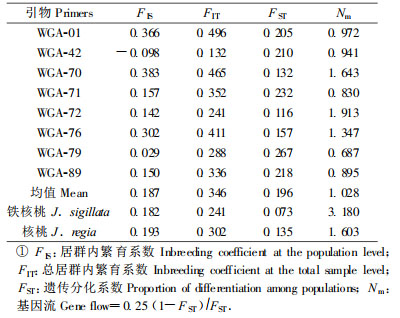
铁核桃及核桃居群在8个SSR位点的遗传分化结果见表 4。8个居群的遗传分化系数(FST)(Wright,1978)的变化范围为0.116~0.267,平均0.196,说明有19.6%的变异存在于所有8个居群间。其中WGA-79位点上的分化系数值为0.267,远高于这个位点分别在4个铁核桃居群和4个核桃居群间的分化值,说明这个位点在维持铁核桃和核桃间分化上起重要作用。8个居群间基因流(Nm)(Bossart et al., 1998)为1.028。铁核桃总居群的FST值变化范围为0.035~0.132,平均0.073,即有7.3%的变异存在于铁核桃总居群的居群间。铁核桃居群间的基因流(Nm)为3.18。核桃总居群的FST值变动于0.039~0.25变动,平均0.135,即有13.5%的变异存在于核桃的居群间。核桃居群间的基因流为1.603。铁核桃与核桃种间的分化系数(FST)值为0.103。铁核桃总居群与核桃总居群之间的基因流(Nm)为2.167。
|
|
采用TFPGA软件进行种间、种内居群间、居群内的遗传分化分析表明,居群间差异达显著水平(P<0.05, 1 000 iterations)。其中,遗传变异的15.8%来源于种间,遗传变异的9.7%来源于种内居群间,74.5%来源于居群内。
2.3 居群符合哈迪-温伯格平衡的状况通过卡方(χ2)(Workman et al.,1970)检验显示,大部分居群约一半位点表现为显著偏离哈迪-温伯格(Hardy-Weinberg)平衡(P<0.05)。铁核桃居群有65.7%的居群-位点组合是显著偏离哈迪-温伯格平衡,而核桃居群有53.2%的居群-位点组合显著偏离哈迪-温伯格平衡。FIT和FIS分别代表总居群和单个居群偏离哈迪-温伯格平衡的程度。整个铁核桃居群和核桃居群的平均FIT值分别为0.241和0.302,平均FIS值分别为0.182和0.193,说明无论在总体水平还是居群内个体间,铁核桃和核桃居群都表现为杂合子不足的现象。
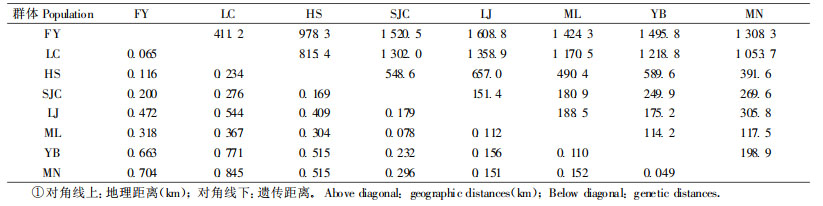
2.4 各居群间的遗传关系根据Nei(1978)的方法计算遗传距离D(表 5),居群的遗传距离在0.049~0.845之间,其平均值为0.322。其中,MN居群与YB居群的遗传距离最小,MN居群与LC居群的遗传距离最大,遗传分化程度高。
|
|
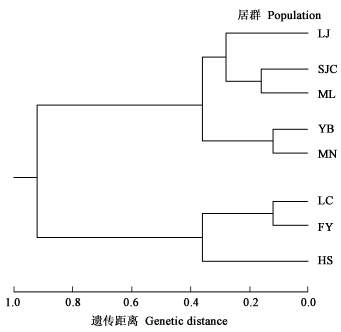
为了进一步探讨居群间的遗传关系,利用核桃的遗传距离进行UPGMA聚类分析,得到8个群体间的聚类图(图 1)。8个居群被聚为两大类:所有铁核桃居群以及SJC核桃居群聚为一大类,剩余的3个核桃居群聚为一大类。在第一大类的5个居群中,MN铁核桃居群和YB铁核桃居群、SJC核桃居群和ML铁核桃以及LJ铁核桃居群先分别聚为亚类,其中SJC核桃居群与ML铁核桃居群的关系较为密切。在另一大类中,FY和LC两居群聚为亚类之后再与HS居群聚为一组。Mantel检测显示,8个居群两两间的遗传距离与其地理距离有显著的相关性(R2=0.354, P<0.01)。
|
图 1 核桃居群基于遗传距离的聚类图 Fig. 1 UPGMA dendrogram of Juglans populations using Nei's (1978) unbiased genetic distances |
基于71个等位基因获得的遗传多样性的结果显示,8个居群平均观察杂合度(Ho)为0.403,期望杂合度(He)为0.618,处于中等水平,低于黑核桃(J. nigra) (0.781, 0.793) (Victory et al., 2006)和核桃楸(J. mandshurica) (0.709,0.806)的杂合水平。另外8个核桃居群多样性水平表现出了明显地域特征。地理纬度南部居群(所有铁核桃居群及核桃SJC居群)的遗传多样性明显高于北部地区,这可能与该地区的地理环境有关。我国西南地区位于欧亚古大陆的南缘,由于喜马拉雅山运动,这里河谷不断下切和高原不断上升,形成了群山起伏、河谷交错的地貌特征,气候类型丰富多样(Peng et al., 2005),适宜的生境和较少的人为干扰可能是居群具有较高遗传多样性的重要原因。
8个居群遗传分化结果显示,种群间遗传分化值FST=0.196,即有19.6%的变异存在于居群间。通过种间-种内居群间-居群内个层次结构的分析发现,在居群间的19.6%变异中有10.3%的变异来源于种间,9.3%的变异来源于种内居群间。另外,铁核桃居群间变异为7.3%,核桃居群间变异为13.5%。这些结果与众多风媒授粉针叶树的变异模式相符,即居群内遗传变异水平较高,而居群间遗传变异水平较低(Yeh et al., 1997a; 1997b)。将本研究获得的居群遗传分化值与同属其他种的结果进行比较发现,核桃居群间的分化值(FST=0.135)高于利用等位酶(GST=0.105)和RFLP标记(FST=0.108)研究的结果(Fornari et al., 2001; Fjellstrom et al., 1994),也远远高于用SSR标记研究黑核桃居群的结果(FST=0.017)(Victory et al., 2006)。生境片断化限制了居群间的基因交流(Nm=1.02),加上生境多样化使居群间出现较高的遗传分化现象(Wang et al., 2005)。
UPGMA聚类结果显示,8个居群并没有呈现出相同种的方式排列,而是按地理距离聚类的趋势,说明铁核桃与核桃居群间的分化差异并不明显。通过Mantel检测也证实8个群体间的遗传距离和地理距离具有显著的相关性。杨自湘等(1989)利用过氧化物同工酶研究核桃和铁核桃的遗传多样性,发现2个种的差异并不明显。路安民等(1990)通过对果实传播方式、分化、生态及地理分化的研究,也认为核桃属植物是从热带和亚热带比较湿润的环境向温带较为干燥环境迁移过程中产生的进化类型。本研究结果支持核桃和铁核桃很可能是同一个种的不同地理生态型,其分化可能是由于地理迁移和隔离所产生的学术观点。然而,要彻底澄清铁核桃的分类问题尚需要进一步的证据,有待于深入研究。
匡可任, 路安民. 1979. 中国植物志:第21卷. 北京: 科学出版社, 30-35.
|
路安民, 张志耘. 1990. 胡桃木的分化、进化和系统关系. 植物分类学报, 28(2): 96-102. |
曲泽洲, 孙云蔚. 1990. 果树种类论. 北京: 农业出版社, 183-191.
|
吴燕民, 裴东, 奚声珂. 2000. 运用RAPD对核桃属种间亲缘关系的研究. 园艺学报, 27(1): 17-22. DOI:10.3321/j.issn:0513-353X.2000.01.004 |
郗荣庭, 张毅萍. 1996. 中国果树志:核桃卷. 北京: 中国林业出版社, 56-78.
|
杨自湘, 奚声珂. 1989. 胡桃属十种植物的过氧化物同工酶分析. 植物分类学报, 27(1): 53-57. |
邹喻萍, 葛颂, 王晓东. 2001. 系统与进化植物学中的分子标记. 北京: 科学出版社, 68-107.
|
Bossart J L, Prowell D P. 1998. Genetic estimates of population structure and gene flow: limitations, lessons and new directions. Trends in Ecology & Evolution, 13: 202-206. |
Fjellstrom R G, Parfitt D E. 1994. Walnut (Juglans spp.) genetic diversity determined by restriction fragment length polymorphisms. Genome, 37: 690-700. DOI:10.1139/g94-097 |
Fornari B, Malvolti M E, Taurchini D. 2001. Isozyme and organellar DNA analysis of genetic diversity in natural/naturalised European and Asiatic walnut (Juglans regia L.) populations. Acta Horticulturae, 544: 167-178. |
Foroni I, Rao R, Woeste K, et al. 2005. Characterisation of Juglans regia L. with SSR markers and evaluation of genetic relationships among cultivars and the 'Sorrento' landrace. J Hort Sci & Biotechnol, 80(1): 49-53. |
Lefort F, Douglas G C. 1999. An efficient micro-method of DNA isolation from mature leaves of four hardwood tree species Acer, Fraxinus, Prunus and Quercus. Annals of Forest Science, 56: 259-263. DOI:10.1051/forest:19990308 |
Malvolti M E, Fineschi S, Pigliucci M. 1994. Morphological integration and genetic variability in Juglans regia L. J Hered, 85: 389-394. DOI:10.1093/oxfordjournals.jhered.a111484 |
Malvolti M E, Paciucci M, Cannata F, et al. 1993. Genetic variation in Italian populations of Juglans regia L. Acta Hortic, 311: 86-94. |
Nei M. 1978. Estimation of average heterozygosity and genetic distance from a small number of individuals. Genetics, 89: 583-590. |
Panaud O, Chen X, McCouch S D. 1996. Development of microsatellite markers and characterization of sample sequence lengthen polymorphism (SSLP) in rice (Oryza sativa L.). Mol Gen Genet, 252: 597-607. |
Peakall R, Smouse P E. 2006. GenAlEx6: Genetic analysis in Excel. Population genetic software for teaching and research. Molecular Ecology Notes, 6: 288-295. DOI:10.1111/j.1471-8286.2005.01155.x |
Peng Y H, Lu Z, Chen K. 2005. Population genetic survey of Populus cathayana originating from southeastern Qinghai-Tibetan plateau of China based on SSR markers. Silvae Genetica, 54(3): 116-122. |
Victory E R, Glaubitz J C, Rhodes Jr O E, et al. 2006. Genetic homogeneity in Juglans nigra (Juglandaceae) at nuclear microsatellites. Am J Botany, 93(1): 118-126. |
Wang Y H, Luo J X, Xue X M. 2005. Diversity of microsatellite markers in the populations of Picea asperata originating from the mountains of China. Plant Science, 168: 707-714. DOI:10.1016/j.plantsci.2004.10.002 |
Woeste K, Burns R, Rhodes O E, et al. 2002. Thirty polymorphic nuclear microsatellite loci from black walnut. Journal of Heredity, 93: 58-60. DOI:10.1093/jhered/93.1.58 |
Workman P L, Niswander J D. 1970. Population studies on southwestern Indian tribes Ⅱ: Local genetic differentiation in the Papago. Am J Hum Genet, 22: 24-49. |
Wright S. 1978. Variability within and among populations: vol. 4. Chicago: University of Chicago Press.
|
Yeh F C, Layton C. 1997a. The organization of genetic variability in central and marginal populations of lodgepole pine Pinus contorta ssp. latifolia. Can J Genet Cytol, 21: 487-503. |
Yeh F C, Yang R C, Boyle T. 1997b. POPGENE version 1.32 ed. Software Microsoft Window-Based Freeware for Population Genetic Analysis. Edmonton, Alta: University of Alberta Press.
|
 2007, Vol. 43
2007, Vol. 43