文章信息
- 王强, 阮晓, 李兆慧, 潘存德.
- Wang Qiang, Ruan Xiao, Li Zhaohui, Pan Cunde.
- 植物自毒作用及针叶林自毒研究进展
- Autotoxicity of Plants and Research of Coniferous Forest Autotoxicity
- 林业科学, 2007, 43(6): 134-142.
- Scientia Silvae Sinicae, 2007, 43(6): 134-142.
-
文章历史
- 收稿日期:2005-09-29
-
作者相关文章
2. 新疆农业大学林学院 乌鲁木齐 830052
2. College of Forest, Xinjiang Agricultural University Urumqi 830052
2000多年前人们就已发现植物具有自体抑制或泌毒现象。但从实验生态学和化学生态学角度验证自毒作用的存在则是近二十几年的事(Blum et al., 1999)。植物种内自毒现象(autotoxicity)是化感作用(allelopathy)的一种特殊类型。化感作用是指“植物(包括微生物)之间相互抑制或促进的生物化学作用”(Rice, 1974)。当供体与受体属于同一植物种时,就称其为自毒作用,又称自化感作用(autoallelopathy)或自体中毒(autointoxication)(Singh et al., 1999)。自毒作用是通过植物分泌到环境中被称作自毒物质(autotoxic substances)的一些植物次生代谢物来实现。自毒物质以挥发、淋溶、根系分泌和残体分解等途径,从植物个体(供体)释放,通过不同方式影响环境中其他同种植物个体(受体)的生长。如从芋头(Colocasia esculenta)根分泌物中鉴定出的乳酸、安息香酸、香草酸、琥珀酸、脂肪酸等物质,浓度达到400 μmol·L-1时能显著抑制芋头植株生长,其中以安息香酸抑制作用最强(Asao et al., 2003)。
从已检索到的资料看(ISI Web of Science, SciFinder Scholar, 万方数据库),近10年间,国内外共发表了200余篇有关植物自毒作用的论文。Rice等(1984)发现酚类物质可明显增加细胞膜脂质过氧化作用,造成细胞膜的破坏。Xuan等(2004)研究发现,花生四烯酸、安息香酸、棕榈酸、硬脂酸积累分别达到0.025%时,能显著抑制水稻(Oryza sativa)苗生长,而阿魏酸和咖啡酸浓度积累达到0.001%时,就显著抑制水稻幼苗生长。苜蓿(Medicago sativa)重茬2~4年后产量下降,主要原因是根分泌的一些水溶性次生代谢物在土壤环境中过量积累对自身产生自毒作用(梁文举等,2004)。Yu等(2005)用黄瓜(Cucumis sativus)根分泌物和水浸液处理幼苗后,其POD、SOD酶活性及膜过氧化反应均有明显增加。另外,Canals等(2005)指出,由于1年生植物黑麦草(Lolium rigidum)种内存在自毒作用,增加了植物远交的机会,提高了植物群落的物种多样性水平。
针叶树是我国重要的用材树种。近年来国内外报道了很多关于针叶林生产力下降、地力衰退、天然更新困难等问题,传统上认为这种现象是因轮伐期、采伐利用方式、采伐剩余物清理、耕作和整地、固氮和肥土植物利用不当等原因造成的(陈龙池等,2004)。但潘存德研究小组在针对天山云杉(Picea schrenkiana)更新障碍研究中发现:天山云杉凋落物中所含次生代谢物经雨水淋溶和根系分泌等复杂环境生态过程作用在土壤中富积,而生态系统排毒解毒机制(自然火过程)被人为干扰,表现出天山云杉的自毒现象,认为自毒作用是影响针叶林天然更新成败的关键因素。本文就自毒物质种类、释放途径、作用特点、作用机理、检测方法、对生态系统的影响以及针叶林自毒作用研究现状等问题进行了综述。
1 自毒物质 1.1 自毒物质生物合成自毒物质是植物在逆境条件下产生对种内其他个体的生长、发育和生理过程有影响的一大类次生代谢物,是非营养性物质。植物由于受到不同环境胁迫因子如温度、太阳辐射、养分含量、水分及遗传因素等的影响,产生的自毒物质的种类和数量有所不同。文中提到的自毒物质是植物界普遍存在的化感物质,多数也具有化感作用。因本文只讨论自毒作用,所以将这些物质称为自毒物质。植物自毒物质产生主要与细胞内醋酸和莽草酸代谢途径耦联,其生物合成过程如下(图 1)。
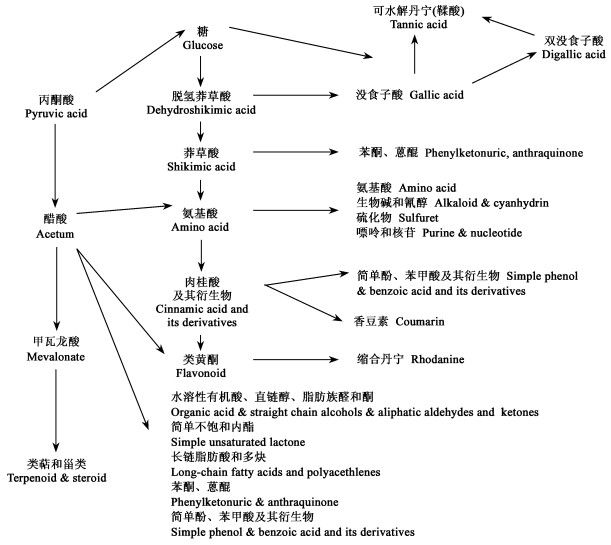
|
图 1 自毒物质主要生物合成途径 Fig. 1 Biosynthetic pathways of major autotoxic substances |
自毒物质种类繁多,常见化合物根据其结构和性质不同,可将其分为10类。
1)简单水溶性有机酸、直链醇、脂肪族醛和酮(Hadacek, 2002;余叔文等, 1998):主要有乙酸、甲醇、乙醛、柠檬酸、琥珀酸、草酸、丙酮,以及:
|
2) 简单不饱和内酯:

|
3) 长链酯肪酸和多炔:

|
4) 苯醌、蒽醌和复醌:
|
5) 简单酚、苯甲酸及其衍生物(曾广文等, 2000):

|
|
6) 肉桂酸及其衍生物:
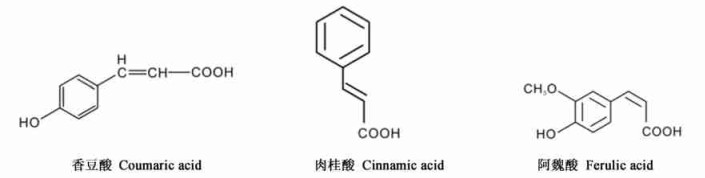
|
7) 香豆素类:

|
8) 类黄酮:
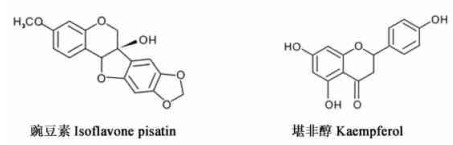
|
9) 丹宁类:
|
10) 类萜、烯类和淄类化合物,包括壳梭孢素以及:
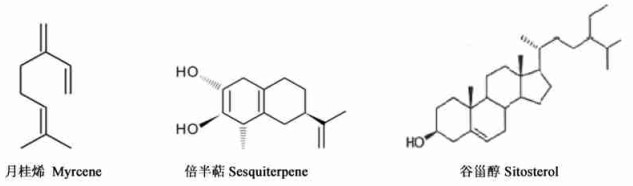
|
除了上述种类外,随着人们对植物自毒作用机制研究的不断深入,还会有大量新的自毒物质被发现。
2 自毒物质释放途径、作用特点及检测方法 2.1 自毒物质释放途径 2.1.1 挥发作用植株体表茎、叶、花等部位挥发释放出的物质(主要是萜类)可直接被其他植物吸收,或溶于雨水、雾等进入土壤中而被植物根直接吸收。黎华寿等(2005)发现:在香茅(Cymbopogon citratus)挥发物中存在较多的萜类物质,茎叶挥发物中有2个单萜,9个倍半萜,根挥发物全部为倍半萜。
2.1.2 根系分泌根系分泌物中的次生代谢产物很大一部分参与自毒作用,是影响森林植物和农作物生化关系的重要因素。南瓜(Cucurbita maschata)根系分泌物对其幼苗表现出高抑低促的作用(李明等,2005)。
2.1.3 物质分解植物凋落的花、果、枝、叶等在分解过程中释放内含物质或转化为次生物,从而影响植物生长。王芳等(2005)发现:茄子(Solanum melongena)秸秆在分解过程中能产生某些有毒物质明显地抑制茄子胚根、胚芽生长,且能阻碍植株对NO3-、PO43-、K+、Mg2+和Ca2+等离子的吸收,从而影响植物的正常发育。
2.1.4 淋溶作用树木在代谢过程中分泌多种氨基酸、有机酸、植物激素等微量生化物质,粘附于体表,被雨水、露水、雾淋溶而沉降于植物体或土壤中,进而对自身或其他植物生长产生直接或间接的影响。
2.1.5 其他途径有些植物其本身并不产生有毒次生物质,而是通过积累或利用环境中的物质对自身和其他植株产生影响。如柽柳(Tamarix spp.)就属于这样一种类型,植物生长于低盐土壤中,会由根系吸收并从叶片盐腺分泌出大量的氯化钠,进而使土壤深处的盐被输送到地表,在柽柳属植物周围形成高含盐区域,使植物本身和其他乔灌木生长受损(宋君, 1990)。
2.2 自毒物质的作用特点 2.2.1 复合效应自毒物质通常含有多种成分,各成分之间常协同起作用,混和物生理活性要比各成分单独作用的活性强。Blum等(1991)对酚酸、生物碱、倍半萜内酯、挥发性脂肪酸、挥发性甲基酮和醇的研究结果显示:几种化合物同时存在时其抑制作用可能是加成的或增效的,要比各个组分单独作用的效果显著。
2.2.2 浓度效应自毒物质作用效果随浓度变化而明显不同,这是自毒作用的最重要特征之一,并被很多研究结果所证实。自毒物质浓度高时抑制自身生长,而浓度低时促进其生长。如杉木(Cunninghamia lanceolata)根际土壤经丙酮和乙酸乙酯1:1混合提取并真空浓缩成浸膏后, 用杉木种子萌发和幼苗生长试验做生物检测。结果表明:绝对发芽率、绝对发芽势和根长生长率等指标均表现为200 mg·kg-1处理时较100和50 mg·kg-1处理,具有更强的抑制作用;杉木根际土壤提取物对绝对发芽率的最低抑制浓度为34 mg·kg-1,对绝对发芽势及根长生长率的最低抑制浓度分别为58和62 mg·kg-1(杜玲等,2003)。
2.2.3 选择性和专一性自毒物质对其作用的对象具有很强的选择性和专一性,即一种植物产生的某一类自毒物质可能只对本种或本属植物产生作用,而对其他种属植物却无影响。如藜科植物Atriplex bunburyana和A. codonocarpa种的叶浸提液可抑制Enchylaena tomentosa及Maireana georgei种子的萌发,而E.tomentosa和M.georgei叶的浸提液却不抑制A.codonocarpa种子的萌发,但这4种藜科植物叶浸提液对自身种子萌发都有抑制作用(Jefferson et al., 2003)。
2.2.4 复杂多样性自毒物质的作用是极其复杂多样的,不仅是简单的抑制或促进作用,还会对不同的器官产生完全不同的效应。如西瓜(Citrullus vulgaris)不同组织的水浸提物在低浓度时对其种子萌发率有抑制作用,而对胚根和胚轴的伸长具有促进作用,随浸提物浓度的增加,萌发率显著下降,并且极显著地抑制胚根和胚轴的伸长(王大力等,1996)。从胡萝卜(Paucus carota)种子的水浸液中分离鉴定出的巴豆酸即有自毒作用,又能抑制水芹(Oenanthe javanica)、黄瓜和洋葱(Allium cepa)的生长(Jasicka-Misiak et al., 2005)。另外,有些自毒作用物质还有杀虫、杀菌等作用(邹丽芸等,2004)。
2.3 自毒作用生物检测方法 2.3.1 模拟试验即在室内进行自毒作用的研究。由于室内试验条件不受外界气候、季节等的影响,可精确控制试验条件而排除其他不必要因素的干扰,并可进行无菌操作,能够根据试验设计需要来研究植物间的自毒作用。一般主要采用水培、砂培或组织培养等方法(阎飞等,2000)。
2.3.2 阶梯栽培法即将盆钵布置成阶梯状,采用循环营养液砂培和连续交替种植2种方法,使其受光一致,并消除对养分的竞争来研究其相互影响。
2.3.3 根渗出液循环栽培法主要是疏水性根渗出液连续收集法。树脂只吸附砂培中植物根所释放的疏水性物质,而不吸附营养元素,同时又能保持根的原状而不被扰动。
2.3.4 植物盒法鉴定植物与待测植物混植于琼脂培养基内,并将鉴定植物的根隔开,在根周围方格内种植待测植物,在较短的时间范围内鉴定根系分泌物中的自毒作用。
2.3.5 田间试验实验室模拟可以评估各种植物是否具有自毒作用的潜能,但要确认其自毒作用的发生,田间试验的证据是必不可少的。主要采用附加栽培法和置换栽培法来研究植物地下部分间的相互作用。
3 自毒作用的生理机制 3.1 改变膜透性抑制植物养分吸收自毒物质可以使细胞膜透性增加、内溶物外溢和增加膜质过氧化作用,导致植物组织生长缓慢或死亡。另外,自毒物质还能抑制植物从外界吸收养分,影响植物的正常生长发育。Politycka(1997)用苯甲酸和肉桂酸衍生物处理生长7天的黄瓜幼苗,发现酚类物质糖基化减退、苯基-β-葡糖基转移酶(PGT)活性降低与细胞膜透性的增加是联系在一起的。
3.2 抑制细胞分裂、伸长和亚显微结构研究发现自毒物质能抑制胚根伸长、细胞分裂,改变其亚显微结构,进而干扰植物的正常生长发育过程。Cruz等(1998)在研究自毒物质对菜豆(Phaseolous vulgaris)的影响时发现,菜豆根尖细胞被挤压在一起,组织出现紊乱并很少出现明显的细胞分化。另有研究表明:挥发性萜可抑制黄瓜幼苗有丝分裂(吕卫光等, 2002)。安息香酸处理芥末(Eutrema wasabi)根7 d后,生长抑制率达81.1 %,且根细胞排列紊乱,细胞器结构受到严重破坏(Harleen et al., 2005)。
3.3 影响植物光合与呼吸作用自毒物质对呼吸作用的影响主要表现为植物对氧吸收能力的减弱,而对光合作用的影响主要表现为使叶绿素含量和光合速率降低。吴凤芝等(2004)报道:苯丙烯酸浓度在80 μmol·L-1时显著降低了黄瓜幼苗的叶面积、叶绿素a含量、光合速率、蒸腾速率、根系活力,叶绿体和线粒体超微结构也受到破坏,而浓度达150 μmol·L-1时显著减少了全株干质量和气孔总数,细胞器出现解体现象。Yu等(2005)研究发现:根分泌物和水浸液处理黄瓜幼苗后, 叶气孔导度、蒸腾作用、细胞间CO2浓度都有不同程度的降低。
3.4 对各种酶功能和活性的影响自毒物质进入膜内可以改变某些酶的活性和功能。Rice等(1974)研究表明:绿原酸、咖啡酸和儿茶酚可抑制磷酸化酶的作用,肉桂酸及其衍生物可抑制ATP酶的水解作用,单宁可抑制过氧化物酶、过氧化氢酶、纤维素酶活性,而根皮苷可抑制叶绿体膜的ATP酶活性,进而影响种子萌发。Politycka(1998)研究表明:自毒物质影响POD、PAL的活性,其中香子兰酸(VA)在0.5和1 mol·L-1时,对POD活性的增加量分别为18%和47%,而在1 mol·L-1时,PAL活性却降低32%。
3.5 对内源植物激素合成代谢的影响植物激素水平受自毒物质的影响较大,它可降低植物激素的生理活性或使其失去活性以抑制植物正常的生理过程。何华勤等(2001)研究表明:羟基苯甲酸、酚类及类黄酮等化合物能影响吲哚乙酸与赤霉素的分解。另外,水稻叶片浸提液不同程度提高了受体植物吲哚乙酸氧化酶活性,从而降低了吲哚乙酸的水平(Ren et al., 2001)。Leslie等(1998)通过细胞悬浮培养研究发现水杨酸具有抑制乙烯合成的效应。
3.6 对蛋白质合成的影响阿魏酸和肉桂酸能抑制蛋白质的合成,许多酚类和生物碱也有抑制蛋白质合成的作用(何华勤等,2001)。水稻自毒物质通过抑制氨基酸运输以及蛋白质的合成而影响植株生长,酚酸类物质都降低磷向DNA和RNA的整合(Ni, 2000; Ren et al., 2001)。自毒物质不是孤立或单一地而是通过相互联系相互制约来发挥作用。如自毒物质引起内源激素分泌水平和调控能力的变化,进而影响相关基因的表达、酶活性与功能的改变及蛋白质合成的改变。图 2表示了自毒物质进入膜内引起的一系列生理生化变化(Kong et al., 2004)。

|
图 2 植物自毒作用机理示意图 Fig. 2 Mechanism of plants autotoxicity |
植物自毒作用及其对生态系统的影响已成为生态学研究的热点问题。自毒作用是一种自然现象,个体为了适应生存的需要分泌出自毒物质,抑制种内其他个体生长,以利于自身存在,这是植物在长期进化过程中所形成的一种适应策略(黄高宝等, 2003)。自毒作用是重要的生态化学因子,它对生态系统中的物质循环、能量流动、食物链类型、系统演替、系统多样性等很多方面都有影响。
4.1 对物质循环和能量流动的影响物质循环包括生物化学循环和生物地球化学循环,生物化学循环主要在生命系统活动库之间进行,由此成为自毒作用调控的对象。自毒作用可影响氮素、磷素生物循环。植物根分泌的酚酸,在低浓度下刺激固氮微生物生长,使其对NH4+-N和NO3--N需求增加,并使土壤中氮素循环由生物化学循环转为生物地球化学循环,改变其流向与流径(Blum et al., 1991)。自毒物质作为信息载体,通过影响植物对氮、磷的利用或它们在土壤中的状态而改变物质循环的流向、流径和流强,最终决定物质循环类型。自毒作用对能量流动的影响发生在能流的不同环节。自毒作用影响能流过程,使捕食过程减弱,如偏苦的自毒物质(生物碱、丹宁等)使一些动物避而远之,使草牧链能流损失增加,生态系统能量转换效率降低。
4.2 对食物链类型的影响自毒物质作为影响动物觅食口感的重要信息载体之一,影响了生态系统功能结构和食物链的类型(周青, 2003)。植物花粉中直链三烯酸是极强的诱蜂化合物,具有同种功能作用的化合物还有叶烯、桉树脑和香草醛等气味引诱剂,它们能吸引不同类型的动物来觅食。又如,荆豆(Ulex europaeus)顶枝在遭受美洲兔(Lepus americanus)过度取食后,枝条中外源毒素增多,兔子难以取食。这种化学保护可持续2~3年,由此造成食物链断裂。这些都是自毒物质影响生态系统功能结构和食物链类型的方式。
4.3 对系统演替和多样性的影响自毒物质可控制生态系统的演替速度、影响演替效应。红车轴草(Trifolium pratense)根分泌芒柄花苷、燃料木黄酮、黄豆苷原等抑制自身幼苗的生长,导致其他植物种类的入侵,进而影响系统演替过程。混交林可有效地抑制水土流失、培肥地力、促进中下层灌木及草本植物的生长,形成复杂稳定的群落结构,增强对外界不良环境条件的抗逆能力。自毒作用可影响植被的物种多样性和种内协调性,并对系统信息选择和物种多样性的构成方面发挥重要作用(Xuan et al., 2005)。
5 针叶林自毒作用研究现状与展望 5.1 针叶林自毒作用研究现状多数学者认为,导致针叶林更新能力和生产力下降的原因众多,其中针叶林无益代谢物的过度积累而形成的种内自毒作用可能是一个原因(王桂龙, 1992)。杜玲等(2003)对杉木研究后发现:杉木叶、根等器官水浸液和分泌物都对自身种子萌发和幼苗生长有不同程度的影响。如用根水浸液处理杉木6年后,各器官生物量有不同程度的降低,随着浓度加大其抑制作用增强;在低浓度时,有利于叶、皮、根、枝和干等器官生物量分配率;高浓度时,有利于枯枝落叶生物量分配率。杉木根际土壤经丙酮和乙酸乙酯1:1混合提取并真空浓缩成浸膏后,用杉木种子发芽试验做生物检测,结果表明:3种浓度处理的根际土壤提取物对种子萌发及幼苗的生长均有不同程度的抑制作用。1代和2代杉木纯林根系分泌物都减少幼苗鲜质量、胚根长度和胚芽长度,抑制幼苗正常生长发育。辐射松(Pinus radiata)产生的挥发性乙烯类物质抑制了种子萌发和幼苗生长,林下土壤腐根和根皮水浸液对幼苗亦有抑制作用(陈龙池等, 2003)。
研究发现:1)天山云杉凋落物水浸提取液对其种子萌发和幼苗生长存在自毒作用。当提取液浓度达到0.3 gDM·mL-1时,种子发芽势和发芽指数的抑制作用达到极显著,抑制率分别为14.5%和29.3%;当提取液浓度达到0.2 gDM·mL-1时,对幼苗鲜质量增加的抑制作用达到极显著,抑制率为31.4%,提取液对幼苗干质量增加的影响不显著;当提取液浓度为0.1 gDM·mL-1时,对种子发芽率和幼苗胚芽、胚根生长的抑制作用达到极显著,抑制率分别为21.2%、34.1%和51.3%,并显著延长种子的发芽时间;与此同时,试验结果还表明:在极低浓度(≤0.05 gDM·mL-1)时,凋落物提取液对其种子的发芽率表现出一定的促进作用。2)天山云杉针叶水浸提取液对其种子萌发和幼苗生长也存在自毒作用。在浓度较低时,自毒作用主要表现为对种子萌发的延迟;在浓度较高时,自毒作用表现为对种子萌发的抑制, 并且随着浓度的增大抑制作用逐渐增强。当提取液浓度达到0.1 gDM·mL-1时,对种子萌发的抑制作用达到极显著水平,抑制率达到31.3 %;当提取液浓度达到0.05 gDM·mL-1时,对幼苗胚根、胚芽伸长的抑制作用达到极显著水平,抑制率分别达到44.0%和27.8%(黄闽敏等,2005;罗侠等,2006)。
针叶林凋落物的主要成分为单宁、树脂和木质素等,这些物质在森林土壤中可转化为各种酚类物质,进而干扰树木的正常生长。凋落物缓慢分解过程中,形成的腐殖酸多为咖啡酸,酸性较强,入土后使土壤pH值降低,抑制微生物的生长和繁殖活动,使纤维素分解菌及氨化和硝化细菌等的减少,有机物质分解和转化速率降低。(张宪武等, 1981)。当这类土壤有机质积累到一定含量后,还抑制其他微生物如灰色变异链霉菌(Steptomyces griseovariabilis 2507)、镰刀霉(Fusarium spp.)、枝孢霉(Glomus jeosporum)和枯草牙孢杆菌(Bacillus thuringiensis)等的正常代谢活动,产生大量次生代谢物的积累(朱斌, 1999)。酚类在针叶林自毒作用中占有着重要作用,如肉桂酸、苯甲酸、对羟基苯甲酸和香草醛等酚类物质能在不同程度上抑制杉木幼苗的生长,主要是抑制幼苗根系活力,影响幼苗对养分的吸收,从而降低其生产力(陈龙池等, 2002a)。香草醛可显著抑制杉木幼苗生长,是杉木存活率低的重要原因之一(肖复明等, 2002)。浓度为1 mol·L-1时,香草醛能够显著抑制杉木林幼苗对NO32-、NH4+、SO42-及HPO42-离子的吸收和根系活力;浓度为0.01 mol·L-1时,香草醛却促进了杉木幼苗对HPO42-离子的吸收(陈龙池等, 2002b)。另有研究表明:连栽林地土壤各层的脲酶、转化酶、过氧化氢酶、过氧化物酶和磷酸酶活性明显低于头栽土壤,而多酚氧化酶活性却比头栽土壤高(朱斌等, 1999)。值得注意的是,任何物质都不是孤立存在的,在研究自毒作用的同时,需把自毒物质之间及与环境间的复合效应联合起来考虑(孔垂华, 1998)。
5.2 针叶林自毒作用研究展望自毒作用研究的目的是要为解决各种生态问题提供切实可行的方案,笔者认为应从以下3个方面重点展开研究工作:第一,在已有化学生态学研究手段和方法的基础上,结合植物生理学、生物化学和分子生物学研究手段,深入研究已知自毒物质的生理生态作用机制,揭示自毒物质产生、释放途径、环境转化和生态效应之间的内在规律,为有效利用和科学控制自毒作用的生态效应提供理论基础。第二,在已经明确自然火过程受到森林经营措施的干扰,针叶林生态系统自身排毒解毒机制受到限制的条件下,探询有效的方法来克服人为干扰对生态系统功能的影响,恢复生态系统健康,将是针叶林自毒作用研究的一个重要问题。第三,针叶林自毒作用研究与现代仪器分析手段和实验生态学方法结合,分离、鉴定新的自毒物质。根据已经获得的研究结果,建立自毒物质结构化学与作用机制数据库,从中筛选具有明确抑制杂草和细菌生长等功能,环境可降解的目标化合物,为新型除草剂和杀虫剂目标化合物筛选提供有效途径。
陈龙池, 黄志群, 廖利平, 等. 2002a. 几种自毒物质对杉木幼苗生长的影响. 应用与环境生物学报, 8(6): 588-591. |
陈龙池, 廖利平, 汪思龙, 等. 2002b. 酚类物质对杉木幼苗15N养分吸收、分配的影响. 植物生态学报, 26(5): 525-532. |
陈龙池, 汪思龙. 2003. 杉木根系分泌物化感作用研究. 生态学报, 23(2): 393-398. DOI:10.3321/j.issn:1000-0933.2003.02.025 |
陈龙池, 汪思龙, 陈楚莹. 2004. 杉木人工林衰退机理探讨. 应用生态学报, 15(10): 1953-1957. DOI:10.3321/j.issn:1001-9332.2004.10.050 |
杜玲, 曹光球, 林思祖, 等. 2003. 杉木根际土壤提取物对杉木种子发芽的化感效应. 西北植物学报, 23(2): 323-327. DOI:10.3321/j.issn:1000-4025.2003.02.023 |
何华勤, 林文雄. 2001. 水稻化感作用的初步研究. 中国生态农业学报, 9(2): 47-49. |
黄高宝, 柴强. 2003. 植物化感作用表现形式及其开发应用研究. 中国生态农业学报, 11(3): 172-174. |
黄闽敏, 潘存德, 罗侠, 等. 2005. 天山云杉针叶提取物对种子萌发和幼苗生长的自毒作用. 新疆农业大学学报, 28(3): 30-34. DOI:10.3969/j.issn.1007-8614.2005.03.008 |
孔垂华. 1998. 植物化感作用研究中应注意的问题. 应用生态学报, 9(3): 332-336. DOI:10.3321/j.issn:1001-9332.1998.03.024 |
黎华寿, 黄京华, 张修玉, 等. 2005. 香茅天然挥发物的化感作用及其化学成分分析. 应用生态学报, 16(4): 763-767. DOI:10.3321/j.issn:1001-9332.2005.04.036 |
李明, 马永清, 税军峰, 等. 2005. 南瓜组培根根系分泌物的化感效应研究. 应用生态学报, 16(4): 744-749. DOI:10.3321/j.issn:1001-9332.2005.04.032 |
梁文举, 姜勇. 2004. 苜蓿化感作用研究进展. 生态学杂志, 23(5): 186-191. DOI:10.3321/j.issn:1000-4890.2004.05.034 |
罗侠, 潘存德, 黄闽敏, 等. 2006. 天山云杉凋落物提取液对种子萌发和幼苗生长的自毒作用. 新疆农业科学, 43(1): 1-5. DOI:10.3969/j.issn.1001-4330.2006.01.001 |
吕卫光, 张春兰, 袁飞, 等. 2002. 自毒物质抑制连作黄瓜生长的作用机理. 中国农业科学, 35(1): 106-109. DOI:10.3321/j.issn:0578-1752.2002.01.021 |
宋君. 1990. 植物间的他感作用. 生态学杂志, 9(6): 43-47. |
王大力, 祝心如. 1996. 豚草的化感作用研究. 生态学报, 16(1): 11-19. |
王芳, 王敬国. 2005. 连作对茄子苗期生长的影响研究. 中国生态农业学报, 13(2): 51-53. |
吴凤芝, 潘凯, 马凤鸣, 等. 2004. 苯丙烯酸对黄瓜幼苗光合作用和细胞超微结构的影响. 园艺学报, 31(2): 183-188. DOI:10.3321/j.issn:0513-353X.2004.02.009 |
王桂龙. 1992. 植物间的他感作用及其应用. 作物研究, 6(3): 4-7. |
肖复明, 黄志群, 汪思龙, 等. 2002. 香草醛和对羟基苯甲酸对杉木幼苗生理特性的影响. 应用生态学报, 13(10): 1291-1294. DOI:10.3321/j.issn:1001-9332.2002.10.020 |
阎飞, 杨振明, 韩丽梅. 2000. 植物化感作用(A11elopathy)及其作用物的研究方法. 生态学报, 20(4): 692-696. DOI:10.3321/j.issn:1000-0933.2000.04.029 |
余叔文, 汤章城. 1998. 植物生理与分子生物学. 2版. 北京: 科学出版社, 710.
|
邹丽芸, 喻景权. 2004. 西瓜植株水浸提物对西瓜种子萌发的影响. 浙江农业科学, (4): 181-182. DOI:10.3969/j.issn.0528-9017.2004.04.006 |
周青. 2003. 化感作用对生态系统的影响. 自然杂志, 22(6): 320-322. |
朱斌. 1999. 杉木连栽障碍的原因及其对策. 中南林学院学报, 19(1): 76-78. DOI:10.3969/j.issn.1673-923X.1999.01.007 |
曾广文, 蒋德安. 2000. 植物生理学. 北京: 中国农业科学出版社, 203-223.
|
张宪武, 郑洪元, 张德生, 等. 1981. 森林有机残体分解与土壤酶活性. 微生物学杂志, 2(1): 17-19. |
Asao T, Hasegawa K, Sueda Y, et al. 2003. Autotoxicity of root exudates from taro. Scientia horticulturae, 97: 389-396. DOI:10.1016/S0304-4238(02)00197-8 |
Blum U, Lehman M E. 1999. Evidence for inhibitory allelopathic inter-actons involving phenolic acids in field sois concepts vs. an experimental model. Critical Reviews in Plant Sciences, 18: 673-693. DOI:10.1080/07352689991309441 |
Blum U, Gerig T M. 1991. Phenolic acid content of soils from wheat-no till, wheat-conventional till, and fallow-conventional till soybean cropping system. J Chem Ecol, 17(6): 1045-1068. DOI:10.1007/BF01402933 |
Canals R M, Emeterio L S, Peralta J. 2005. Autotoxicity in Lolium rigidum:analyzing the role of chemically mediated interactions in annual plant populations. Journal of Theoretical Biology, 235: 402-407. DOI:10.1016/j.jtbi.2005.01.020 |
Cruz O R, Anaya A L, Hernandez-Bautista B E, et al. 1998. Effects of allelochemical stress produced by sicyosdeppei on seedling root ultrastructure of Phaseolous vulgaris and Cucubita ficifolia. Journal of Chemical Ecology, 24(12): 2039-2057. DOI:10.1023/A:1020733625727 |
Hadacek F. 2002. Secondary metabolites as plant trait:current assessment and future perspectives. Critical Reviews in Plant Sciences, 21(4): 273-322. DOI:10.1080/0735-260291044269 |
Harleen K I, Shalini K. 2005. Cellular evidence of allelopathic interference of benzoic acid to mustard (Brassica juncea L.) seedling growth. Plant Physiology and Biochemistry, 43: 77-81. DOI:10.1016/j.plaphy.2004.12.007 |
Jasicka-Misiak I, Wieczorek P P, Kafarski P. 2005. Crotonic acid as a bioactive factor in carrot seeds(Daucus carota L.). Phytochemistry, 66: 1485-1491. DOI:10.1016/j.phytochem.2005.04.005 |
Jefferson L V, Pennacchio M. 2003. Allelopathic effects of foliage extracts from four Chenopodiaceae species on seed germination. Journal of Arid Environments, 55: 275-285. DOI:10.1016/S0140-1963(03)00028-4 |
Kong C H, Xu X H, Zhou B, et al. 2004. Two compounds from allelopathic rice accession and their inhibitory activity on weeds and fungal pathogens. Phytochemistry, 65: 1123-1128. DOI:10.1016/j.phytochem.2004.02.017 |
Leslie CA, Romani R J. 1998. Inhibition of ethylene biosynthesis by salicylic acid. Plant Physiol, 88: 833-837. |
Ni H W. 2000. Present status and prospect of crop allelopathy in China//Kim K U and Shin D H. Rice Allelopathy. Kyungpook: Kyunpook National University, 41-48
|
Politycka B. 1998. Phenolics and the activities of phenylalanine ammonia-lyase, phenol-beta-glucosyltransferase and beta-glucosidase in cucumber roots as affected by phenolic allelochemicals. Acta Physiol Plantarum, 20(4): 405-410. DOI:10.1007/s11738-998-0027-z |
Politycka B. 1997. Free and glucosylated phenolics, phenol-beta-glucosyltransferase activity and membrane perability in cucumber roots affected by derivatives of cinnamic and benzoic acid. Acta Physiologiae Plantarum, 19(3): 311-317. DOI:10.1007/s11738-997-0007-8 |
Ren S Z, Luo S M, Shi Y H, et al. 2001. Physiological and biochemical mechanism of allelopathy of secalonic acid on higher plants. Agron J, 93(1): 72-79. DOI:10.2134/agronj2001.93172x |
Rice E L. 1984. Allelopathy. 2nd Ed. New York: Academic Press, 1-5.
|
Rice E L. 1974. Allelopathy. 1st Ed. New York: Academic Press.
|
Singh H P, Batish D R, Kohli R K. 1999. Autotoxicity: concept, organisms, and ecological significance. Critical Reviews in Plant Sciences, 18: 757-772. DOI:10.1080/07352689991309478 |
Xuan T D, Shinkichi T, Khanh T D. 2005. Biological control of weeds and plant pathogens in paddy rice by exploiting plant allelopathy:an overview. Crop protection, 24: 197-206. DOI:10.1016/j.cropro.2004.08.004 |
Xuan T D, Tsuzuki E. 2004. Allelopathic plants:Buckwheat. Allelopathy J, 13: 137-148. |
Yu J Q, Ye S F, Zhang M F, et al. 2005. Effects of root exudates and aqueous root extracts of cucumber(Cucumis sativus) and allelochemicals, on photosynthesis and antioxidant enzymes in cucumber. Biochemical Systematics and Ecology, 31: 129-139. |
 2007, Vol. 43
2007, Vol. 43
