文章信息
- 翟树伟, 杨大荣, 彭艳琼, 徐磊, 白莉芬.
- Zhai Shuwei, Yang Darong, Peng Yanqiong, Xu Lei, Bai Lifen.
- 聚果榕与大果榕隐头果内雌花花柱分布方式及与其传粉蜂间的关系
- Compare of Style Length of Female Florets and Relationship with Their Fig Pollinating Wasps in Monoecious Ficus racemosa and Dioecious Ficus auriculata
- 林业科学, 2007, 43(6): 67-71.
- Scientia Silvae Sinicae, 2007, 43(6): 67-71.
-
文章历史
- 收稿日期:2006-11-07
-
作者相关文章
2. 中国科学院研究生院 北京 100049
2. Graduate University of Chinese Academy of Sciences Beijing 100049
榕属植物与榕小蜂互惠共生系统被认为是研究物种协同进化关系最有代表性的模式系统之一(Ramirez, 1970; Wiebes, 1979; Herre, 1999; 杨大荣等,2001;2005)。目前,全世界已知榕树有750多种,其中雌雄同株与雌雄异株榕树几乎各占一半(Berg, 1989)。雌雄同株榕树的单个榕果内既产生榕小蜂和花粉,同时也产生种子(Kathuria, 1999; 杨大荣等,2001; Weiblen, 2002)。在雌花期的榕果中,雌花分成数层排列,但几乎所有的雌花柱头都在同一平面上,这是由于花柱和花梗长度的变异所致(Ganeshaiah et al., 1999)。传粉榕小蜂通常更倾向于产卵于其子房靠近榕果果腔的短柱雌花内(Nefdt et al., 1996; Anstett, 2001; Jousellin et al., 2001),长柱雌花被传粉受精通常发育成为种子。雌雄异株榕树具有两种不同功能型的隐头果,即雄果(gall fig)和雌果(seed fig),分别结在功能性雄株和雌株上。雄果通常产生榕小蜂和花粉,而雌果只产生种子(Kjellberg et al., 1987; Yang et al., 2002; 彭艳琼等,2005)。在隐头果雌花期时,雄果和雌果不论在外观形态上还是在所释放出的挥发性吸引物上都十分相似,从而导致传粉榕小蜂进入雌果(Song et al., 2001; Moore et al., 2003)传粉,却不能产生后代。
榕树和榕小蜂的繁殖都必须依赖于隐头果中的雌花,二者之间存在繁殖利益冲突。与其他的共生系统一样,榕树与榕小蜂之间并不存在亲缘关系,因此它们相互之间应该不会表现出利它行为。关于榕小蜂为什么不占用隐头果中的所有雌花资源来繁殖自身后代的问题,很多研究者认为是由于雌花花柱长度的高度变异(Jazen, 1979; Ganeshaiah et al., 1999)和榕小蜂通常利用短柱雌花繁殖(West et al., 1994; Nedft et al., 1996; Jousselin et al., 2001)所致。Shi等(2006)通过对雌雄异株榕树对叶榕以及歪叶榕的隐头果内雌花的形态观察得到,联合花柱以及柱头的形状可能也是影响传粉榕小蜂产卵效率的重要原因。从进化角度来说,雌雄同株是相对原始的,雌雄异株较为进化(Weiblen, 2000)。本文中,我们比较了同一亚属内的雌雄同株榕树聚果榕与雌雄异株榕树大果榕在雌花资源分配上的差异,以此得到它们在分配繁育种子以及小蜂的雌花的不同机制。
1 材料与方法 1.1 材料聚果榕(Ficus racemosa)雌雄同株,隶属于聚果榕亚属。乔木,高25~30 m。叶薄革质,椭圆状倒卵形。隐头果聚生于老茎上的瘤状短枝,稀成对于落叶枝叶腋,梨形。生于海拔500~1 200 m的溪边、河畔。其传粉昆虫为聚果榕小蜂(Ceratosolen fusciceps)。
大果榕(Ficus auriculata)雌雄异株,隶属于聚果榕亚属。灌木或小乔木。叶互生,厚纸质,广卵状心形。隐头果簇生于老茎,大梨形或扁球形至陀螺形。生于海拔50~1 500 m的热带、亚热带沟谷林中。其传粉昆虫为大果榕小蜂(C. emarginatus)。
1.2 方法 1.2.1 雌花期隐头果内花柱长度及传粉榕小蜂产卵器长度测量由于传粉榕小蜂在隐头果的雌花期进入榕果进行产卵以及传粉,因此我们采集处于雌花期的隐头果带回实验室。聚果榕5株样树共采集20个隐头果,大果榕3株雌树共采集6个隐头果,5株雄树共采集10个隐头果。把每个果平均切为4份,每份随机挑取5~6朵小花。每果至少挑20朵小花。利用Olympus(SZX12)体式显微镜对小花长度进行测量。同时我们采集雄花期的隐头果内刚羽化的传粉榕小蜂测量其产卵器长度。
1.2.2 聚果榕雄花期隐头果内种子花梗长度以及传粉榕小蜂所在瘿花花梗长度测量采集隐头果雄花期小蜂尚未羽化但是种类已经可以辨别时的隐头果共10个,带回实验室。每果平均分为4份,每份随机挑取7~8粒种子,并测量其花梗长度,共测量281朵。每份随机挑取瘿花20~25朵,并测量记录花梗长度,然后鉴别小蜂种类,将含有传粉榕小蜂的瘿花进行记录,共得到含有传粉榕小蜂的瘿花554朵。
1.3 数据分析运用Excel及Spss软件进行相应的统计分析。Tamhane’s T2用来比较聚果榕隐头果内小花花柱长度与大果榕雌株以及雄株内小花花柱的差异显著度。Mann-Whitney U用于比较大果榕与聚果榕的传粉榕小蜂产卵器长度以及大果榕雌雄株隐头果内雌花花柱长度差异。
2 结果与分析 2.1 两种不同榕树中花柱以及对应传粉榕小蜂产卵器长度聚果榕隐头果内的花柱长度介于木瓜榕(F.auriculata)的雌株与雄株之间,三者之间具有显著性差异(Tamhane’s T2: F= 385.001, P < 0.001)。聚果榕花柱长度平均为1.679 8 mm,而其传粉榕小蜂的产卵器长度为1.783 4 mm。单从数值来看,聚果榕传粉榕小蜂的产卵器长度足以到达大部分的雌花子房。但是花柱长度的变异要比产卵器长度的变异大,说明聚果榕利用变异较大的花柱长度限制传粉榕小蜂的过度产卵,以保证种子的形成。雌雄异株榕树大果榕的雌果与雄果内花柱长度具有显著的差异(Mann-Whitney U: Z=-16.549, P < 0.001)。其传粉榕小蜂产卵器长度大于雄果内的花柱长度,却远远小于雌果内的花柱长度。因此大果榕雄果用于养育榕小蜂,雌果只能产生种子,很少留下其传粉者后代。
2种榕树的传粉榕小蜂产卵器长度具有明显的差异(Mann-Whitney U: Z=-7.985, P < 0.001)。聚果榕的传粉榕小蜂产卵器长度显著大于大果榕的传粉榕小蜂产卵器长度。这是传粉榕小蜂根据寄主榕树的进化所产生的相应的协同进化。大果榕传粉榕小蜂产卵器长度变异高于聚果榕传粉榕小蜂表明,由雌雄同株榕树进化到雌雄异株榕树后,雄果内小蜂数量的多少决定于传粉榕小蜂的产卵器长度的大小;而聚果榕内小蜂数量的调节更多的依靠于榕树本身对雌花资源的分配方式。
|
|
聚果榕内的花柱长度呈单峰分布方式,其范围为0.25~3.75 mm,绝大多数的花柱长度位于1~2.5 mm的范围内。其传粉榕小蜂的产卵器长度位于1.75 ~2 mm的范围内,处于峰值的位置,表明传粉榕小蜂倾向于将卵产到短花柱雌花中,一部分长柱雌花不能被其产卵(图 1)。而相比来说,大果榕的雌花花柱长度呈双峰分布,它的传粉榕小蜂产卵器长度分布于雄树隐头果内的雌花花柱分布范围内,而与雌株内雌花花柱的分布分离较远,只有很小一部分产卵器长度与雌株内的短花柱雌花分布一致(图 2)。因此,大果榕的传粉榕小蜂只能在雄株隐头果内产卵,而在雌株隐头果内它们只能为榕树传粉,很少留下自己的后代。
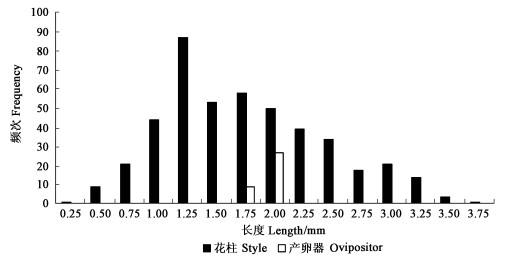
|
图 1 聚果榕隐头果内花柱以及传粉榕小蜂产卵器长度分布 Fig. 1 The style and ovipositor length distribution in F. racemosa |

|
图 2 大果榕隐头果内花柱以及传粉榕小蜂产卵器长度分布 Fig. 2 The style and ovipositor length distribution in F. auriculata |
在聚果榕隐头果内,传粉榕小蜂与种子竞争雌花资源。从图 3中可以看出,种子占用的小花资源与传粉榕小蜂所利用的小花资源具有分离趋势。种子一般产生在短花梗的小花中,其分布范围为0.3~3.3 mm。而传粉榕小蜂可以利用花梗长度从0.3~6. 3 mm的所有雌花,呈双峰分布,但更倾向于在长花梗的瘿花中生长。这种花梗长度反映到小花在隐头果内的位置,即靠近果壁的小花倾向于产生种子,这类小花通常具有较长的花柱;传粉榕小蜂倾向于生长于靠近果腔的小花子房中,而这种小花的花柱通常较短。

|
图 3 雄花期聚果榕隐头果内种子以及传粉榕小蜂所在瘿花的花梗长度分布 Fig. 3 The pedicel length distribution of seeds and galls with pollinators in post-flora stage of syconia in F. racemosa |
长久以来,榕树隐头果内小花资源的分配受到很多学者的关注(Jazen, 1979; Bronstein, 1988; Verkerke, 1989; West et al., 1994; Kathuria et al., 1995; Kathuria, 1999)。虽然传粉榕小蜂已经与其寄主榕树形成了高度的互惠共生关系,但榕小蜂与榕树都利用共同资源繁衍后代,两者之间也不可避免的存在着对共同资源的竞争。在雌雄同株榕树中,这种竞争更加激烈,因为小蜂与种子同时产生在同一隐头果内。在雌雄异株榕树的繁殖体系中,它们有功能性的雌雄株榕树,雄树隐头果用于养育榕小蜂,而雌树用于产生种子,因此对资源的竞争相对较小。
从本研究结果来看,雌雄同株榕树聚果榕中的雌花花柱长度变异较大,因而当传粉榕小蜂进入隐头果产卵时,它们将要花费更多的时间探测合适的小花进行产卵。而传粉榕小蜂的存活时间较短,需要把它的时间分配到寻找小花以及产卵两个不同的过程中(Douglas et al., 2004)。而另一个限制传粉榕小蜂产卵的原因可能是先于传粉榕小蜂产卵的非传粉小蜂的影响。在聚果榕隐头果内有一类造瘿非传粉小蜂(Platyneura testacea)(张光明等,2003;徐磊等,2003),在花前期便到达隐头果产卵,占据了一部分小花子房,而且它们通常制造较大的瘿花,伸入到果腔。这对进入果腔产卵的传粉榕小蜂影响很大,既增加了种间竞争,又使其爬行寻找合适雌花的过程更加困难。
在大果榕中,雄株隐头果内的花柱长度要小于传粉榕小蜂产卵器长度,而且变异度较小。而雌株隐头果内的花柱长度要远远大于其传粉榕小蜂产卵器长度,因而可以大大限制传粉榕小蜂将卵产到其子房中。雌雄异株榕树运用将短花柱与长花柱分离到不同隐头果中的策略来更大限度的平衡小蜂与种子之间对资源的竞争,其优势要显著高于雌雄同株榕树。
3.2 种子以及传粉榕小蜂在两种不同榕树隐头果内的分布方式比较聚果榕隐头果同时产生种子并养育传粉榕小蜂。图 3表明种子与传粉榕小蜂在利用小花资源时具有空间上的分化。在隐头果生长到雄花期时,部分小花的花柱已经干枯萎缩,小花的花梗长度成为衡量各个小花所在空间位置的指标(Anstett et al., 1996)。聚果榕隐头果中,产生种子的小花花梗长度跨度不大。最长的花梗长度只有3.9 mm,而且占有此长度的种子数量很少,大部分的种子花梗长度在0.6~2.7 mm的范围内。可见这与以往的学者们得到的结论是一致的(Anstett, 2001),即种子倾向于产在靠近果壁的小花中,此类小花在雌花期时一般具有较长的花柱,限制了传粉榕小蜂的产卵,却在小蜂产卵的过程中接受了花粉,受精发育成为种子。而传粉榕小蜂更倾向于生长在具有较长花梗的瘿花子房内,主要有以下几方面的优势:具有较大的发育空间;获得更多的交配机会;在雄虫打好出蜂口后,雌蜂可以快速出蜂寻找新的接收期的榕果。但是为什么仍有部分榕小蜂生长于靠近果壁的瘿花子房呢? Jousellin等(2001)通过试验得到,当有较多的母代小蜂进入隐头果产卵时,竞争加剧,而且它们一般不能再离开此隐头果,因此后来的传粉榕小蜂只好利用花柱较长的小花,虽然这对它们非常不利。
就大果榕而言,它们不存在隐头果内小花资源的分配问题,因而种子与传粉榕小蜂对资源的竞争大大减少,极好的避免了共生体系中矛盾冲突的存在。由此看来,雌雄异株榕树大果榕比雌雄同株榕树聚果榕在进化上具有更大的优势。
彭艳琼, 杨大荣, 段柱标, 等. 2005. 影响对叶榕及其传粉者繁殖的生态学因素. 植物生态学报, 29(5): 793-798. DOI:10.3321/j.issn:1005-264X.2005.05.013 |
徐磊, 杨大荣, 彭艳琼, 等. 2003. 西双版纳聚果榕隐头果内小蜂群落结构及种间关系. 生态学报, 23(8): 1554-1560. DOI:10.3321/j.issn:1000-0933.2003.08.013 |
杨大荣, 赵庭周, 王瑞武, 等. 2001. 西双版纳热带雨林聚果榕小蜂的传粉生态学. 动物学研究, 22(2): 126-130. |
杨大荣, 彭艳琼, 赵庭周, 等. 2005. 聚果榕内种子季节变化与聚果榕小蜂活动的关系. 林业科学, 41(1): 25-29. DOI:10.3321/j.issn:1001-7488.2005.01.006 |
张光明, 杨大荣, 徐磊, 等. 2003. 西双版纳聚果榕榕果小蜂种间联结性研究. 生态学杂志, 22(4): 20-26. DOI:10.3321/j.issn:1000-4890.2003.04.005 |
Anstett M C, Bronstein J L, Hossaert-McKey M. 1996. Resource allocation: a conflict in the fig/fig wasp mutualism?. Journal of Evolution Biology, 9: 417-428. DOI:10.1046/j.1420-9101.1996.9040417.x |
Anstett M C. 2001. Unbeatable strategy, constraint and coevolution, or how to resolve evolutionary conflicts: the case of the fig/wasp mutualism. Oikos, 95: 476-484. DOI:10.1034/j.1600-0706.2001.950313.x |
Berg C C. 1989. Classification and distribution of Ficus. Experientia, 45: 601-611. DOI:10.1007/BF01975676 |
Bronstein J L. 1988. Mutualism, antagonism, and the fig-pollinator interaction. Ecology, 69: 417-428. |
Douglas W Y, Ridley J, Jousselin E, et al. 2004. Oviposition strategies, host coercion and stable exploitation of figs by wasps. Proceedings of Royal Society of London B, 271: 1185-1195. DOI:10.1098/rspb.2003.2630 |
Ganeshaiah K N, Katyuria P, Shaanker R U. 1999. Does optimal packing of flowers in syconia shape style length variation in monoecious figs?. Biotropica, 31: 312-320. DOI:10.1111/j.1744-7429.1999.tb00143.x |
Herre E A. 1999. Laws governing species interactions? Encouragement and caution from figs and their associates. In: Keller L. Levels of selection in evolution. Princeton, NJ: Princeton Univ Press, 209-235
|
Jazen D H. 1979. How to be a fig. Annual Review of Ecological System, 10: 13-51. DOI:10.1146/annurev.es.10.110179.000305 |
Jousselin E, Hossaert-Mckey M, Vernet D, et al. 2001. Egg deposition patterns of fig pollinating wasps: implications for studies on the stability of the mutualism. Ecological Entomology, 26: 602-608. DOI:10.1046/j.1365-2311.2001.00368.x |
Jousselin E, Kjellberg F. 2001. The functional implications of active and passive pollination in dioecious figs. Ecology Letters, 4: 151-158. DOI:10.1046/j.1461-0248.2001.00209.x |
Kathuria P, Ganeshaiah K N, Shaanker R U, et al. 1995. Is there dimorphism for style lengths in monoecious figs?. Current Science, 68: 1047-1049. |
Kathuria P. 1999. The pollination biology of monoecious fig trees in India. PhD Thesis, University of Leeds
|
Kjellberg F, Gouyon P H, Ibrahim M, et al. 1987. The stability of the symbiosis between dioecious figs and their pollintors: a study of Ficus carica L. Evolution, 41: 693-704. DOI:10.1111/j.1558-5646.1987.tb05846.x |
Moore J C, Hatcher M J, Dunn A M, et al. 2003. Fig choice by the pollinator of a gynodioecious fig: Selection to rush, or intersexy mimicry?. Oikos, 101: 180-186. DOI:10.1034/j.1600-0706.2003.12212.x |
Nefdt R J C, Compton S G. 1996. Regulation of seed and pollinator production in the fig-fig wasp mutualism. Journal of Animal Ecology, 65: 170-182. DOI:10.2307/5720 |
Ramirez B W. 1970. Host specificity of fig wasps(Agaonidae). Evolution, 24: 680-691. DOI:10.1111/j.1558-5646.1970.tb01804.x |
Shi Z H, Yang D R, Peng Y Q. 2006. The style-length of the female florets and their fate in two dioecious species of Xishuangbanna, China. Trees- structure and function, 20: 410-415. DOI:10.1007/s00468-006-0054-6 |
Song Q S, Yang D R, Zhang G M, et al. 2001. Volatiles form Ficus hispida and their attractiveness to fig wasps. Journal of Chemistry Ecology, 27: 1929-1942. DOI:10.1023/A:1012226400586 |
Verkerk W. 1989. Structure and function of the fig. Experientia, 45: 612-621. DOI:10.1007/BF01975678 |
Weiblen G D. 2000. Phylogenetic relationships of functionally dioecious Ficus (Moraceae) based on ribosomal DNA sequences and morphology. American Journal of Botany, 87: 1342-1357. DOI:10.2307/2656726 |
Weiblen G D. 2002. How to be fig wasp. Annual Review of Entomology, 47: 229-230. |
West S A, Herre E A. 1994. The ecology of the New World fig-parasitizing wasps Idarnes and implications for the evolution of the fig-pollinator mutualism. Proceedings of Royal Society of London B, 258: 67-72. DOI:10.1098/rspb.1994.0143 |
Wiebes J T. 1979. Coevolution of figs and their insect pollinators. Annual Review of Ecology System, 10: 1-12. DOI:10.1146/annurev.es.10.110179.000245 |
Yang D R, Peng Y Q, Song Q S, et al. 2002. Pollination biology of Ficus hispida in the tropical rainforests of Xishuangbanna, China. Acta Botanical Sinica, 44: 519-526. |
 2007, Vol. 43
2007, Vol. 43


