文章信息
- 王庆菊, 李晓磊, 王磊, 陈学森, 沈向.
- Wang Qingju, Li Xiaolei, Wang Lei, Chen Xuesen, Shen Xiang.
- 桃、李属红叶树种叶片光合特性
- Photosynthetic Characteristics of Red-Leaf Tree Species in Amygdalus and Prunus
- 林业科学, 2007, 43(6): 32-37.
- Scientia Silvae Sinicae, 2007, 43(6): 32-37.
-
文章历史
- 收稿日期:2006-05-25
-
作者相关文章
紫叶桃(Amygdalus persica f. atropurpurea)、紫叶李(Prunus cerasifera ‘Pissardii’)、美人梅(P.×bliriana ‘Meirenmei’)及紫叶矮樱(P.×cistena ‘Pissardii’)分别为蔷薇科(Rosaceae)桃属(Amygdalus)和李属(Prunus)植物,形态和生理相似性很高,彼此可以相互嫁接。同时,上述树种生长季叶片常为紫红色,作为重要的园林美化树种,对园林的构图、配色等起到点睛作用。虽然这类特殊叶色植物在园林实践中应用甚多,但生理研究甚少,以基础性的光合作用来说,国内仅姚砚武等(2000)、庄猛等(2005)做过红叶树种光合作用的研究。这类植物的色彩是由于叶片含有花青苷造成的, 而花青苷中糖配基正是植物光合作用的产物,因此花青苷的存在可能从不同侧面影响到光合作用。
本研究以上述4个桃、李属红叶树种为试材,以同属绿叶树种油蟠桃(A. persica var. compressa)和玉皇李(P. salicina ‘Yuhuangli’)为对照,对其叶片色素、反射光谱、光合速率日变化及叶绿素荧光参数进行检测,以探索叶色不同的树种之间光合特性的差异以及各生理指标对不同树种光合性能的影响,为红叶树种的栽培、育种及园林植物配置提供理论依据。
1 材料与方法 1.1 供试材料试验于山东农业大学果树实验园内进行。以2年生的盆栽紫叶桃、紫叶李、美人梅、紫叶矮樱、油蟠桃及玉皇李为试材,盆土为有机肥:土为1:4 (V/V)的混合物,进行常规的田间管理。2004年6月10—12日晴天时,选择树体大小一致、生长良好的苗木的当年生枝自顶端数第5—6片健康成熟叶进行测定。每树种取3盆,每盆选择5片叶进行测定。
1.2 色素含量的测定花青苷的测定参考仝月澳等(1982)的方法,将叶片取回,洗净,擦干,剪碎后,采用1.5 mol·L-1 HCl:95%乙醇=15:85(V/V)混合液,在黑暗条件下浸提24 h,后用岛津UV-2450紫外光可见分光光度计检测535 nm波长的光密度值,参照胡位荣等(2004)的计算方法进行花青苷含量的计算。叶绿素a、b和类胡萝卜素的含量参照Lichtenthaler等(1983)的方法测定,总叶绿素用叶绿素a与b的含量之和表示。
1.3 叶片反射光谱的测定采用英国PP Systems国际有限公司生产的UnispecTM光谱分析系统测定叶片的反射光谱。选择晴朗无风天气进行测定,测定方法参照光谱分析系统用户手册中反射光谱测量方法。
1.4 光合速率日变化的测定采用美国LI-COR公司的LI-6400便携式光合测定系统,测定光合速率日变化。多年测定结果表明,6月中旬是供试植物光合特性最为典型的测定时间,故于6月10—12日晴天时,8:00—17:00每隔1 h测定6个树种的光合速率(Pn)、气孔导度(Gs)、细胞间隙CO2浓度(Ci)、蒸腾速率(Tr)、大气温度(tair)以及光强(PFD)。以3 d平均值作为光合速率的日变化(蔡永萍等,2004)。
1.5 叶绿素荧光参数的测定用英国Hansatech公司生产的FMS2型脉冲调制荧光仪,在光合速率测定的同时,按照李志等(2004)的方法测定叶绿素荧光参数。光系统Ⅱ(PSⅡ)最大光化学效率Fv/Fm=(Fm-Fo)/Fm,光化学猝灭系数qP=(Fm′-Fs)/(Fm′-Fo′);PSⅡ量子效率ΦPSⅡ=(Fm′-Fs)/Fm′,非光化学猝灭系数NPQ=(Fm-Fm′)/Fm′。
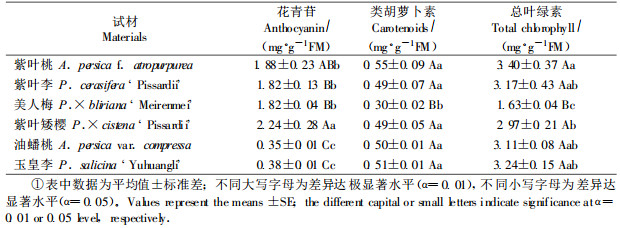
2 结果与分析 2.1 光强及气温日变化6月中旬泰安地区PFD和大气温度日变化如图 1所示。一天中光强最大值1 600 μmol·m-2s-1左右, 11:00 —14:00 PFD值均大于1 000μmol·m-2s-1, 14:00后迅速下降。昼间气温在24~39 ℃之间, 13 :00左右上升到一天中的最高值, 随后缓慢下降。
|
图 1 大气温度和光强日变化 Fig. 1 Diurnal changes of photon flux density(PFD) and air temperature (ta) |
不同树种之间色素的含量存在一定差异, 对色素的含量进行方差分析, 结果如表 1所示, 红叶树种与绿叶树种叶片花青苷含量差异极显著, 红叶树种花青苷的含量是绿叶树种的5倍左右。在类胡萝卜素和总叶绿素的含量上, 除美人梅外, 红叶树种与绿叶树种无显著差异。
|
|
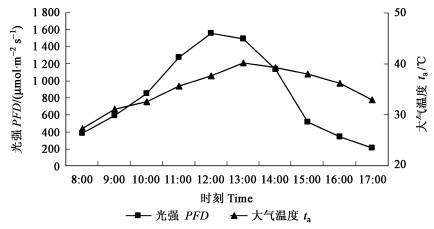
如图 2所示,在380~780 nm的可见光范围内,红叶树种和绿叶树种叶片的反射率和反射光谱波段均存在显著差异。就反射率而言,红叶树种的反射率均低于绿叶树种。在490~590 nm的黄绿光区,红叶树种的反射率明显低于绿叶树种;在590~670 nm的橙红光区,红叶树种叶片的反射率有小幅上升,与绿叶树种叶片的反射率接近。并且红叶树种叶片的透射率要低于绿叶树种(数据未列出),因此,红叶树种叶片光能的吸收要高于绿叶树种。
|
图 2 不同试材叶片反射率 Fig. 2 Reflective rate of leaves in different materials ①紫叶桃A.persica f. atropurpurea; ②紫叶李P.cerasifera ‘Pissardii’;③美人梅P.×bliriana ‘Meirenmei’; ④紫叶矮樱P.×cistena ‘Pissardi’; ⑤油蟠桃A.persica var. compressa; ⑥玉皇李P.salicina ‘Yuhuangli’.下同。The same below. |
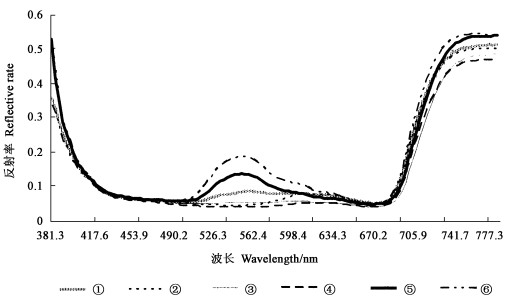
净光合速率的测定结果表明,各树种的Pn日变化均呈双峰曲线(图 3),第1峰值较高,出现在11:00左右, 第2个峰值较低出现在14:00左右。所不同的是,首先全天红叶树种的净光合速率均低于绿叶树种,以第1峰值计红叶树种的平均值比绿叶树种低约25%,以全天的平均值计算,红叶树种全天净光合速率的平均值极显著低于绿叶树种(α=0.01)。其次,各树种的光合“午休”持续时间不同,红叶树种光合午休持续时间短,Pn在11:00左右开始下降,12:00左右达到全天最低值,随后即迅速回升,光合“午休”持续时间约为1 h;而绿叶树种Pn开始下降的时间虽然相同,但到13:00左右达到全天的最低值,光合“午休”持续约2 h后Pn才开始回升。红叶树种间Pn日变化趋势略有差异,主要体现在光合“午休”开始的时间和“午休”过程中Pn的降低以及回升的幅度上。从光合开始的时间上看,紫叶李“午休”时间开始最早,在10:00左右,其他3个红叶树种均在11:00左右;从“午休”过程中Pn的降低以及回升幅度上看,紫叶矮樱和紫叶李低于紫叶桃和美人梅。与之相比,绿叶树种Pn日变化趋势较为一致。
|
图 3 不同试材净光合速率日变化 Fig. 3 Diurnal changes of net photosynthetic rate in different materials |
气孔导度、蒸腾速率、细胞间隙CO2浓度等均与净光合速率存在着不同的相关关系,但红叶树种与绿叶树种之间各相关生理指标与净光合速率的相关关系趋势相同(图 4)。红叶树种、绿叶树种叶片净光合速率与气孔导度和蒸腾速率均呈直线相关关系。2种叶色树种中,净光合速率与细胞间隙CO2浓度呈二次曲线关系,根据回归方程可以计算出红叶树种的CO2补偿点约为36 μmolCO2·mol-1,当Ci为190 μmol CO2·mol-1左右时净光合速率达到最大值,而绿叶树种的CO2补偿点的平均值高于红叶树种,为50 μmol CO2·mol-1左右,当Ci为200 μmol CO2·mol-1左右时,绿叶树种的净光合速率达到最大值。由不同叶色树种中各生理指标与净光合速率的相关关系来看,红叶树种与绿叶树种净光合速率和光合“午休”持续时间的差异不是由这些与光合相关的生理指标引起。

|
图 4 红叶树种(上)与绿叶树种(下)气孔导度(Gs)、细胞间隙CO2浓度(Ci)、蒸腾速率(Tr)与净光合速率(Pn)的相关性分析 Fig. 4 Correlations between net photosynthetic rate and stomatal conductance(Gs), intercellular CO2 concentration(Ci), transpiration rate(Tr) in red leaf plants(upper) and green leaf plants(below) |
由图 5可见,Fv/Fm、ΦPSII、qP均是早上6:00测定值最高,8:00以后迅速降低,12:00左右达到一天中的最低点,下午18:00左右Fv/Fm、ΦPSII、qP值均低于早上6:00的测定值。NPQ日变化规律与前三者不同,6:00左右NPQ最低,随光强的升高NPQ升高,12:00左右达最高值,之后随光强的减弱NPQ降低。
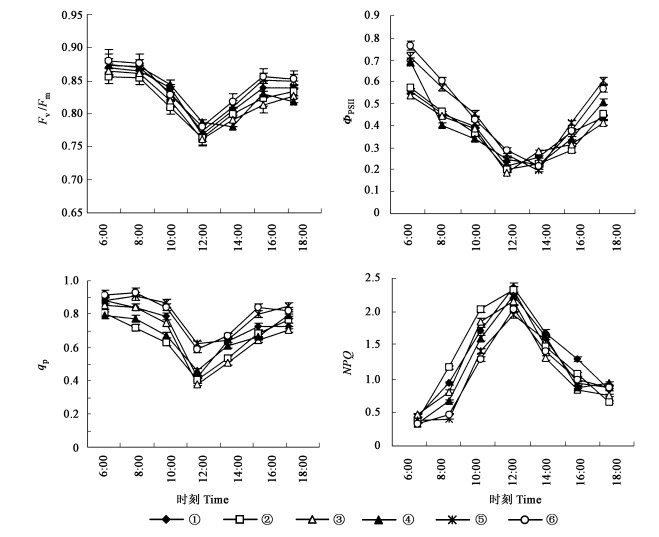
|
图 5 不同试材荧光参数日变化 Fig. 5 Diurnal variation of chlorophyll fluorescence parameters in different materials |
Fv/Fm日变化表现“V”形(图 5),10:00左右光强约850 μmol·m-2s-1以后光抑制程度增强,12:00左右光强最强时光抑制程度最高,以后随光强的减弱光抑制程度降低。6个树种一天中均受到不同程度的光抑制,12:00左右紫叶桃、紫叶李、美人梅、紫叶矮樱、油蟠桃、玉皇李Fv/Fm的降幅分别为12.8%、11.7%、13.0%、10.8%、12.6%、12.3%,Fv/Fm降低是光抑制的显著特征(Demming et al., 1987;董高峰等,1999),光抑制程度最轻的为紫叶矮樱,这反映在紫叶矮樱的Pn上,与Pn一直保持较高水平有一定的相关性。但总体来看,红叶树种的光抑制程度与绿叶树种差异不显著,18:00各树种Fv/ Fm值均低于6:00时的值,表明光合机构均受到损伤。
绿叶树种的ΦPSⅡ变化整体上高于红叶树种,并且14:00以后PSⅡ实际光化学效率恢复较快,ΦPSⅡ与PSⅡ非环式光合电子传递成正相关(Demming et al., 1987),由此可见,绿叶树种光系统受损伤程度较轻。
全天红叶树种qP平均值较绿叶树种低,特别是12:00左右,红叶树种qP显著低于绿叶树种,这表明红叶树种叶片吸收的光能转化成化学能的效率低于绿叶树种。另外,红叶树种和绿叶树种NPQ全天的平均值分别约为0.94、1.14,两者NPQ差异达到极显著水平。NPQ大小被广泛应用于评价植物安全耗散过剩激发能的能力(齐欣等,2004),红叶树种和绿叶树种NPQ的差异表明,红叶树种安全耗散过剩激发能的能力高于绿叶树种。由此可见,红叶树种较高的花青苷含量导致过剩光能的吸收,而所吸收的过剩光能通过非光化学猝灭NPQ安全耗散掉,以保护光合机构。但总体来看,过剩的光能不能彻底耗散,因此导致了光合机构受损,因此全天的净光合速率低于绿叶树种。
3 讨论除美人梅外,红叶树种和绿叶树种之间叶绿素、类胡萝卜素等光合色素的含量差异不显著,而红叶树种中花青苷的含量是绿叶树种的5倍左右。色素在叶片中含量和分布的差异,影响了叶片反射光谱的差异,同时也影响了叶片对光能的吸收。因此,红叶树种叶片的光能吸收要高于绿叶树种。光是植物光合作用的能量来源,植物叶片对光的截获可能会直接影响植物的光合作用。
本试验结果表明,红叶树种和绿叶树种的净光合速率日变化为双峰曲线,且红叶树种全天净光合速率的平均值极显著低于绿叶树种(α=0.01),另外,各树种的光合“午休”持续时间不同,红叶树种光合“午休”持续时间短。由红叶和绿叶树种气孔导度、蒸腾速率及细胞间隙CO2浓度与净光合速率相关性比较可见,红叶树种和绿叶树种之间不存在显著的差异,说明红、绿叶树种净光合速率和光合“午休”持续时间的差异并不是由气孔导度、蒸腾速率及细胞间隙CO2的差异引起,而可能是不同树种叶片对光能的吸收和对过剩光能的耗散差异造成的。
叶绿素荧光是研究植物光合作用的一个敏感的探针。为进一步探索自然条件下红、绿叶树种净光合速率日变化的差异,测定了自然条件下各树种叶绿素荧光参数的日变化。Fv/Fm日变化表明,各树种一天中均受到不同程度的光抑制,但红、绿叶树种光抑制程度差异不显著,这与Burger等(1996)在Coleus属中的研究结果一致。另外,绿叶树种的实际光化学效率ΦPSII、光化学猝灭系数qP均高于红叶树种,但红叶树种非光化学猝灭系数NPQ较绿叶树种高,即红叶树种耗散过剩光能的能力高于绿叶树种,可以通过非光化学猝灭安全耗散过剩光能来保护光合机构,因此,这可能是红叶树种光合“午休”持续时间较短的原因。
花青苷在叶片中的分布一方面可以通过遮光保护叶绿体,另一方面可以耗散光能,使光合机构免受过剩光能的破坏(Chalker-Scott, 1999; Thomas, 1997; Pietrini et al., 2002),因此,本试验中红叶树种叶片对光能的吸收高于绿叶树种,但两者所受到的光抑制程度却无显著差异,并且红叶树种光合“午休”持续时间较绿叶树种短。另外,花青苷与SOD、APX等起保护作用的酶存在高度的相关性,是天然的抗氧化剂(Farquhar et al., 1982; Samuel et al., 2003; Aysel et al., 2004),因而,可以清除因高光强、高温条件引起的活性氧伤害,对PSⅡ反应中心起到保护作用,这可能是红叶树种非光化学猝灭较绿叶树种高的原因之一。
本研究表明,红叶树种叶片中的花青苷对其净光合速率、光合“午休”持续时间以及叶绿素荧光参数均存在一定的影响,进一步了解花青苷在植物体内所起的生理生化作用,有助于揭示花青苷影响植物光合作用的机制,值得进行深入研究。
蔡永萍, 李玲, 李合生, 等. 2004. 霍山石斛叶片光合速率和叶绿素荧光参数的日变化. 园艺学报, 31(6): 778-783. DOI:10.3321/j.issn:0513-353X.2004.06.015 |
董高峰, 陈贻竹, 蒋跃明. 1999. 植物叶黄素循环与非辐射能量耗散. 植物生理学通讯, 35(2): 141-142. |
胡位荣, 张昭其, 季作梁, 等. 2004. 酸处理对采后荔枝果皮色泽与生理活性的影响. 食品科学, 25(7): 176. DOI:10.3321/j.issn:1002-6630.2004.07.042 |
李志, 冯玉龙. 2004. 砂仁不同叶位叶片的光合作用和氧化胁迫. 植物生理与分子生物学学报, 30(5): 546-552. |
齐欣, 曹坤芳, 冯玉龙. 2004. 热带雨林蒲桃属3个树种的幼苗光合作用对生长光强的适应. 植物生态学报, 28(1): 31-38. DOI:10.3321/j.issn:1005-264X.2004.01.005 |
仝月澳, 周厚基. 1982. 果树营养诊断法. 北京: 农业出版社, 112-115.
|
姚砚武, 周连第, 李淑英, 等. 2000. 美国红栌光合作用季节性变化的研究. 北京农业科学, 18(5): 32-34. |
庄猛, 姜卫兵, 马瑞娟, 等. 2005. Rutgers桃(红叶)与白芒蟠桃(绿叶)光合生理特性比较. 南京农业大学学报, 28(4): 26-29. |
Aysel Sývacý, Münevver Sökmen. 2004. Seasonal changes in antioxidant activity, total phenolic and anthocyanin constituent of the stems of two Morus species (Morus alba L. and Morus nigra L.). Plant Growth Regulation, 44: 251-256. DOI:10.1007/s10725-004-4500-4 |
Burger J, Edwards G E. 1996. Photosynthetic efficiency, and photodamage by UV and visible radiation, in red versus green leaf Coleus varieties. Plant Cell Physiology, 37: 395-399. DOI:10.1093/oxfordjournals.pcp.a028959 |
Chalker-Scott L. 1999. Environmental significance of anthocyanins in plant stress responses. Photochem Photobiol, 70: 1-9. DOI:10.1111/j.1751-1097.1999.tb01944.x |
Demming B, Björkman O. 1987. Comparison of the effect of excessive light on chlorophyll fluorescence (77K) and photon yield of O2 evolution in leaves of higher plants. Planta, 172: 171-184. |
Farquhar G D, Sharkey T D. 1982. Stomatal conductance and photosynthesis. Ann Rev Plant Physiol, 33: 317. DOI:10.1146/annurev.pp.33.060182.001533 |
Lichtenthaler H K, Wellburn A R. 1983. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents. Biochem Soc T, 11: 591-592. DOI:10.1042/bst0110591 |
Pietrini F, Iannelli M A, Massacci A. 2002. Anthocyanin accumulation in the illuminated surface of maize leaves enhances protection from photo-inhibitory risks at low temperature, without further limitation to photosynthesis. Plant, Cell and Environment, 25: 1251-1259. DOI:10.1046/j.1365-3040.2002.00917.x |
Samuel O, Gould S. 2003. Anthocyanins in leaves: light attenuators or antioxidants?. Functional Plant Biology, 30(8): 865-873. DOI:10.1071/FP03118 |
Thomas H. 1997. Chlorophyll: a symptom and a regulator of plastid development. New Phytol, 136: 163-181. DOI:10.1046/j.1469-8137.1997.00737.x |
 2007, Vol. 43
2007, Vol. 43