文章信息
- 管道平, 刘文科, 杨其长, 巫国栋, 魏强.
- Guan Daoping, Liu Wenke, Yang Qichang, Wu Guodong, Wei Qiang.
- 植物光自养培养箱CO2自动调控系统的设计与试验
- Design and Test of Auto-Controlling System in Cultural Vessels for Plant Photoautotrophic Micropropagation
- 林业科学, 2007, 43(5): 116-119.
- Scientia Silvae Sinicae, 2007, 43(5): 116-119.
-
文章历史
- 收稿日期:2006-03-22
-
作者相关文章
目前,有关在光自养微繁技术中采用大型容器培养组培苗已成为国内外研究的热点,报道的培养容器的体积已达120~170 L(Xiao et al., 2004;丁永前等,2002;肖玉兰等,2001)。由于采用了大型容器培养,植株的栽培密度显著增加,为了提高组培苗生长和发育的一致性,必须保证培养容器内环境条件的一致。CO2是光自养微繁系统中唯一的碳源,培养容器内的CO2浓度是否均一是限制植物生长一致性的重要因子。国内外植物光自养微繁试验和生产中大多采用强制性通风换气的方法增施CO2,但是,如果仅仅进行强制性通风,在进气口和排气口之间CO2浓度存在着显著差异,导致容器内培养的植株生长极为不一致(Wilson et al., 2001;蔡能等,2003)。其主要原因为仅仅采用强制通风措施不能实现容器内环境条件的均匀。关于大型组培箱设计与环境控制系统的研究已有些报道,但控制效果差异很大(丁永前等,2002;Wilson et al., 2001;李传业等,2004)。为此本研究设计了一套基于脉冲宽度调制(pulse width module,PWM)控制技术的CO2环境自动调控系统,该系统控制精度高、造价低、可控性强。
1 系统结构系统由硬件和软件两部分组成, 系统的主要硬件包括培养容器、传感器、气源组件、PWM控制器、电磁阀、稳流阀和计算机等(图 1)。培养容器是光自养组培苗生长的场所;PWM控制器是可编程序的单片机,能够完成数据采集、处理和发出控制指令等功能。气源组件包括CO2液化气钢瓶、减压阀、稳压稳流装置、输气管和流量控制器。CO2控制与光照互锁启动。
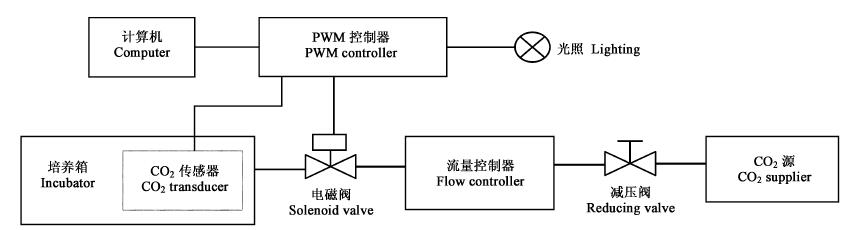
|
图 1 控制系统结构示意图 Fig. 1 Schematics of the control system structure |
PWM控制是通过对一系列脉冲的宽度进行调制来等效地获得所需要的波形(含形状和幅值)。其原理是:在每一个采样周期内,计算机将控制量的设定值与检测到的控制量进行比较,按照设计的控制软件,经判断、计算,采用PWM信号作为开关阀的驱动信号。如果两者不相等, 就产生了偏差;偏差大, 脉冲宽度很宽, 执行元件动作时间长, 使参数的实测值与设定值的偏差迅速减小;偏差小, 脉冲宽度变窄, 执行元件动作时间短, 直到设定值与实测值相等, 达到自动控制参数的目的。即用一定周期的脉冲信号驱动开关阀,用控制信号控制开关阀的开启时间。
本系统PWM控制器连接CO2传感器,并将检测到被控环境的电信号转变为数字信号,通过嵌在监控器表面的液晶显示器显示当前检测环境的CO2浓度,实现在线检测。PWM控制器通过通讯接口(RS-485)和上位计算机通讯,该控制器既具有自我诊断的功能,又可直接接受上位计算机的信号指令。计算机控制系统的控制程序采用VB语言编制,检测记录可利用Office软件进行数据处理。
1.2 无糖培养容器本研究设计了无糖培养容器(图 2),其主要特征:材质采用透光率高的进口有机玻璃。容器壁厚为1.0 cm,容器尺寸为1 200 mm×500 mm×300 mm,体积达到180 L。容器内安装了采用有机玻璃管制作的CO2释放管;CO2释放装置的设计可以保证CO2在箱体内迅速均匀地分布于培养箱的空间内,减少扩散引起的滞后,提高CO2浓度控制的精度。管的直径为1 cm,长度为1.25 m。安装时一端露出3 cm,连接气源,为进气口;另一端封闭后安装在箱体的内嵌小槽中固定。有机玻璃管的侧面打2排孔,孔径为0.5 mm,按开孔垂直方向两排孔面间呈120°夹角,孔间距离为2 cm。培养箱采用自然通风换气的方式。
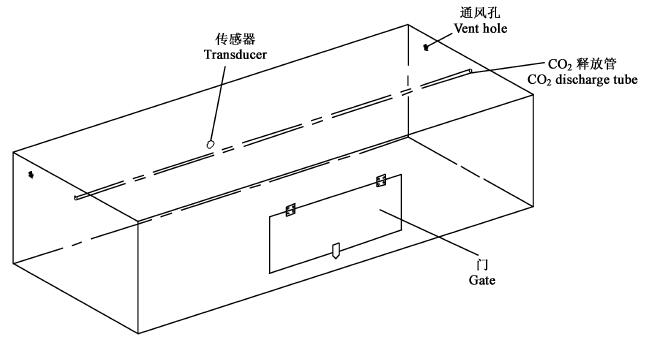
|
图 2 培养容器示意图 Fig. 2 The sketch of the cultural vessel |
由于培养容器的体积相对较小,作为气源的CO2液化气钢瓶内CO2压力较高,在实际控制中,首先通过减压阀把CO2液化气钢瓶内的CO2压力从8.0 MPa降低到0.15 MPa,再通过稳压稳流装置使CO2输送的速度降低到10 mL·s-1左右。控制系统的基本思想是利用单片机具有的PWM端口,在不改变PWM控制周期的前提下,通过PWM信号来控制向培养容器内输入一定量CO2时电磁阀开启所需要的时间。即当系统中的CO2传感器检测到培养容器中的CO2浓度不符合设定标准时,PWM控制器通过比较实测值与目标值之间的差距,根据比例参数来计算出电磁阀的开启时间, 进行间接控制。在程序中设定以50 s为一个控制周期。同时,CO2增施与光照互锁启动。计算公式如下:t=CP×(CS-Cx)×Cd, 式中:t为电磁阀导通时间,CS为CO2目标设定值,Cx为CO2测定值,CP为比例参数,Cd为CO2流速系数。当t≥50 s时, 表示在一个控制周期内, 电磁阀导通时间为全开;当t<50 s时, 表示在一个控制周期内, 电磁阀导通时间为t秒。
本系统所使用的CO2传感器为芬兰产的Vaisala-GMW22D型,检测精度为±30 μmol·mol-1,测量范围为0~5 000 μmol·mol-1。
3 系统的控制性能试验为了评价系统的性能,利用所设计的控制系统,进行无糖培养箱内CO2浓度变化的调控试验。研究圆叶海棠(Malus prunifolia var. ringo)组培苗在高CO2浓度环境下的生长发育以及光自养能力,并在试验过程中测试控制系统不同比例控制系数(CP:0.1、0.2、0.3)对培养箱内CO2浓度(目标值为1 500 μmol·mol-1)的控制效果。选择生长健康、叶色较浓绿的圆叶海棠组培苗(高度2.5 cm左右),在MS培养基中用1 mg·L-1 IBA诱导,3 d后转接到无激素无糖1/2MS培养基上。培养容器为带有2个透气膜的方盒,容积为445 mL。培养支持物选择多孔的无机基质蛭石。每个处理20瓶,每瓶装入培养基45 mL,每瓶接种2株试验苗。圆叶海棠组培苗诱导生根3 d后,将其转接到无激素有糖1/2MS培养基上进行常规组织培养,作为试验对照。培养25 d后观察测量各项指标,重复3次。
环境的控制参数为:温度25 ℃左右,相对湿度65%左右,光照强度62.5 μmol·m-2 s-1(在空的培养架上测量),光照时间8:00—22:00,无糖培养箱内的CO2浓度1 500 μmol·mol-1左右,CO2增施与光照互锁启动。
4 结果与分析测试表明:该系统可以用于无糖培养容器内CO2浓度的环境控制。本系统运行稳定、操作简单;控制过程中,能够根据植物组培苗生长的变化,把培养容器内CO2浓度控制在设定的范围内,且控制精度较高。如图 3所示,在不同比例参数条件下,该控制系统对培养箱内CO2浓度的控制效果表现出一定的差异性:当比例参数CP为0.1时,培养箱内CO2浓度最大值为1 461 μmol·mol-1,达不到培养箱目标值1 500 μmol·mol-1的要求;当比例参数CP为0.3时,培养箱内CO2浓度最大值为1 570 μmol·mol-1,最小值为1 429 μmol·mol-1,虽然达到了培养箱控制目标值,但培养箱CO2浓度变化幅度大,达不到精确控制的目的;当比例参数CP为0.2时,培养箱内CO2浓度最大值为1 529 μmol·mol-1,最小值为1 465 μmol· mol-1,实现了较为理想的控制效果。当达到动态平衡时,CO2浓度会随着植物组培苗的消耗和培养箱通风状况,呈现一定的波动性。但CO2浓度控制存在着一定的误差,该误差主要是由于CO2传感器的检测精度、传感器的稳定性和信号的传送滞后引起的。
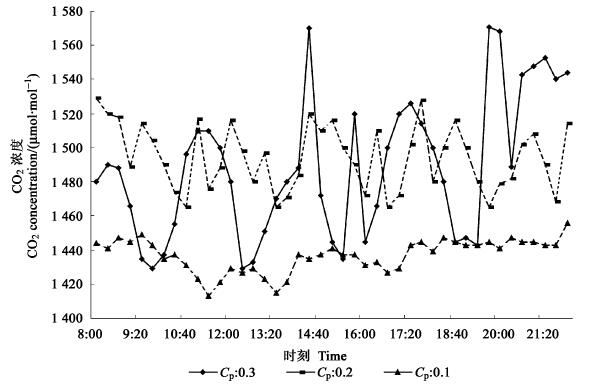
|
图 3 CO2浓度目标值为1 500 μmol·mol-1时培养箱CO2浓度变化 Fig. 3 Change of CO2 concentration under 1 500 μmol·mol-1 destination in the cultural vessel |
试验证明:通过对比例参数的设定,PWM控制方法可以实现对环境CO2浓度的控制。同时,可以根据培养容器的大小、环境通风量的状况以及培养植株对CO2浓度的要求,及时地调整比例参数来实现对CO2浓度较为精确的控制,操作非常简单。
从表 1可以看出,与有糖培养相比,无糖培养促进了组培苗的生长发育。主要表现在:植株根系发达,植株的光合作用、调节气孔开闭和控制蒸腾速率等方面能力显著提高。而对照组的组培苗根条数少,叶绿素含量低,光合作用弱,气孔调节能力较差, 水分散失快,其气孔导度和蒸腾速率分别为0.262 mol·m-2s-1和3.86 mmol·m-2s-1,显著高于无糖培养处理。增加光照强度和提高CO2浓度,改善了圆叶海棠组培苗生长的环境条件;无糖培养提高了圆叶海棠组培苗光自养能力和对环境的适应能力。
|
|
通过对培养容器的改进,使操作更容易;同时,更大的垂直空间,提高了培养箱气体浓度的缓冲性能;CO2释放装置的设计与安装,为提高CO2释放时的控制精度创造了条件,实现了较为理想的控制效果,系统稳定性高。
本系统以PWM控制方式为核心,实现了对培养容器内CO2的动态控制。该控制方案属于开关控制范畴,实现非常简单, 控制作用通过一个开关的操作就能实现, 这样就不需要线性的执行器, 减小了执行器的体积, 大大地提高了系统的可靠性, 也降低了系统的复杂性。另外, PWM控制对干扰的灵敏度也比较低。在执行机构的自身功耗、与计算机接口的方便性等方面, 也具有明显的优势。
与常规组织培养相比,光自养微繁技术改革了传统的用糖作为碳营养和培养瓶作为培养空间的技术方法,增加了植物生长和生化反应所需要的物质流的交换和循环,促进了植株的生长和发育,实现了组培苗的优质生产。
蔡能, 易自力, 李祥. 2003. 改善植物大规模组织培养条件的研究进展. 植物学通报, 20(6): 745-751. DOI:10.3969/j.issn.1674-3466.2003.06.015 |
丁永前, 丁为民, 崔瑾, 等. 2002. 组培环境CO-2增施监控系统的设计与试验. 农业工程学报, 18(1): 96-98. DOI:10.3321/j.issn:1002-6819.2002.01.025 |
李传业, 滕光辉, 曲英华. 2004. 基于PLC的无糖组培微环境控制系统. 中国农业大学学报, 9(4): 30-34. DOI:10.3321/j.issn:1007-4333.2004.04.007 |
肖玉兰, 钱彪, 和树庄, 等.2001.植物光独立培养微繁殖培养箱: 中国, 00223771.7[P]. 2001-05-16
|
Xiao Y, Kozai T. 2004. Commercial application of a photoautotrophic micropropagation system using large vessels with forced ventilation. HortScience, 39(6): 1387-1391. DOI:10.21273/HORTSCI.39.6.1387 |
Wilson S B, Heo J, Kubota C, et al. 2001. A forced ventilation micropropagation system for photoautotrophic production of sweet potato plug plantlets in a scaled-up culture vessel Ⅱ: Carbohydrate status. HortTech, 11: 95-99. |
 2007, Vol. 43
2007, Vol. 43


