文章信息
- 陈介南, 王义强, 何钢, 章怀云, 周再魁.
- Chen Jienan, Wang Yiqiang, He Gang, Zhang Huaiyun, Zhou Zaikui.
- 木质纤维生产燃料乙醇的生物转化技术
- Bioconversion of Lignocellulose to Ethanol
- 林业科学, 2007, 43(5): 99-105.
- Scientia Silvae Sinicae, 2007, 43(5): 99-105.
-
文章历史
- 收稿日期:2006-08-08
-
作者相关文章
生物乙醇(bioethanol)是一种最易普及的生物燃料(相较于生物柴油和燃料电池),凭借其经济、环保、实用等多维优势而日益成为替代汽油等传统能源的新能源之星。迅速普及的汽油醇(10%乙醇、90%汽油)以酒精作为助燃/抗爆剂直接取代MTBE (methyl tertiary butyl ether)。世界各主要汽车制造商都能生产以乙醇汽油(乙醇含量达85%)为燃料的汽车(如美国),甚至飞机也可以使用乙醇燃料(如巴西)。目前全世界超过90%的乙醇来自生物质,但多以粮食[如玉米(Zea mays)、小麦(Triticum aestivum)、高粱(Sorghum vulgare)]和糖类作物[如甘蔗(Saccharum officinarum)、甜菜(Beta vulgaris)]为原料(Badger, 2002)。
木质纤维是地球上数量最大的一种可再生资源。据估算,如果发展能源林业与回收利用废弃木质纤维(可回收部分约占总量的1/3)并举,则每年可保障替代1/3以上运输燃料的酒精产量。为此,发展经济有效而环境友好的木质纤维生物转化乙醇技术,已成为世界生物能源科技发展的战略制高点。
美国等国家已开始将生物能源研究和开发的战略重心转移到以木质纤维生产乙醇的方向。针对我国国情,发展以木质纤维生物转化乙醇为重点的生物能源技术,建立以能源林业为依托并综合利用大量农业废弃物(如秸秆、皮壳等)(Kim et al., 2004)、林业残余物(如锯木屑、刨花、木材和造纸工业废料等)、城乡垃圾和杂草等低成本木质纤维资源的原料保障模式,可以避免以粮食为原料所带来的“与农争地"和“与人争食"的弊端,兼得经济、生态、环保、社会多重效益,是全面协调可持续发展的必然要求。
木质纤维(lignocellulose)主要由纤维素(cellulose)(约占1/3~1/2)、半纤维素(hemicellulose)(约占1/4~1/3)和木质素(lignin)(约占1/5~1/4)组成。纤维素和半纤维素经过糖化和发酵转化为乙醇(ethanol),而木质素的降解物不含可发酵糖,只能通过燃烧供热(或发电)或化学转化为燃料添加剂(或其他生物制品或工业原料)加以综合利用(图 1)。
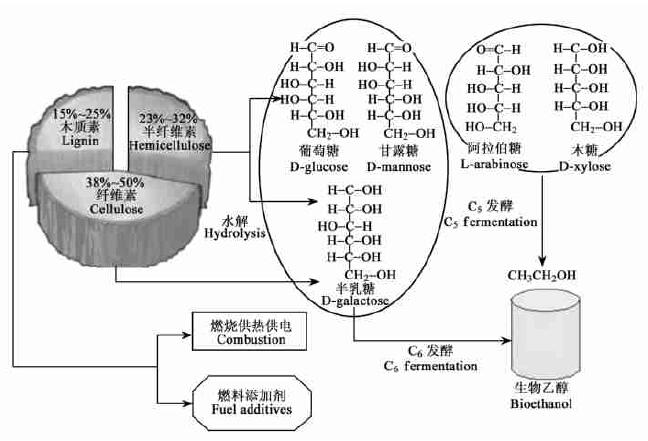
|
图 1 木质纤维原料的构成及其利用 Fig. 1 Structure and use of lignocellulose material |
木质纤维原料的糖化液中所含的可发酵糖(fermentable sugars)通常包括源于纤维素的葡萄糖(D-glucose)、甘露糖(D-mannose)和半乳糖(D-galactose)等6碳(C6)糖,以及源于半纤维素的木糖(D-xylose)和阿拉伯糖(L-arabinose)等5碳(C5)糖。普通微生物(如酵母)只能发酵C6糖,对C5缺乏代谢能力,而且易受降解产物的抑制。
木质纤维原料的理化特性决定了其具有不同于淀粉(如玉米、高粱)和糖类(如甘蔗、甜菜)原料转化的难度和复杂性,因此木质纤维生物转化是复杂且存在许多不确定因素的动态过程(Lin et al., 2006)。将木质纤维原料经济有效地转化成乙醇和其他生物产品,取决于许多因素。本文试图以国际(特别是美国)的研究和开发进展为背景,探讨木质纤维生物转化乙醇的几个富有挑战性的技术问题,特别是预处理、酶活性、C6/C5糖共发酵、木质素的综合利用和工艺优化。
1 经济有效的快速预处理技术木质纤维材料中的可糖化纤维素和半纤维素在木质素包裹下形成稳定的结构,很难被直接水解或酶解。纤维素由糖分子的极性基团(-OH groups)通过氢键(hydrogen bonds)相连成长链,在木质素的包裹下形成坚固而稳定的晶体结构,在普通条件下不易被水解或稀酸(稀碱)糖化,酶解糖化是最为经济有效而环境友好的途径。半纤维素分子和纤维素类似,也是由糖分子构成长链,但其非晶体(随机、不规则)结构比较脆弱,不像纤维素那样强稳,很容易在稀酸(或稀碱)预处理中被糖化。木质素在植物体中起结构强化和支撑作用,也是植物抵御病菌侵袭的物理障碍,不容易被微生物降解,特别是在缺氧条件下。富氧条件下木质素的生物降解也相当缓慢(需要许多天),难以达到工业规模生产的要求。木质纤维原料通常需要适当的预处理(pretreatment)来破除木质纤维的晶体结构及木质素对纤维素和半纤维素的包裹,增加供酶接触的有效表面积(Grethelin, 1985),并消除对微生物有危害的毒性物质,以利生物降解(Gharpuray et al., 1983)。
预处理方法可以是物理的、化学的、生物的,也可以取其交合运用,常用的如表 1所示。在选择预处理方法时,要考虑木质纤维原料的特点、经济和环保性能要求,以及整体工艺设计,避免盲目性。根据文献,最为看好的是蒸爆(steam explosion)、酸解(acidic hydrolysis)和碱湿氧化(alkaline wet oxidation)。
|
|
木质纤维含有半纤维素,其糖化不仅产生C6糖(D-glucose及其异构体),而且有C5糖(D-xylose和L-arabinose)。由于普通酵母(yeasts)只能发酵C6,对C5缺乏代谢能力,而且易受降解产物的抑制,半纤维素的利用在相当长的时期被忽视,直接影响了木质纤维原料生物转化乙醇的经济效益。尚无天然微生物能够将木质纤维糖化液中的C6和C5糖同时快速有效地转化为乙醇(Ingram et al., 1995),尽管一些微生物(如Neurospora crassa)能够将纤维素和半纤维素直接转化成乙醇(Deshpande et al., 1986;Phadtare et al., 1997)。因此,开发出能对C6和C5糖进行快速、完全、同步发酵并且抗逆性强的工程菌株(strains)成为当务之急。
通过遗传重组来解决C6/C5糖共发酵难题已在一些微生物中获得部分成功,如常见的Saccharomyces cerevisiae(Johansson et al., 2001)、Zymomonas mobilis(Sprenger, 1993)和Escherichia coli(Burchardt et al., 1992;Dien et al., 2003;Zhou et al., 1999)。这些是研究和应用基础相对较好的,也是最成功的重组平台(Zaldivar et al., 2001)。重组S. cerevisiae发酵路径遇到的一个棘手问题是C5(如L-arabinose)转运(transport)不好,使发酵达不到理想效果。目前美国能源部的国家可再生能源实验室(NREL)已经在攻克这一难题。
美国佛罗里达大学的Ingram教授领导的实验室于20世纪80年代就尝试了以外源基因补充(或改进)受体微生物的发酵代谢途径(Ingram et al., 1987)。他们将Zymomonas mobilis的C6发酵基因转入具备C5发酵途径的Escherichia coli,除了成功使大肠杆菌获得在富氧(aerobic)和缺氧(anaerobic)条件下发酵pyruvate的功能外,这个由lactose启动子(promoter)加pyruvate decarboxylase(pdc)和alcohol dehydrogenase(adh)基因串联组合的操作元(operon)还使pyruvate的代谢具有向发酵ethanol方向倾斜的选择性,并使微生物生长明显优于对照。这一操作元在Clostridium cellulolyticum中也得到较好的表达(Guedon et al., 2002; Jennert et al., 2000)。
相对于酵母发酵(以小时计)来说,细菌(bacteria)发酵有速度快(以分钟计)的优势(Badger, 2002)。NREL资助的研究(Zhang et al., 1998)成功地把C5糖代谢所需的7个外源酶基因(包括araBAD Operon,Lee et al., 1986)以3个操作元串联在一个质粒载体(vector)转入Zymomonas mobilis并获得了80%~90%的C6/C5共转化率。从遗传重组的Zymomonas mobilis表型分析可以推导,这3个操作元(Pgap-xylA/xylB,Pgap-araBAD和Peno-tal/tkt)通过ED途径(entner-doudoroff pathway)(Conway, 1992)与内源控制pyruvate发酵的操作元(Plac-pdc/adh)(Ingram et al., 1987)并联成完整的C6/C5发酵代谢体系(图 2)。ED途径是glucose→pyruvate的3个已知代谢途径中(其他是glycolysis和pentose phosphate pathway)较简单而有效的一个。
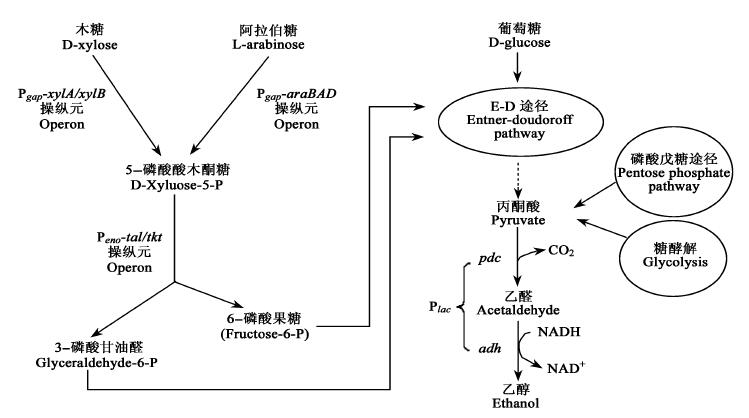
|
图 2 木质纤维生物转化乙醇中C6/C5共发酵的可能代谢途径 Fig. 2 Probable pathway for C6/C5 cofermentation of lignocellulose to ethanol Pgap: glyceraldehyde-3-phosphate dehydrogenase promoter; xylA: xylose isomerase; xylB: xylulokinase; araA: L-arabinose isomerase; araB: L-ribulokinase; araD: L-ribulose-5-P4-epimerase; Peno: an enolase promoter; tal: transaldolase; tkt: transketolase (Zhang et al., 1998); Plac: lactose promoter; pdc: pyruvate decarboxylase; adh: alcohol dehydrogenase (Ingram et al., 1991). |
木质纤维的生物降解是由一系列纤维素酶、半纤维素酶和木质素酶组成的复杂系统来执行的。一般纤维素酶生产菌也生产半纤维素酶(及或多或少的木质素酶)(如Phanerochaet echrysosporium)(Broda et al., 1994)。因木质素不含可发酵糖,其降解是个综合利用的问题,不是糖化的目标。在工业规模的木质纤维生物转化中,大部分半纤维素在预处理阶段就被糖化,而且许多纤维素酶对半纤维素也有活性,故纤维素才是酶解/糖化阶段的重点对象。纤维素酶按存在状态可分为自由酶(free或noncomplexed)和络合酶(complexed,即cellulosomes)系统。好氧真菌(最著名的是Trichoderma reesei)和好氧细菌(如Cellulomonas和Thermobifida)一般产生自由纤维素酶,而络合纤维素酶系统则主要源于厌氧细菌(如Clostridium和Ruminococcus)和少数厌氧真菌(如Piromyces)。
一个纤维素酶系统按作用方式可大致分为:内切葡萄糖苷酶(endoglucanases)(EC 3.2.1.4);外切葡萄糖苷酶(exoglucanases),包括cellodextrinases (EC 3.2.1.74)和cellobiohydrolases(EC 3.2.1.91)和(外切型)葡萄单糖酶(β-glucosidases)(EC 3.2.1.21)(图 3)。
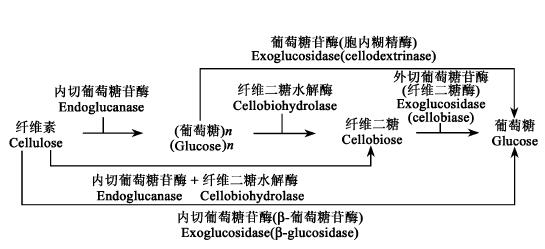
|
图 3 纤维素酶降解系统 Fig. 3 Biodegradation of lignocellulose |
纤维素酶成本的居高难下始终是一个困扰木质纤维生物转化乙醇技术产业化的主要障碍之一(McAloon et al., 2000)。遗传重组技术不仅用于控制(或调节)发酵代谢途径(metabolic pathway)(Ingram et al., 1998),而且也是纤维素酶优化(增强活性)的一个重要技术手段(Hogsett et al., 1992)。
应用遗传重组技术开发优质纤维素酶、半纤维素酶和木质素酶工程菌,高活性纤维素酶酵母工程菌和产朊假丝酵母工程菌等GEM材料已取得显著成绩,包括将纤维素酶编码序列克隆到细菌、酵母、霉菌和植物中,以产生新的更优质纤维素酶(Lynd et al., 2002)。一个重要进展是细胞表面工程技术(Murai et al., 1998),即在酵母细胞表层蛋白(α-凝聚素等)基因上植入纤维素酶等基因,使菌体和酵素在反应器内始终保持高浓度,持续反复利用,从而降低成本,提高糖化效率。
归纳起来,微生物酶工程技术策略可分为:1)选用抗逆高产工程菌(如NREL/GENENCOR采用嗜热耐酸性的Acidothermus cellulolyticus),改进纤维素酶的就地生产(on-site production)(Thygesen et al., 2003);2)用异源纤维素酶(如源于bacteria, fungi, and plants)重组更有效的纤维素酶系统(例如,在最常用的Trichoderma reesei纤维素酶系统的基础上添加Aspergillus的β-glucosidases,从而克服glucose的抑制)(Gunata et al., 1999; Yan et al., 1997); 3)将外源纤维素酶基因转入优质发酵工程菌(如Saccharomyces cerevisiae或Zymomonas mobilis),使之至少能供应木质纤维直接转化乙醇所需的部分纤维素酶(Panttilä et al., 2004;Zhou et al., 1999); 4)将外源发酵基因转入纤维素酶生产菌(如Trichoderma reesei和Clostridium cellulolyticum),实现酶解和发酵工程菌的一体化(Guedon et al., 2002);5)运用代谢工程策略增加欲求的(gene transfer)、强化有利的(gene overexpression)和排除(或弱化)不利的(gene suppression/gene knockout)(Kamionka et al., 2005)代谢途径(Lynd et al., 2002)。
此外,应用纳米技术进行分子设计,可以“对号入座",制造与纤维素酶结构和功能类似的纳米催化剂,获得新的或更加稳定转化的催化途径,并实现催化剂的固定重复循环使用。同时,通过纳米传感器和无线网络对酶解/发酵过程进行智能化在线监控,可以实时精确地优化动态反应条件,提高酶解/发酵效率。
4 环境友好的综合利用技术木质素不含糖,目前还没有发现将其转化为乙醇的有效方法,其主要用途是燃烧发电或供热。开发高附加值的木质素综合利用技术,通过增加收益来降低(抵消一部分)木质纤维生物转化乙醇的生产成本,是使经济和环保相得益彰的必然选择。由木质素生产高octane的燃料添加剂(Ragauskas et al., 2006; Shabtai et al., 1999)技术已取得进展,将纤维素(和半纤维素)直接化学转化为高附加值产品(特别是燃料成份)的技术也在探索中(Miller et al., 1999; Huber et al., 2005; Ragauskas et al., 2006; Rostrup-Nielsen, 2005),对促进木质纤维资源综合有效利用及提高生物乙醇技术的市场竟争力将大有助益。如图 4所示,木质纤维原料可以生成多种高附加值的主产品和副产品(包括燃料添加剂、生物塑料、化学品等)。
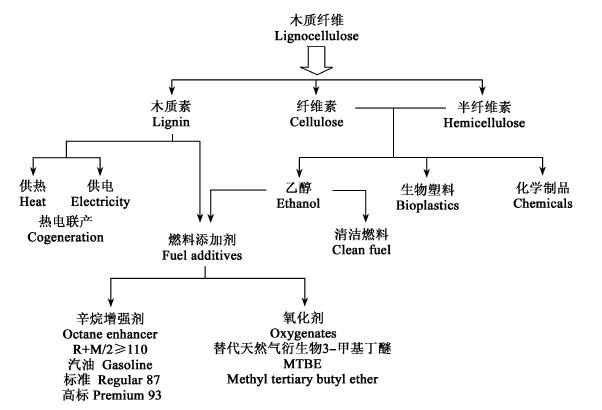
|
图 4 木质纤维的综合利用 Fig. 4 Lignocellulose utilization |
尽管酒精燃烧时产生的热能比汽油低(酒精为22.1 MJ·L-1、汽油为34.3 MJ·L-1(Nordin, 1994),但酒精的辛烷值比汽油高许多,是抗爆剂,又是助燃剂,所以用汽油醇作燃料不用再添加四乙基铅或MTBE,就可成为高标号燃料油,可减少空气中铅的污染。
5 木质纤维生物转化乙醇工艺的优化木质纤维生物转化乙醇技术的发展是一个渐进的过程。最初是从化学转化演变而来,即用酶解替代酸解,再进行发酵,即所谓的分步糖化发酵(saccharification and fermentation,简称SF)法(Wilke et al., 1976)。SF法存在纤维素酶受葡萄糖(glucose)和纤维二糖(cellobiose)终产物抑制,酶解效果差、酶制剂用量大的弊端。因此,同步糖化发酵(simultaneous saccharification and fermentation,简称SSF)法(Gauss et al., 1976)便应运而生。SSF法使水解(hydrolysis)与发酵(fermentation)两步合一,消除了SF法的弊端,提高了糖化效率。
随着遗传重组微生物技术的应用(Ingram et al., 1991; Zhang et al., 1998),以前无法实现的C6/C5糖共发酵成为可能。目前相对比较成熟的是美国能源部的国家可再生能源实验室(NREL)推荐的同步糖化共发酵(simultaneous saccharification and cofermentation,简称SSCF)法。SSCF法把源于半纤维素的木糖等C5糖和源于纤维素的葡萄糖等C6糖一道转化成乙醇,从而提高了转化效率,降低了生产成本。在NREL Model的应用中,通常用稀酸(≤1% H2SO4)进行预处理,然后浆液的一小部分供送生产纤维素酶的微生物培养罐, 其余流向发酵罐, 同时加入纤维素酶和发酵微生物,实现同步糖化共发酵。
通常绝大部分半纤维素在预处理过程中便被糖化,所释放的C5糖易损失,需要及时发酵。图 5是基于SSCF概念(NREL Model)改进的并行糖化共发酵生产模型(工艺流程)。主要是优化预处理,将预处理释放的C5糖化液并联发酵,以及对预处理后的残留物(主要含纤维素和木质素及少量半纤维素)进行同步糖化共发酵。
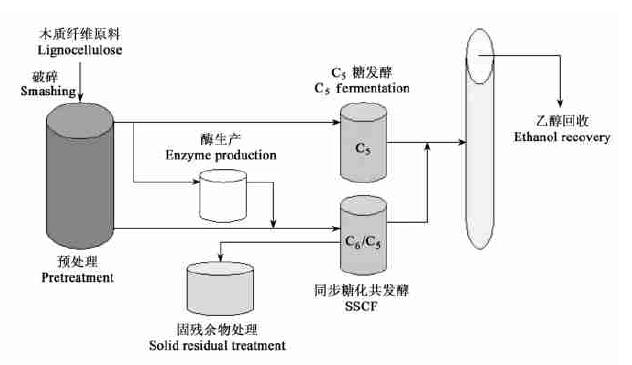
|
图 5 木质纤维生物转化乙醇的并行糖化共发酵生产流程 Fig. 5 Optimized SSCF process for bioconversion of lignocellulose to ethanol consolidated from NREL model and its various industrial modifications |
木质纤维生物转化乙醇是个动态发展、不断完善的技术。技术进步的核心方向(或最终目的)是要降低生产成本,提高生物乙醇的市场(价格)竞争力。基本策略是生物的(如工程菌和纤维素酶)和工艺的(如预处理,综合利用,和系统集成)优化并举,特别是生物的改进尚有较大的空间,而纤维素酶活性的提高是关键。优质高产抗逆C6/C5共发酵工程菌和产酶工程菌的开发所取得的进展,为木质纤维生物转化乙醇技术奠定了发展基础。就工艺而言,本文根据美国能源部可再生能源实验室(NREL)所推荐的SSCF Model进行概念性改进,提出了并行糖化共发酵生产模型。目前类似的生物转化模型已接近产业化(实用)阶段,但其运行成本和效率取决于多方面因素,应该避免盲目地照搬硬套。不过,可以谨慎乐观地预期,随着汽油价格的飙升和生产成本的下降,木质纤维生物转化乙醇技术将越来越显现其生命力和市场竞争力。
Badger P C. 2002. Ethanol from cellulose: a general review//Janick J, Whipkey A. Trends in New Crops and New Uses. ASHS Press, Alexandria, VA, 17-21
|
Basaglia M, Concheri G, Cardinali S, et al. 1992. Enhanced degradation of ammonium-pretreated wheat straw by lignocellulolytic Streptomyces spp. Canadian Journal of Micorbiology, 38(10): 1022-1025. DOI:10.1139/m92-168 |
Broda P, Birch P, Brooks P, et al. 1994. Phanerochaete chrysosporium and its natural substrate. FEMS Microbiol Rev, 13: 189-196. DOI:10.1111/j.1574-6976.1994.tb00042.x |
Burchardt G, Ingram L O. 1992. Conversion of xylan to ethanol by ethanologenic strains of Escherichia coli and Klebsiella oxytoca. Appl Environ Microbiol, 58: 1128-1133. |
Conway T. 1992. The entner-doudoroff pathway: history, physiology and molecular biology. FEMS Microbiol Rev, 9(1): 1-27. |
Crawford D L. 1986. The role of actinomycetes in the decomposition of lignocellulose. FEMS Symp, 34: 715-728. |
Deshpande V, Keskar S, Mishra C, et al. 1986. Direct conversion of cellulose/hemicellulose to ethanol by Neurospora crassa. Enzyme Microb Technol, 8: 149-152. DOI:10.1016/0141-0229(86)90103-1 |
Dien B S, Iten L B, Nichols N N, et al. 2003. Conversion of lignocellulose to ethanol using a recombinant E. coli strain. Society of Industrial Microbiology: 102. |
Foody P. 1980. Optimization of steam explosion pretreatment. Final Report to DOE, Contract AC02-79ET23050
|
Gauss W F, Suzuki S, Takagi M. 1976. Manufacture of alcohol from cellulosic materials using plural ferments. United States Patent 3, 990, 944, November 9
|
Gharpuray M M, Lee Y H, Fan L T. 1983. Structural modification of lignocellulosics by pretreatments to enhance enzymatic hydrolysis. Biotechnology and Bioengineering, 25(11): 157-172. |
Grethelin H E. 1985. The effect of pore size distribution on the rate of enzymatic hydrolysis of cellulosic substrates. Bio/Technology, 3: 155-160. DOI:10.1038/nbt0285-155 |
Guedon E, Desvaux M, Petitdemange H. 2002. Improvement of cellulolytic properties of clostridium cellulolyticum by metabolic engineering. Appl Environ Microbiol, 68(1): 53-58. DOI:10.1128/AEM.68.1.53-58.2002 |
Gunata Z, Vallier M J. 1999. Production of a highly glucose-tolerant extracellular β-glucosidase by three Aspergillus strains. Biotechnol Lett, 21: 219-223. DOI:10.1023/A:1005407710806 |
Hatakka A I. 1983. Pretreatment of wheat straw by white-rot fungi for enzymic saccharification of cellulose. Appl Microbiol Biotechnol, 18(6): 350-357. DOI:10.1007/BF00504744 |
Hogsett D A, Ahn H J, Bernardez T D, et al. 1992. Direct microbial conversion: perspects, progress, and obstacles. Appl Biochem Biotechnol, 35: 527-542. |
Huber G W, Chheda J N, Barrett C J, Dumesic J A. 2005. Production of liquid alkanes by aqueous-phase processing of biomass-derived carbohydrates. Science, 308: 1446-1450. DOI:10.1126/science.1111166 |
Ingram L O, Conway T, Alterthum F. 1991. Ethanol production by Escherichia coli strains co-expressing Zymomonas PDC and ADH genes. United States Patent 5, 000, 000, March 19
|
Ingram L O, Conway T, Clark D P, et al. 1987. Genetic engineering of ethanol production in Escherichia coli. Appl Environ Microbiol, 53: 2420-2425. |
Ingram L O, Doran J B. 1995. Conversion of cellulosic materials to ethanol. FEMS Microbiology Reviews, 16(2-3): 235-241. DOI:10.1111/j.1574-6976.1995.tb00170.x |
Ingram L O, Gomez P F, Lai X, et al. 1998. Metabolic engineering of bacteria for ethanol production. Biotechnol Bioeng, 58: 204-214. DOI:10.1002/(SICI)1097-0290(19980420)58:2/3<204::AID-BIT13>3.0.CO;2-C |
Jennert K, Tardif C, Young D, et al. 2000. Gene transfer to clostridium cellulolyticum ATCC 35319. Microbiology, 146: 3071-3080. DOI:10.1099/00221287-146-12-3071 |
Johansson B, Christensson C, Hobley T, et al. 2001. Xylulokinase overexpression in two strains of Saccharomyces cerevisiae also expressing xylose reductase and xylitol dehydrogenase and its effect on fermentation of xylose and lignocellulosic hydrolysate. Appl Environ Microbiol, 67(9): 4249-4255. DOI:10.1128/AEM.67.9.4249-4255.2001 |
Kim S, Dale B E. 2004. Global potential bioethanol production from wasted crops and crop residues. Biomass and Bioenergy, 26: 361-375. DOI:10.1016/j.biombioe.2003.08.002 |
Kamionka A, Bertram R, Hillen W. 2005. Tetracycline-dependent conditional gene knockout in Bacillus subtilis. Appl Environ Microbiol, 71(2): 728-733. DOI:10.1128/AEM.71.2.728-733.2005 |
Kirk T K, Farrell R L. 1987. Enzymatic "combustion": the microbial degradation of lignin. Annu Rev Microbiol, 41: 465-505. DOI:10.1146/annurev.mi.41.100187.002341 |
Klinke H B, Ahring B K, Schmidt A S, et al. 2002. Characterization of degradation products from alkaline wet oxidation of wheat straw. Bioresource Technology, 82: 15-26. DOI:10.1016/S0960-8524(01)00152-3 |
Ladisch M R, Lin K W, Voloch M, et al. 1983. Process considerations in the enzymatic hydrolysis of biomass. Enzyme Microb Technol, 5(2): 82-102. DOI:10.1016/0141-0229(83)90042-X |
Lee N, Gielow W, Martin R, et al. 1986. The Organization of the araBAD Operon of Escherichia coli. Gene, 47: 231-244. DOI:10.1016/0378-1119(86)90067-3 |
Lin Y, Tanaka S. 2006. Ethanol fermentation from biomass resources: current state and prospects. Appl Microbiol Biotechnol, 69(6): 627-642. DOI:10.1007/s00253-005-0229-x |
Lynd L R, Weimer P J., van Zyl W H, et al. 2002. Microbial cellulose utization: fundamentals and biotechnology. Microbiol Mol Biol Rev, 66(3): 506-577. DOI:10.1128/MMBR.66.3.506-577.2002 |
McAloon A, Taylor F, Yee W, et al. 2000, Determining the cost of producing ethanol from corn starch and lignocellulosic feedstocks. National Renewal Laboratory NREL/TP-580-28893, 43
|
Miller J E, Evans L, Littlewolf A, et al. 1999. Batch microreactor studies of lignin and lignin model compound depolymerization by bases in alcohol solvents. Fuel, (78): 1363-1366. |
Murai T, Ueda M, Kawaguchi T, et al. 1998. Assimilation of cellooligosaccharides by a cell surface-engineered yeast expressing-glucosidase and carboxymethylcellulase from aspergillus aculeatus. Appl Environ Microbiol, 64(12): 4857-4861. |
Nordin A. 1994. Chemical elemental characteristics of biomass fuels. Biomass and Bioenergy, 6: 339-347. DOI:10.1016/0961-9534(94)E0031-M |
Panttilä M E, André L, Saloheimo M, et al. 2004. Expression of two Trichoderma reesei endoglucanases in the yeast Saccharomyces cerevisiae. Yeast, 3(3): 175-185. |
Phadtare S U, Rawat U B, Rao M B. 1997. Purification and characterisation of xylitol dehydrogenase from Neurospora crassa. FEMS Microbiology Letters, 146: 79-83. DOI:10.1016/S0378-1097(96)00457-0 |
Ragauskas A J, Williams C K, Davison B H, et al. 2006. The path forward for biofuels and biomaterials. Science, 311: 484-489. DOI:10.1126/science.1114736 |
Rostrup-Nielsen J R. 2005. Making fuels from biomass. Science, 308: 1421-1422. DOI:10.1126/science.1113354 |
Sawada T, Nakamura Y, Kobayashi F, et al. 1995. Effects of fungal pretreatment and steam explosion pretreatment on enzymatic saccharification of plant biomass. Biotechnology and Bioengineering, 48: 719-724. DOI:10.1002/bit.260480621 |
Shabtai J, Zmierczak W, Kadangode S, et al. 1999. Lignin conversion to high-octane fuel additives. Proceedings of the Fourth Biomass Conference of the Americas, Oakland, CA, 811-818
|
Schmidt A S, Thomsen A B. 1998. Optimization of wet oxidation pretreatment of wheat straw. Bioresource Technol, 64: 139-151. DOI:10.1016/S0960-8524(97)00164-8 |
Sprenger G A. 1993. Approaches to broaden the substrate and product range of the ethanologenic bacterium Zymomonas mobilis by genetic engineering. J Biotechnol, 27(3): 225-237. DOI:10.1016/0168-1656(93)90087-4 |
Thygesen A, Thomsen A B, Schmidt A S, et al. 2003. Production of cellulose and hemicellulose-degrading enzymes by filamentous fungi cultivated on wet-oxidised wheat straw. Enzyme and Microbial Technology, 32: 606-615. DOI:10.1016/S0141-0229(03)00018-8 |
Wilke C R, Yang R D, von Stockar U. 1976. Preliminary cost analyses for enzymatic hydrolysis of newsprint. Biotechnology and Bioengineering: 155-175. |
Yan T R, Lin C L. 1997. Purification and characterization of a glucose-tolerant β-glucosidase from Aspergillus niger CCRC 31494. Biosci Biotechnol Biochem, 61: 965-970. DOI:10.1271/bbb.61.965 |
Yang H H, Effland M J, Kirk T K. 1980. Factors influencing fungal degradation of lignin in a representative lignocellulosic, thermomechanical pulp. Biotechnology and Bioengineering, 22(1): 65-77. DOI:10.1002/bit.260220106 |
Zaldivar J, Nielsen J, Olsson L. 2001. Fuel ethanol production from lignocellulose: a challenge for metabolic engineering and process integration. Appl Microbiol Biotechnol, 56: 17-34. DOI:10.1007/s002530100624 |
Zhang M, Chou Y C, Picataggio S K, et al. 1998. Single Zymomonas mobilis strain for xylose and arabinose fermentation. United States Patent 5, 843, 760, December 1
|
Zhou S, Yomano L P, Saleh A Z, et al. 1999. Enhancement of expression and apparent secretion of Erwinia chrysanthemi endoglucanase (Encoded by celZ) in Escherichia coli B. Appl Environ Microbiol, 65(6): 2439-2445. |
 2007, Vol. 43
2007, Vol. 43

