文章信息
- 席梦利, 施季森.
- Xi Mengli, Shi Jisen.
- 不同因素对农杆菌介导的杉木转化效率的影响
- An Assessment of Factors Influencing the Efficiency of Transformation of Cunninghamia lanceolata Mediated by Agrobacterium tumefaciens
- 林业科学, 2007, 43(3): 46-50.
- Scientia Silvae Sinicae, 2007, 43(3): 46-50.
-
文章历史
- 收稿日期:2006-01-10
-
作者相关文章
针叶树种生长周期长、树体高大,而且由于长期异交,具有高度的杂合性和大量的遗传负荷(王明庥,2001),因此传统育种周期长,难以适应速生树木遗传改良的需要。植物遗传转化技术在多种植物品种改良中的成功应用,为有效地将具有特殊性状的基因引入有价值的针叶树种提供了机会,为培育针叶树新品种开辟了一条经济而有效的途径。针叶树种由于组织培养困难,因而缺乏好的再生系统,加之对抗生素比较敏感,在加选择压的培养基上难以分化等问题, 都增加了遗传转化的难度。针叶树种遗传转化研究尚处于起步阶段。转化方法主要是农杆菌介导法和基因枪法。目前,农杆菌介导法已在欧洲落叶松(Larix decidua) (Huang et al., 1991;Shin et al., 1994)、日本落叶松与欧洲落叶松杂种(Larix kaempferi ×L. decidua)(Levee et al., 1997)、挪威云杉(Picea abies) (Wenck et al., 1999)、火炬松(Pinus taeda) (Tang et al., 2001;Gould et al., 2002;Tang,2003)等针叶树种转化中取得成功,用基因枪法已获得白云杉(Picea glauca)(Ellis et al., 1993)、辐射松(Pinus radiata)(Walter et al., 1998;Bishop-Hurley et al., 2001)、挪威云杉(Walter et al., 1999;Bishop-Hurley et al., 2001)等针叶树种的转基因植株。
杉木(Cunninghamia lanceolata)在我国分布广,栽培历史悠久。20世纪70年代起,由于杉木林过于集中连片,生态环境恶化,病害问题突出。迄今为止,被研究的杉木病害有10余种,其中真菌性病害最为严重,种类较多,占75%以上(俞新妥,1997)。因此,开展杉木转天麻抗真菌蛋白基因研究,为培育杉木抗病品种提供材料,有着非常重要的现实意义。本文报道了以杉木试管苗靠近茎尖的茎段为受体材料进行的转基因研究,试验以根癌农杆菌(Agrobacterium tumefaciens)EHA105为载体,系统研究了预培养时间、浸染时间、共培养时间,共培养基中添加乙酰丁香酮(AS)的浓度等因素对杉木转基因的影响,旨在建立杉木的遗传转化体系。
1 材料与方法 1.1 试验材料 1.1.1 植物材料以福建种源的杉木试管苗为试验材料。
1.1.2 质粒和菌株天麻抗真菌蛋白(GAFP)基因的表达载体pBin35SGAFP由中国科学院遗传与发育生物学研究所孙勇如研究员提供。
1.1.3 PCR扩增引物1) 5′-ACG TCT AGA AGG GAT CGG TTG AAT-3′;2)5′-GAT CTC GAG GCC AGA AGC CGC CGC TGT-3′。
1.1.4 培养基农杆菌培养基:YEB培养基;茎段诱导培养基:DCR+6-B A 1.0 mg·L-1+TDZ 0.001 mg·L-1+NAA 0.1 mg·L-1;初次筛选培养基:DCR +6-BA 1.0 mg·L-1+TDZ 0.001 mg·L-1+NAA 0.1 mg·L-1+Cef 200 mg·L-1+Km 5 mg·L-1;二次筛选培养基:DCR +Cef 20 0 mg·L-1+Km 40 mg·L-1;生根培养基:1/4MS+IBA 0.2 mg·L-1+NAA 0.1 mg·L-1。以上培养基含有蔗糖2%,琼脂粉0.6%,pH5.8。
1.2 试验方法 1.2.1 杉木茎段遗传转化方法以根癌农杆菌EHA 105介导进行杉木茎段转化。1)预培养:继代培养1个月的杉木试管苗,选取生理状态良好的茎尖,轻轻剥去针叶,切取靠近茎尖的长约0.5 cm的茎段,在用农杆菌浸染之前先置于诱导培养基上预培养。2)正、负对照的设置:杉木茎段在不经过农杆菌浸染、也无卡那霉素(Km)等选择压力时,在诱导培养基上是完全能分化出芽的,称之为正对照;而相应的负对照则是指未浸染的茎段在一定的选择压力下完全不能分化出正常芽。每次遗传转化时都必须设置相应的正、负对照。3)农杆菌的活化及浸染菌液的制备:挑农杆菌单菌落,接种于5 mL YEB+Km 25 mg·L-1的液体培养基中,27 ℃,220 r·min-1振荡培养过夜。取0.5 mL菌液转接入25 mL YEB+Km 25 mg· L-1的液体培养基中扩大培养,培养至一定浓度(进入对数生长期),测定菌液600 nm波长OD值。5 000 r·min-1离心10 min收集菌体,取适当液体诱导培养基悬浮菌体并稀释到浸染所需的浓度。4)浸染和共培养:将预培养后的茎段,浸入制备的浸染菌液,轻微振荡,浸泡一定时间,取出茎段后在无菌滤纸上吸去多余菌液,然后再放回诱导培养基上进行共培养。黑暗条件下共培养一定时间后,转接到初次筛选培养基上培养。5)筛选培养:茎段转接到初次筛选培养基上培养约20 d,待少数茎段开始长芽时转入二次筛选培养基。在二次筛选培养基上25 d继代1次。
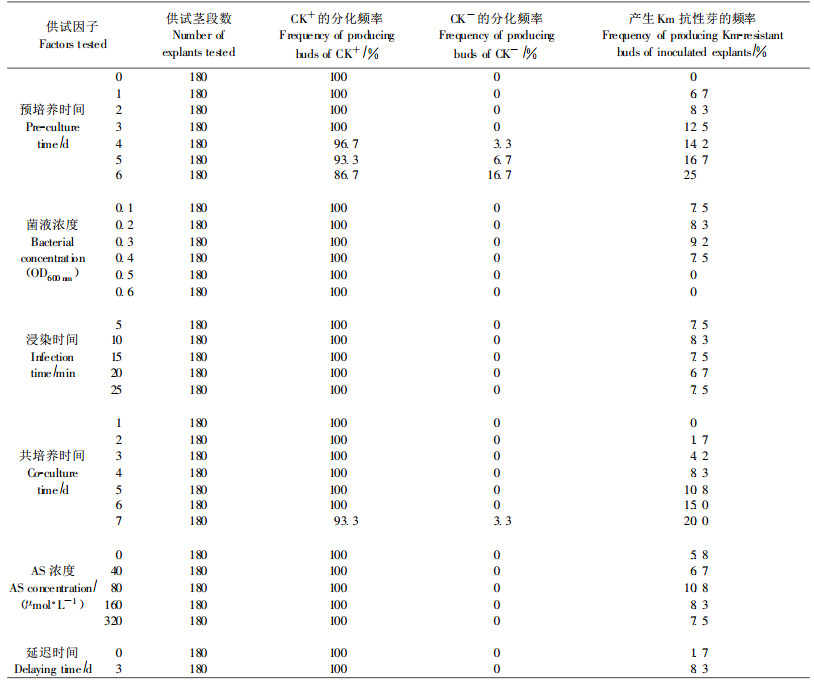
1.2.2 影响杉木遗传转化效率的因素杉木转化的基本条件:预培养2 d,浸染菌液浓度为OD600 nm=0.2,浸染10 min,共培养4 d,共培养基添加AS 80 μmol·L-1,pH5.8,共培养后延迟3 d转入初次筛选培养基。
预培养时间:茎段浸染前,分别预培养0、1、2、3、4、5、6 d,其他条件同转化的基本条件。
浸染菌液浓度:菌液600 nm波长OD值分别为0.1、0.2、0.3、0.4、0.5、0.6,其他条件同转化的基本条件。
浸染时间:浸染时间分为5、10、15、20、25 min,其他条件同转化的基本条件。
共培养时间:浸染茎段分别共培养1、2、3、4、5、6、7 d,其他条件同转化的基本条件。
共培养基中AS浓度:在共培养基中分别添加AS 0、40、80、160、320 μmol·L-1,共培养基pH5.4,其他条件同转化的基本条件。
Km添加的时机:Km分2个时间加入,共培养后直接转入初次筛选培养基,共培养后延迟3 d再转入初次筛选培养基,其他条件同转化的基本条件。
衡量转化效率的指标:以茎段转接入初次筛选培养基20 d后的Km抗性芽分化频率为指标。分化频率(%)=分化Km抗性芽的茎段数/转化的茎段数×100%。
1.2.3 分步筛选培养和Km抗性芽的获得采用分步筛选,逐步提高选择压力。因为杉木对Km非常敏感,如果开始选择时就加入较高浓度的Km,很难得到芽,在开始筛选时加入较低的选择压,以确保有少量芽的发生,随后加大选择压,淘汰假阳性芽。在二次筛选培养基上继代2次的芽,被初步认定为Km抗性芽。
1.2.4 Km抗性芽的PCR检测Km抗性芽的总DNA提取:采用少量DNA提取方法(李丹等,2000)。PCR反应体系:DNA模板量100 ng,10×buffer 2 μL,MgCl2(25 mol·L-1)2 μL,dNTP(2 mol·L-1)2 μL,引物1 0.25 μmol·L -1,引物2 0.25 μmol·L-1,Tag DNA聚合酶(5 U·μL-1)0.2 μL,无菌水11.8 μL。PCR反应程序为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃复性3 0 s,72 ℃延伸30 s,进行30个循环后72 ℃再延伸7 min。反应结束后,进行1%的琼脂糖凝胶电泳,检测扩增结果。
2 结果与分析 2.1 预培养时间对产生Km抗性芽的影响比较了不同预培养时间对杉木转化中Km抗性芽产生的影响。试验结果(表 1)表明:不进行预培养就浸染茎段,没有Km抗性芽产生;预培养1~3 d,正对照的分化频率为100%,负对照的分化频率为0,随着预培养时间的延长,Km抗性芽产生的频率从6.7%增加到12.5%;预培养4~6 d,正对照的分化频率从96.7%降到86.7%,这是因为,预培养使茎段愈伤组织大量生长,影响了腋芽和不定芽的发生,而负对照的分化频率从3.3%增加到16.7%,Km抗性芽产生的频率从14.2%增加到25%。石蜡切片观察表明,预培养时间延长到4 d时,少数腋芽已开始脱分化成一团分生组织,随着预培养时间的增加,分生组织快速分裂,到第6天时,少数腋芽分生组织已发育成叶原基。由于Km的传递速度较慢,较难扩散到分生组织团内部,因此预培养时间越长,腋芽对Km的抗性越强,负对照的分化频率就越高,假阳性的比例也越高。综合考虑Km抗性芽产生的频率和可能出现假阳性的比例,确定杉木预培养1~3 d较为合适。
|
|
EHA105菌液浓度OD600 nm为0.1~0.4时,茎段产生Km抗性芽的频率变化不大,这说明菌液浓度较低时,浓度的变化对转化效率影响不大。当菌液浓度OD600 nm为0.5和0.6时,茎段没有产生Km抗性芽,这可能是因为菌液浓度较高时,容易对茎段产生毒害作用,导致茎段在培养过程中褐化死亡。这与Humara等(1999)的研究结果类似。观察发现,菌液浓度OD600 nm高于0.4时,在筛选培养过程中很难将农杆菌完全脱除,农杆菌的迅速生长,也会影响茎段产生Km抗性芽。
2.3 浸染时间对产生Km抗性芽的影响试验结果(表 1)表明,在杉木转化过程中,浸染时间对转化效率影响不大。观察发现,浸染时间超过15 min,随着浸染时间的增加,软腐的茎段明显增多。在浸染过程中,一般不发生T-DNA的转移,只是外植体表面带菌,加之农杆菌对植物细胞有毒害作用,因此延长浸染时间并无益处。
2.4 共培养时间对产生Km抗性芽的影响农杆菌和植物共培养是整个转化过程中非常重要的环节,因为农杆菌附着,T-DNA的转移及整合都在共培养阶段完成(王关林等,2002)。从表 1可以看出,随着共培养时间的延长,Km抗性芽的获得频率明显增加,共培养时间为1~6 d时,CK-的分化频率并未提高,仍为0。这说明茎段产生Km抗性芽频率的提高是转化细胞增多的结果,不是由于Km筛选时间的推后而使假阳性比例增加。共培养时间并不是越长越好,试验过程中观察发现,共培养时间超过2 d,部分茎段周围就会出现微菌落,共培养时间越长,农杆菌长势越盛。共培养时间超过5 d,部分茎段的农杆菌在选择培养基中很难抑制。综合分析后认为,杉木茎段转化时的共培养时间以3~5 d为宜。
2.5 共培养基中AS浓度对产生Km抗性芽的影响已有大量试验表明酚类化合物对Vir区基因的活化具有重要作用,其中最常用的Vir区基因诱导物是AS。在转化过程中添加AS常采用3种方法:第1种是在浸染菌液中加AS;第2种是在共培养基中加AS;第3种是在浸染菌液和共培养基中都加AS。诸葛强等(2003)研究新疆杨(Populus alba var. pyramidalis)转基因时发现,共培养基中添加AS,Km抗性芽的产生频率比对照高近4倍;浸染菌液中加AS,Km抗性芽的产生频率稍高于对照;浸染菌液和共培养基中都加AS,Km抗性芽的产生频率反而低于对照。本研究只在共培养基中添加AS,共培养基pH值为5.4。结果(表 1)表明,AS浓度为80 μmol·L-1时,Km抗性芽的产生频率比对照有明显提高。AS浓度为160、320 μmol·L-1时,茎段褐化速度加快,这可能是AS对茎段产生了毒害作用。
2.6 Km添加的时机对产生Km抗性芽的影响设计了2个处理:一种为共培养后直接转接入初次筛选培养基中开始筛选;另一种为共培养后先转接到没有添加抗生素的诱导培养基上培养3 d,然后再接到初次筛选培养基上开始筛选。结果(表 1)表明:不延迟筛选,尽管筛选压力很低,Km浓度仅为5 mg·L-1,但只有个别茎段分化芽;延迟3 d筛选,产生Km抗性芽的频率明显提高。
2.7 大量Km抗性芽的获得通过以上试验,可以初步确定杉木茎段较为合适的转化体系为:预培养1~3 d,OD600 nm= 0.1~0.4菌液浸染10~15 min,共培养3~5 d,共培养基pH值5.4,附加AS 80 μmol·L-1,共培养后延迟3 d筛选。随后以预培养2 d,OD600 nm=0.2菌液浸染10 min,共培养4 d,共培养基pH值5.4,附加AS 80 μmol·L-1,共培养后延迟3 d筛选为转化条件,对1 080个茎段进行转化试验,包括在试转化条件时所转化的茎段,先后对4 920个茎段进行浸染,在初次筛选培养基上共获得186个Km抗性芽。初次获得的Km抗性芽在二次筛选培养基上继代2次,在继代过程中大量芽白化,最终仍保持绿色的芽被认定为K m抗性芽。共获得39个Km抗性芽。
2.8 Km抗性芽的PCR检测提取Km抗性芽的DNA,以转化植株DNA为模板,以未转化植株DNA为阴性对照,以质粒pBin35SGAFP为阳性对照,用人工合成的GAFP基因的特异引物,在20 μL反应体系中进行PCR扩增。结果(图 1)表明,在39个抗性芽中,扩增出与阳性对照一致的DNA片段的只有2个Km抗性芽,而未转基因的对照植株未扩增出同样大小的片段。初步证明外源GAFP基因已整合到这2个Km抗性芽的基因组DNA中。
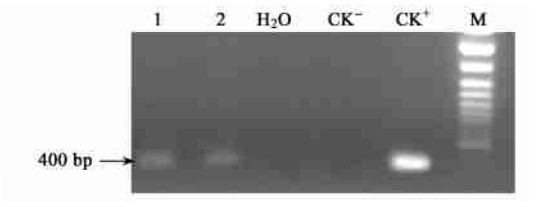
|
图 1 转GAFP基因Km抗性芽的PCR检测 Fig. 1 PCR amplification of Km-resistant buds of GAFP gene M:100 bp ladder;1,2:Km抗性芽Km-resistant buds;CK+:质粒Plasmid DNA;CK-:未转化植株Non-transgenic plant;H2O:水Water. |
影响转化效果的因素很多,本试验共研究了6个影响转化效率的因素:预培养时间、共培养时间、浸染菌液的浓度、浸染时间、共培养基中AS浓度及Km添加时机。研究结果表明:不同因素对转化效率的影响不同,其中预培养时间、共培养时间对转化效率有明显的影响;共培养基中AS浓度及Km添加时机对转化效率有一定影响;而浸染菌液的浓度和浸染时间对转化效率几乎没有影响。这可能是因为,预培养时间直接影响着外植体的生理状态,只有预培养一定时间的外植体才有更多细胞处于感受态时期,而共培养时间关系到有多少感受态细胞接受了外源T-DNA,在农杆菌不会旺盛生长的前提条件下,延长共培养时间,可明显提高转化效率。
3.2 分步筛选策略的确定选择转化体的方法有多种,根据选择压加入的时间不同,选择的方法可分成3种:前期选择、延迟选择和后期选择(王关林等,2002)。前期选择是共培养后立即加选择压,这种方法适于不定芽再生很快的植物,例如林木中的部分杨树品种。延迟选择是共培养一定时间后再加选择压,后期选择是先再生出不定芽,然后再选择,这2种方法多用于再生较慢的植物。
杉木属于再生较慢的树种,确定筛选方法的原则是在能够得到芽的前提下尽可能加大选择压。杉木对Km非常敏感,茎段在芽诱导培养基上预培养6 d后(暗培养),转接入添加Km的芽诱导培养基上培养,Km浓度为6 mg·L-1 时,芽的诱导频率仅为9.7%。考虑到转化过程中农杆菌可能会对茎段产生影响,在转化后的初次筛选培养基中Km浓度降为5 mg·L-1。杉木茎段转化时不延迟添加Km,初次筛选后Km抗性芽的再生频率仅为1.7%,延迟3 d后,初次筛选后Km抗性芽的再生频率升高到8.3%,因此本试验采用了延迟3 d的方法,允许有一定的逃逸比例,在2次筛选时加大选择压。
李丹, 凌定厚. 2000. 五种提取马尾松基因组DNA方法的比较. 植物学通报, 17(2): 168-173. DOI:10.3969/j.issn.1674-3466.2000.02.012 |
王明庥. 2001. 林木遗传育种学. 北京: 中国林业出版社.
|
王关林, 方宏筠. 2002. 植物基因工程. 2版. 北京: 科学出版社.
|
俞新妥. 1997. 杉木栽培学. 福州: 福建科学技术出版社.
|
诸葛强, 王婕琛, 陈英, 等. 2003. 新疆杨高效遗传转化系统的建立. 植物资源与环境学报, 12(4): 6-10. DOI:10.3969/j.issn.1674-7895.2003.04.002 |
Bishop-Hurley S L, Zabkiewicz R J, Grace L, et al. 2001. Conifer genetic engineering: transgenic Pinus radiata (D. Don) and Picea abies (Karst) plants are resistant to the herbicide Buster. Plant Cell Rep, 20: 235-243. DOI:10.1007/s002990100317 |
Ellis D D, McCabe D, Mclnnis S, et al. 1993. Stable transformation of Picea glauca by particle acceleration. Bio Technol, 11: 84-89. |
Gould J H, Zhou Yuanxiang, Padmanabhan V, et al. 2002. Transformation and regeneration of Loblolly Pine: shoot apex inoculation with Agrobacterium. Mol Breed, 10: 131-141. DOI:10.1023/A:1020324604279 |
Huang Y, Diner A M, Karnosky D F. 1991. Agrobacterium rhizogenes-mediated genetic transformation and regeneration of a conifer: Larix decidua. In Vitro Cell Dev Biol, 27: 201-207. DOI:10.1007/BF02632217 |
Humara J M, Lopez M, Ordas R J. 1999. Agrobacterium tumefaciens-mediated transformation of Pinus pinea L. cotyledons: an assessment of factors influencing the efficiency the uidA gene transfer. Plant Cell Rep, 19: 51-58. DOI:10.1007/s002990050709 |
Levee V, Lelu M A, Jouanin L, et al. 1997. Agrobacterium tumefaciens-mediated transformation of hybrid larch (Larix kaempferi, L. decidua) transgenic plant regeneration. Plant Cell Rep, 16: 680-685. DOI:10.1007/s002990050301 |
Shin D I, Podila G K, Huang Y, et al. 1994. Transgenic larch expressing genes for herbicide and insect resistance. Can J For Res, 24: 2059-2067. DOI:10.1139/x94-264 |
Tang Wei, Sederoff R, Whetten R. 2001. Regeneration of transgenic Loblolly Pine (Pinus taeda) from zygotic embryos transformed with Agrobacterium tumefaciens. Planta, 213(6): 981-989. DOI:10.1007/s004250100566 |
Tang Wei. 2003. Additional virulence genes and sonication enhance Agrobacterium tumefaciens-mediated Loblolly Pine transformation. Plant Cell Rep, 21(6): 555-562. |
Walter C, Grace L J, Wagner A, et al. 1998. Stable transformation and regeneration of transgenic plants of Pinus radiata D. Don. Plant Cell Rep, 17: 460-469. DOI:10.1007/s002990050426 |
Walter C, Grace L J, Donaldson S S. 1999. An efficient biolistic transformation protocol for Picea abies embryogenic tissues and regeneration of transgenic plants. Can J For Res, 29: 1539-1546. DOI:10.1139/x99-116 |
Wenck A R, Quinn M, Whetten R W, et al. 1999. High-efficiency Agrobacterium-mediated transformation of Norway Spruce(Picea abies) and Loblolly Pine(Pinus taeda). Plant Mol Biol, 39: 407-416. DOI:10.1023/A:1006126609534 |
 2007, Vol. 43
2007, Vol. 43