文章信息
- 朱天辉, 刘富平.
- Zhu Tianhui, Liu Fuping.
- 坚强芽孢杆菌对3种病原真菌的抗生现象
- The Antagonism of Bacillus firmus against Three Strains of Pathogenetic Fungi
- 林业科学, 2007, 43(2): 120-123.
- Scientia Silvae Sinicae, 2007, 43(2): 120-123.
-
文章历史
- 收稿日期:2005-07-21
-
作者相关文章
2. 海南大学海洋学院 海口 570228
2. Ocean College, Hainan University Haikou 570228
病害生物防治,具有无污染、不诱导抗药性、防效持久等特点,是今后植物病害控制的主要方向,也是综合治理的一个重要环节。立枯丝核菌(Rhizoctonia solani)、腐皮镰孢菌(Fusarium solani)、腐霉菌(Pythium sp.)是引起林木幼苗立枯病的3种主要病原菌, 近年来, 苗圃中广泛使用化学药剂防治这类病害, 严重破坏了林业生态系统, 并对环境造成污染,因而探索无公害、无污染的生物防治措施是植物病害综合治理中的重要课题。枯草芽孢杆菌(Bacillus subtilis)(何远礼,1985;鲁素云,1993;朱伟光等,1990;孔建等,1992)是生物防治中报道较多的一种拮抗细菌,在植物病害的生物防治中发挥着尤为重要的作用,它能够产生广谱的抗菌代谢物质(Cavaglieri et al., 2005), 是土壤和植物微生态的优势微生物种群,具有很强的抗逆能力和抗菌防病作用, 许多性状优良的天然分离株已成功地应用于植物病害生物防治,但有关坚强芽孢杆菌在生物防治中的作用尚缺乏研究,本文以从松苗圃土壤中分离纯化出的一株具有拮抗活性的坚强芽孢杆菌(B. firmus)为研究对象,探索了坚强芽孢杆菌对立枯丝核菌、腐皮镰孢菌、腐霉菌的拮抗作用机理,以期为林木病害生物防治提供理论依据。
1 材料与方法 1.1 参试菌种坚强芽孢杆菌采用3层琼脂法(方仲达,1987)从松苗圃土壤中分离而得。立枯丝核菌、腐皮镰孢菌、腐霉菌为四川松幼苗猝倒病常见病原,从发病苗木上分离。
1.2 坚强芽孢杆菌对病原菌的抗生现象研究1) 坚强芽孢杆菌的挥发性代谢产物对病原菌的影响用对扣法(Dennis, 1971)测定挥发性代谢产物对3种病原菌生长的抑制作用,重复3次,25 ℃培养,以抑制病原菌直径生长为评定指标。
2) 坚强芽孢杆菌的非挥发性代谢产物对病原菌的影响将一支活化后的坚强芽孢杆菌斜面接种于肉膏蛋白胨培养基(100 mL)中,25~28 ℃摇床培养24 h即为1级发酵种子,然后将10 mL发酵种子液转入100 mL马铃薯蔗糖培养液中,于25 ℃分别振荡培养1~8 d后,分别用细菌滤器抽滤灭菌,取1 mL滤液于10 mL的马铃薯蔗糖固体培养基中,摇匀后倒平板,分别接种立枯丝核菌、腐皮镰孢菌、腐霉菌,以不加芽孢杆菌发酵滤液的平板接种3种病原菌为对照,重复3次,于25 ℃培养,观测3种病原菌的生长情况,分别在24、64 h测量菌落直径。同时以培养3 d的代谢产物为测试对象,取1 mL滤液于10 mL的PDA培养基中,摇匀后倒平板,接种立枯丝核菌25 ℃培养72 h,以不加坚强芽孢杆菌发酵滤液的PDA平板接种丝核菌为对照。分别切取对照和处理的丝核菌琼脂块,进行扫描电镜前处理,最后经KYKY-1000B型扫描电子显微镜观察。
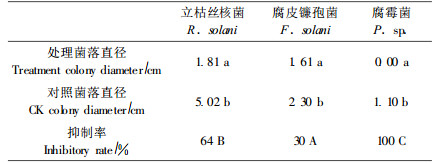
2 结果与分析 2.1 坚强芽孢杆菌的挥发性代谢产物对病原菌的抑制效应对扣法试验结果表明坚强芽孢杆菌产生的挥发性代谢产物对丝核菌、腐皮镰孢菌、腐霉菌的抑制率较低,以菌落直径为评定指标,3种真菌的抑制率分别仅为8.43%、9.89%、5.59% (表 1)。相对而言,腐皮镰孢菌对挥发性物质最为敏感,其次是丝核菌和腐霉菌。
|
|
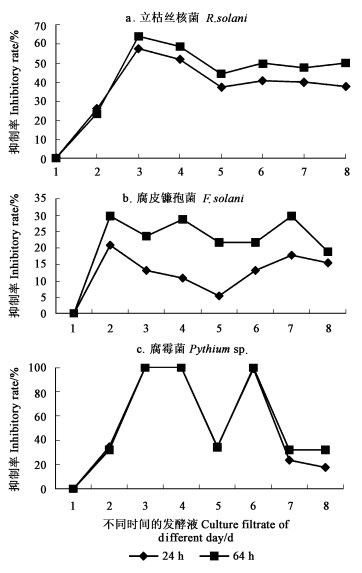
坚强芽孢杆菌不同时间的发酵液对3种病原真菌的抑制作用不完全相同(图 1),统计分析显示:不同时间的发酵液对病原真菌有显著影响,第3天的发酵液对丝核菌、腐霉菌的抑制达最大,分别为64.04%、99.99%,对镰孢菌抑制最高为29.58%(第2天的发酵液)。以不同真菌对发酵液的敏感性来看(表 2),腐霉菌最敏感,其次为丝核菌和镰孢菌,它们的抑制率分别可达100%、60%以上和近30%。
|
图 1 坚强芽孢杆菌发酵液对3种菌的抑制率 Fig. 1 Inhibitory rate of B. firmus culture filtrate to three kinds of fungi |
|
|
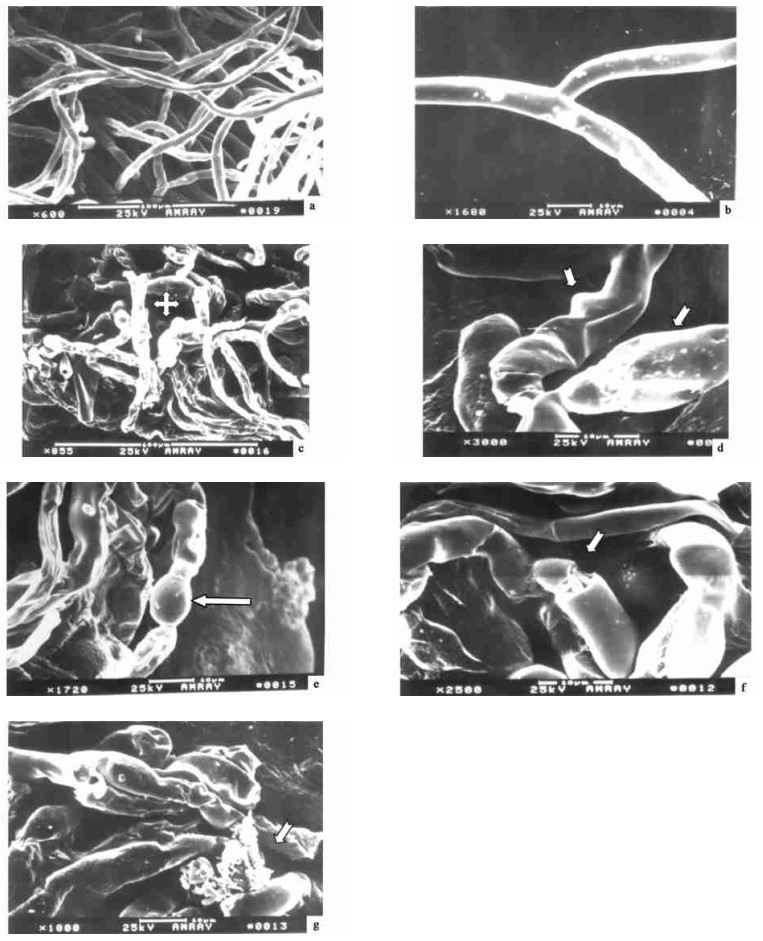
扫描电镜显示,在未加坚强芽孢杆菌发酵滤液的平板上生长的立枯丝核菌菌丝生长旺盛,均匀饱满(图 2-a),近直角分枝明显(图 2-b)。坚强芽孢杆菌发酵滤液对立枯丝核菌的超微结构有明显影响,菌丝多数变形(图 2-c),菌丝端部和中部明显膨胀呈椭圆状和球状(图 2-d, e),部分菌丝有断裂现象(图 2-f),许多菌丝在断裂处有内含物流出的现象(图 2-g)。
|
图 2 坚强芽孢杆菌的非挥发性代谢产物对立枯丝核菌超微结构的影响 Fig. 2 The effect on the ultrastructure of the R.solani from the volatilizable metabolites of B.firmus a:正常生长状况Normally growing hyphae (×600); b:正常的直角分枝Approximately orthogonal ramification of the normal(×1 600); c:菌丝变形Distortion hyphae of inhibitory(×855); d:膨胀呈椭圆状Deformity ellipsoid structure (×3 000); e:菌丝膨胀呈球状Deformity globular structure (×1 700); f:菌丝断裂Deformity hyphae breaking off (×2 500); g:菌丝断裂后物质外渗Cytoplasm of breaking hyphae oozing (×1 800). |
人们对芽孢杆菌生防潜能的研究至少已有40年的历史,田间应用研究己经证实芽孢杆菌生防菌剂在产品中的稳定性,与化学农药的相容性和不同植物不同年份防效的一致性方面明显优于非芽孢杆菌和真菌生防菌(Monica et al., 2001)。芽孢杆菌(Bacillus spp.)作为一类重要的微生物资源, 它富含蛋白酶、淀粉酶、脂酶等酶类以及其他丰富的代谢产物,部分菌还可以分解土壤中的不溶性磷酸盐,与其他微生物一起在土壤中起着重要作用(来航线等,2004)。不仅如此,芽孢杆菌的不同代谢产物在各个领域都有发展前景。产生抗生素是芽孢杆菌抗菌作用的一个重要的因素,但是,往往一种芽孢杆菌的拮抗活动中,会同时存在多种代谢产物。芽孢杆菌的抗生素主要是核糖体合成的小分子量抗菌蛋白和非核糖体合成的各种抗菌肽,以及次生代谢产生的其他抗菌活性物质,如脂肪氨基酸氮氧衍生物等(陈中义等,2003;Trejo-Estrada et al., 1998)。
许多研究者认为:芽孢杆菌的抑菌机理主要是通过产生抗菌素来抑制病菌的生长(Gutter et al., 1953; Janisiewicz, 1988)但有些拮抗菌细菌产生的挥发性物质对病原菌也有抑制作用(汪来发等,1994)。本研究结果表明:坚强芽孢杆菌可产生挥发性和非挥发性2大类物质,挥发性物质的抑菌作用不强,主要抑菌物质存在于发酵液中,以水溶性代谢物质为主,并且挥发性与非挥发性代谢物对3种病原真菌的抑菌效应有显著差异,挥发性代谢物的抑菌顺序为:腐皮镰孢菌>立枯丝核菌>腐霉菌,而非挥发性代谢物则为:腐霉菌>立枯丝核菌>腐皮镰孢菌,这种现象可能与非挥发性物质和挥发性物质作用机理不同、菌种对不同抗菌物质敏感特异性有关,尚待进一步研究。
一般而言,在拮抗菌代谢物质中,以非挥发性物质研究和应用的较多,尚无将挥发性物质用于生产实践的报道,范青等(2000)的试验结果表明,芽孢杆菌除活菌液处理外,热处理液和滤液对青、绿霉菌在PDA上的生长和在柑橘果实(in vivo)上的侵染有一定的抑制效果,这进一步证明了枯草芽孢杆菌产生的抗菌物质对病菌有抑制作用, 这些物质大多为低分子抗生素(王岳,1986)。本试验也证明坚强芽孢杆菌在生长过程中产生于体外的代谢产物抑制了3种病原真菌的生长,其非挥发性抗菌物质可使病原菌菌丝畸形,细胞崩溃,菌丝断裂,内含物外泄,菌丝变得皱缩干瘪,从而使病菌丧失对植物的侵染能力。研究中涉及的坚强芽孢杆菌与谢栋等(1998)的研究结果相一致。谢栋认为,枯草芽孢杆菌对病原真菌抑制作用主要有2种方式:其一为造成细胞畸形,出现囊泡、肿胀,继而崩溃溶解;其二为对细胞壁的破坏,造成菌丝原生质体从胞壁溶解处泄露,菌丝断裂成段,继而消融。
陈中义, 张杰, 黄大昉. 2003. 植物病害生防芽孢杆菌抗菌机制与遗传改良研究. 植物病理学报, 33(2): 97-103. DOI:10.3321/j.issn:0412-0914.2003.02.001 |
范青, 田世平. 2000. 枯草芽孢杆菌(Bacillus subtilis)B-912对采后柑桔果实青、绿霉病的抑制效果. 植物病理学报, 30(4): 343-348. DOI:10.3321/j.issn:0412-0914.2000.04.010 |
方仲达. 1987. 植病研究方法. 北京: 农业出版社, 228.
|
何礼远. 1985. 细菌在植物病害防治上应用的研究进展. 生物防治通报, 1(3): 28-31. |
孔建, 王文夕, 赵白鸽, 等. 1992. 枯草芽孢杆菌B-903菌株抗菌物质的研究. 微生物学报, 32(6): 445-449. |
来航线, 杨保伟, 邱学礼, 等. 2004. 9株芽孢杆菌的初步分离鉴定与拮抗性试验. 西北农林科技大学学报:自然科学版, 32(7): 93-96. |
鲁素云. 1993. 植物病害生物防治学. 北京: 北京农业大学出版社.
|
王岳. 1986. 抗生素. 北京: 科学出版社, 453-471.
|
汪来发, 邱德勋. 1994. Psedomonas sp. A 03对Rhizoctonia solani的抗生现象. 四川农业大学学报, 12(2): 248-252. |
谢栋, 彭憬, 王津红, 等. 1998. 枯草芽孢杆菌抗菌蛋白X98III的纯化与性质. 微生物学报, 38(1): 13-19. |
朱伟光, 李德葆, 葛起新. 1990. 植物病原细菌拮抗菌及其拮抗物质测定. 浙江农业大学学报, 16(4): 345-350. |
Cavaglieri L, Orlando J, Rodriguez M I, et al. 2005. Biocontrol of Bacillus subtilis against Fusarium verticillioides in vitro and at the maize root level. Research in Microbiology, 156(5/6): 748-754. |
Dennis C. 1971. Antagonistic properties of species groups of Trichoderma (Ⅱ). Tran Br Mycol Soc, 157: 41-52. |
Gutter Y, Littauer F. 1953. Antagonistic action of Bacillus subtilis against citrus fruit pathogens. Bull Res Counc Isr, 3: 192-196. |
Janisiewicz W. 1988. Biological control of diseases of fruits//Mukergii N C, Garg K L. Biocontrol of plant diseases.V.2.Boca Raton: CRC Press, 153-166
|
Monica L E, Elizabeth A D J, William E B J, et al. 2001. Viability and stability of biological control agents on cotton and snap bean seeds. Pest Manag Sci, 57(8): 695-706. DOI:10.1002/ps.342 |
Trejo-Estrada S R, Paszcaynski A, Crawford D L. 1998. Antibiotics and enzymes produced by the biocontrol agent strepto myces violaceusiger TCED-9. J Indust Microb Biotech, 21: 81-90. DOI:10.1038/sj.jim.2900549 |
 2007, Vol. 43
2007, Vol. 43