文章信息
- 张奇, 李海燕, 白钢, 熊惠龙, 杨文博.
- Zhang Qi, Li Haiyan, Bai Gang, Xiong Huilong, Yang Wenbo.
- 松材线虫纤维素酶的免疫学分析
- Immunological Analysis of Bursaphelenchus xylophilus Pathogenous Cellulase
- 林业科学, 2007, 43(2): 64-67.
- Scientia Silvae Sinicae, 2007, 43(2): 64-67.
-
文章历史
- 收稿日期:2005-07-28
-
作者相关文章
2. 国家林业局森林病虫害防治总站 沈阳 110034
2. General Station of Forest Pest Control, State Administration of Forestry Shenyang 110034
松树枯萎病是由松材线虫(Bursaphelenchus xylophilus)引起的重大森林病害,其传播宿主为松墨天牛(Monochamus alternatus)。当松树感染松材线虫后,树脂道中的薄壁细胞的胞质首先会颗粒化,并且发生褐变(Kusunoki,1987)。随后树脂道、木射线和形成层甚至木质部和皮层细胞形成空穴化,从而导致组织死亡(Fukuda et al., 1992)。目前关于松材线虫病的致病机制有毒素学说、酶学说和空洞化学说3种理论(Odani et al., 1985;Kuroda,1989;Oku et al., 1979)。其中酶学说认为:松材线虫会分泌高活力的纤维素酶,该酶可以破坏松树薄壁细胞管胞的细胞壁和细胞膜系统,致使树脂分泌到管胞中并阻止水分的运输,从而导致了松树的枯萎。Odani等(1985)首次初步分离了松材线虫高活力的纤维素酶,并应用该酶和其他的商品化的具有水解纤维素能力的酶类进行病理研究,发现这一类酶均可以使正常松树死亡,认为松材线虫纤维素酶是导致松树枯萎病早期病症的主要因素。Kojima等(1994)通过纤维素酶的酶染电泳验证了松材线虫纤维素酶具有水解纤维素的能力,并进一步证明了该酶通过水解细胞壁中纤维素导致宿主松树的死亡。Kikuchi等(2004)克隆了松材线虫的纤维素酶基因,认为该基因可能来源于真菌,松材线虫通过基因的水平漂移获得该基因。
尽管松材线虫纤维素酶的作用已经被确认,但有关它的表达、分泌的过程却极少报道。本文采用免疫学的方法对松材线虫的纤维素酶分泌侵染过程进行了研究,为确定致病因子纤维素酶在早期感染中的重要作用提供有力证据。
1 材料与方法 1.1 材料试剂:弗氏佐剂(GIBCOBRL),辣根过氧化物酶(HRP)标记羊抗兔IgG,辣根过氧化物酶(HRP)标记的羊抗鼠IgG,邻苯二胺(OPD),4-氯萘酚(4-CN),羧甲基纤维素钠(CMC),羊血清及牛血清白蛋白(BSA)均购于北京TBD生物工程有限责任公司;DAB显色试剂盒购于武汉博士德生物工程有限公司;兔抗松材线虫全蛋白血清(Anti-BX)为本实验室保存(白钢等,2005);其他试剂均为分析纯。
主要仪器:酶标仪(BIOTECH,ELX800),冷冻干燥机(Christ,ALPHA1-4),高速冷冻离心机(Beckman,20RP52D),超声波细胞粉碎仪(国产)。
1.2 纤维素酶抗体的制备及特异性分析取100 μg纯化的抗原性纤维素酶BXC60(张奇等,2006)与等体积的弗氏完全佐剂混合乳化后,腹腔注射于4周龄的雌性BALB/c小鼠。每隔2周加强注射1次,采用ELISA法定期测定抗血清效价,待获得最高效价后,收集血清,作为抗松材线虫纤维素酶血清(Anti-BXC60),-20 ℃保存备用。以不同种类的抗原为固相,采用直接ELISA方法分别分析Anti-BXC60以及Anti-BX的特异性(白钢等,2005)。
1.3 纤维素酶酶谱电泳及免疫印迹分析采用SDS-PAGE电泳(10%分离胶,浓缩胶3%)分离松材线虫粗酶液及纤维素酶BXC60,分离后的凝胶采用半干式电转移,分别转移至一块含有1%CMC的SDS-PAGE凝胶和PVDF膜上,前者进行纤维素酶染色(Goren et al., 1976);后者采用10 000倍稀释的Anti-BXC60抗体进行免疫印迹分析(张奇等,2006);并同时进行考马斯亮蓝染色分析。
1.4 免疫斑点分析取活松材线虫的混悬液(约100条/滴),滴加到PVDF膜上,于25 ℃下培养2 h使之分泌物分泌在膜上,然后置于37 ℃温育3 h以固定抗原。充分清洗后,以10%空白羊血清4 ℃封闭过夜后,分别置于5 000倍稀释的Anti-BX或10 000倍稀释的Anti-BXC 60血清中室温反应3 h,充分清洗后分别加入2 000倍稀释的HRP标记的羊抗兔或鼠IgG的酶标抗体,室温反应1.5 h,采用DAB显色试剂盒显色至适宜后水洗中止反应,显微镜下观察并照相。
1.5 双重染色分析按上面描述的方法进行抗原的固定和封闭,随后将PVDF膜置于10 000倍稀释的Anti-BXC60血清和5 000倍稀释的Anti-BX血清的混合液中室温反应3 h,随后加入2 000倍稀释的HRP标记的羊抗鼠IgG,室温反应1.5 h,DAB显色试剂盒显色至适宜后水洗中止反应;然后再加入2 000倍稀释的HRP标记的羊抗兔IgG酶标抗体,室温反应1.5 h,4-CN(0.5 mg·mL-14-CN,0.012% H2O2,0.1 mol·L-1Tris-HCl缓冲液,pH7.4)显色至适宜水洗中止反应,显微镜下观察并照相。
2 结果与分析 2.1 抗血清的特异性分析纤维素酶的酶染结果显示:松材线虫含有2种可以水解CMC的纤维素酶:BXC60和BXC30(图 1,B1);但免疫印迹的结果表明:Anti-BXC60血清针对松材线虫总蛋白提取物只呈现单一条带(图 1,C1),该着色部位与考马斯亮蓝染色和纤维素酶BXC60酶染部位相一致(图 1,A2,B2)。该结果表明:所制备的抗纤维素酶多克隆抗体能够特异性地识别纤维素酶BXC60,而与其他的包含BXC30在内的可溶性蛋白没有交叉反应。

|
图 1 松材线虫蛋白的SDS-PAGE、免疫印迹及酶染分析 Fig. 1 SDS-PAGE、Western blot analyses and cellulase staining of B. xylophilus proteins M:标准分子量蛋白Marker protein;1:全蛋白提取物BX total protein; 2:纤维素酶BXC60 Cellulase BXC60;A:SDS-PAGE;B:酶染分析Cellulase staining;C:免疫印迹Western blot |
抗体的特异性分析结果如图 2所示:在相同浓度的固相抗原(5 μg·mL-1)条件下,Anti-BXC60与Anti-BX相比具有较好的特异性。Anti-BXC60能够特异性地识别松材线虫纤维素酶BXC60,而与松材线虫的另一种纤维素酶BXC30以及其他的商品酶(蛋白酶K、果胶酶、中性蛋白酶和商品纤维素酶)几乎没有交叉反应。由于松材线虫与拟松材线虫同源性较高,该血清与拟松材线虫总蛋白提取物(BM total protein)也呈现了一定的交叉反应(<15.3%),信噪比(P/N)大于6,即该血清针对松材线虫纤维素酶具有较好的特异性。

|
图 2 Anti-BXC60与anit-BX多克隆抗体的特异性分析 Fig. 2 Specificity assay of Anti-BXC60 and Anti-BX serum |
以Anti-BX为示踪抗体的免疫斑点分析结果表明:活的松材线虫会向体外分泌大量的可溶性蛋白。如图 3-A、B所示,全蛋白的抗原染色主要集中在松材线虫分泌孔附近,由于体壁有少部分蛋白抗原,因此染色后可以看出不明显的虫体轮廓。但经100 ℃,2 min热致死的松材线虫(图 3-C)则没有任何着色反应,即分泌性蛋白均来源于活体的松材线虫。

|
图 3 松材线虫分泌性全蛋白的DAB染色 Fig. 3 DAB staining of B. xylophilus secretions A,B:松材线虫分泌的全蛋白染色Total proteins staining of pine wood nematodes; A(×40),B(×100);C:负对照Negative control(×100);白色箭头所指处为全蛋白染色White arrowheads indicate total proteins staining. |
另一方面,纤维素酶的染色结果显示:松材线虫向体外分泌的纤维素酶零星地分布在各处,较为分散,推测与觅食活动相关,明显区别于分泌性全蛋白(图 4-A)。同样热致死的松材线虫则没有任何染色反应(图 4-B)。
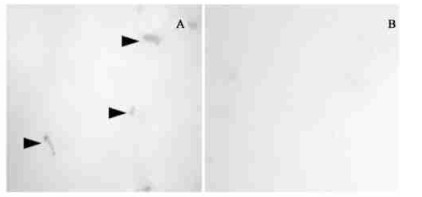
|
图 4 松材线虫分泌的纤维素酶DAB染色 Fig. 4 DAB staining of B. xylophilus cellulase A:松材线虫分泌的纤维素酶染色(×100) Cellulase staining of pine wood nematode;B:负对照Negative control(×100);黑色箭头所指处为纤维素酶染色Black arrowheads indicate cellulase staining. |
双重染色的结果更清晰地表明:松材线虫分泌的大量可溶性蛋白分泌物呈蓝黑色染色,并主要集中在分泌孔周围;而松材线虫分泌的纤维素酶染色呈褐色染色,且零星分布在松材线虫的口部附近,与分泌性蛋白相比两者之间有明显的差别(图 5-A、B)。而热处理的松材线虫对照样品则无任何着色反应(图 5-C)。据报道(Smant et al., 1998),植物线虫在其侵入宿主细胞时先通过其口针刺入植物的细胞壁,并向外分泌纤维素酶,水解细胞壁的纤维素,导致细胞壁软化,以便其进入植物细胞中。结合图 3、4的结果认为:松材线虫分泌的纤维素酶也是通过口部中空的口针向外分泌的。
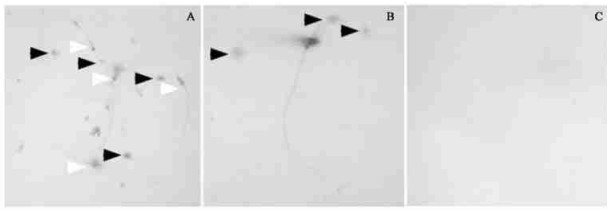
|
图 5 松材线虫分泌物的双重染色 Fig. 5 Double staining of B. xylophilus secretions A,B:松材线虫分泌物的双重染色Double staining of pine wood nematodes;A(×40),B(×100);C:负对照Negative control(×100);白色箭头所指处为全蛋白染色White arrowheads indicate totalproteins staining;黑色箭头所指处为纤维素酶染色Black arrowheads indicate celluase staining. |
目前松材线虫病已给自然环境和资源带来了巨大的灾害,并且通过国际间的商贸活动跨国传播的现象也十分严重,已经成为了亚洲、欧洲等松林的主要病害,已被列入我国生物入侵的主要检疫对象。虽然目前对松材线虫分泌的纤维素酶的相关酶学性质报道甚少,松材线虫与拟松材线虫纤维素酶之间的差异也尚未定论,但在寄主松树的早期感染中,纤维素酶仍被认为是重要的致病因素之一。
Lawler等(1993a; 1993b)通过松材线虫全蛋白抗血清来检测松材线虫,尽管由于交叉反应等原因,其方法存在着一定的局限性,但为作者工作提供了一定的参考。本研究中,作者利用兔抗松材线虫可溶性全蛋白血清和鼠抗松材线虫纤维素酶BXC60多克隆抗体,分别对松材线虫分泌在PVDF膜上的包括纤维素酶在内的分泌物进行分析,旨在阐明纤维素酶的分泌过程及其分泌部位。
严东辉等(1996)曾证明松材线虫可以向体外分泌多种酶蛋白,其中包括纤维素酶、过氧化物酶、蛋白酶、淀粉酶等。Kikuchi等(2004)克隆了松材线虫的纤维素酶的基因,并通过地高辛标记的分子探针对线虫进行了原位杂交实验,发现纤维素酶产生于线虫的食道腺。
本研究建立了线虫分泌蛋白在PVDF膜上双重染色的试验方法。本试验结果表明:松材线虫主要通过分泌孔分泌大量的蛋白,而松材线虫的纤维素酶的分泌方式与其他植物线虫相似,也是通过口针向体外分泌。该方法为检测松材线虫纤维素酶提供了一个新的手段,同时也为开展松材线虫病的病理研究奠定了一定的基础。
白钢, 王玉嬿, 马洪周, 等. 2005. 疫木中松材线虫的免疫学检测方法的研究. 林业科学, 41(2): 91-95. |
严东辉, 杨宝君. 1996. 松材线虫体外酶组成分析. 林业科学研究, 10(3): 265-269. |
张奇, 马洪周, 杨文博, 等. 2006. 松材线虫纤维素酶的分离纯化及免疫学检测方法的研究. 南开大学学报, 39(1): 95-99. |
Fukuda K, Hogetsu T, Suzuki K. 1992. Cavitation and cytological changes in xylem of pine seedling inoculated with virulent and avirulent isolates of Bursaphelenchus xylophilus and B. mucronatus. J Jpn For Soc, 74(4): 289-299. |
Goren R, Huberman M. 1976. A simple and sensitive staining method for the detection of cellulase isozymes in polyacrylamide gels. Analytical Biochemistery, 75: 1-8. DOI:10.1016/0003-2697(76)90048-8 |
Kikuchi T, Jones J T, Aikawa T, et al. 2004. A family of glycosyl hydrolase family 45 cellulase from the pine wood nematode Bursaphelenchus xylophilus. FEBS Letters, 572: 201-205. DOI:10.1016/j.febslet.2004.07.039 |
Kojima K, Kamijyo A, Masumori M, et al. 1994. Cellulase activities of pine wood nematode isolates with different virulences. J Jpn For Soc, 76(3): 258-262. |
Kusunoki M. 1987. Symptom Development of pine wilt disease histopathological observations with electron microscopes. Ann Phytopath Soc Japan, 53: 622-629. DOI:10.3186/jjphytopath.53.622 |
Kuroda K. 1989. Terpenoids causing tracheid-cavitation in Pinus thunbergii infected by the pine wood nematode (Bursaphelenchus xylophilus). Ann Phytopath Soc Japan, 55: 170-178. DOI:10.3186/jjphytopath.55.170 |
Lawler C, Harmey M A. 1993a. Immunological detection of nematode antigens on the surface of a wood section. Fundamental and Applied Nematology, 16(6): 521-523. |
Lawler C, Joyce P, Haimey M A. 1993b. Immunological differentiation between Bursaphelenchus xylophilus and B.mucronatus. Nematologica, 39(4): 536-546. |
Odani K, Sasaki S, Nishiyama Y, et al. 1985. Early Sympton development of the pine wilt disease by hydrolytic enzymes produced by the pine wood nematodes-cellulase as a possible candidate of the pathogen. J Jpn For Soc, 67(9): 366-372. |
Oku H, Shiraishi T, Kurozumi S. 1979. Participation of toxin in wilting of Japanese pines caused by a nematode. Naturwissenschaften, 66: 210-211. DOI:10.1007/BF00366031 |
Smant G, Stokkermans J P W G, Yan Y T, et al. 1998. Endogenous cellulases in animals: Isolation of β-1, 4-endoglucanase genes from two species of plant-parasitic cyst nematodes. PNAS, 95: 4906-4911. DOI:10.1073/pnas.95.9.4906 |
 2007, Vol. 43
2007, Vol. 43
