文章信息
- 赵俊, 秦国夫, 张来, 徐振昌, 赵日良, 蔺成阁, 彭广增.
- Zhao Jun, Qin Guofu, Zhang Lai, Xu Zhenchang, Zhao Riliang, Lin Chengge, Peng Guangzeng.
- 蜜环菌群体遗传规律的初步研究
- Primary Study on Armillaria Population Heredity Law
- 林业科学, 2007, 43(1): 72-77.
- Scientia Silvae Sinicae, 2007, 43(1): 72-77.
-
文章历史
- 收稿日期:2005-04-18
-
作者相关文章
2. 吉林省黄泥河林业局 敦化 133704
2. Huangnihe Forestry Bureau, Jilin Province Dunhua 133704
群体遗传学主要是通过鉴定群体(population)无性和有性繁殖的组成及其随寄主在时间、空间上的变异,来了解群体的基因流(genet flow)、遗传漂变(drift)以及交配和重组格局(pattern),进而明确繁殖方式在病害初侵染和流行中的作用、对寄生适合度(fitness)的影响(Anderson et al., 1995),是以遗传个体(genet individual)或称遗传体(genet)为基点的。因此,遗传体的鉴定在土传病原菌的群体结构中尤为重要(Anderson et al., 1995),遗传体的大小和密度分别是无性繁殖和有性繁殖的结果,也是病害发生的直接原因。
蜜环菌根朽病(armillaria root rot)是世界性的病害,1873年由Hartig首次发现,现已在70多个国家造成经济损失(Shaw Ⅲ et al., 1991)。国内鞠国柱(1979)首次报道以来,东北地区由蜜环菌引起的根朽病普遍发生(何军等,1993;秦国夫等,1999)。在蜜环菌的群体遗传多样性方面,Roll-Hansen(1985)认为在整个北半球,A. mellea仅寄生于阔叶树上,具有极强的致病力;寄生针叶树,则引起根朽病。在阔叶林中,A. gallica具有发达的菌索网络,无性繁殖力强,基因多样性较低,遗传体占据较大空间(Anderson et al., 1995)。针叶林的主要靠担孢子飞散建立遗传体,基因多样性较高(Rizzo et al., 1995; Worrall, 1994)。Worrall(1994)发现,混交林中蜜环菌种类多,遗传体面积小、密度高,而只有一个生物种的纯林中,遗传体面积大、密度低。
我国东北地区的森林是重要的经济林和生态林,在国民经济和自然调控方面,起着不可估量的作用。我国蜜环菌群体遗传规律方面的研究较弱,基本上停留在20世纪70年代的水平。笔者调查和研究了东北地区蜜环菌的种类及分布,现将研究结果报道如下。
1 材料与方法 1.1 样地的设定详细地调查了长白山自然保护区林内蜜环菌的发生情况,在天然针阔混交林设定了3块样地,以东西、南北方向建立直角坐标系,0.5 m范围内视为同一个样本,统一编号,作好寄主、坐标值的记录,共采集了170号标本。
在张广才岭的额穆地区人工次生林内,以同样方法设定了2块样地,共采集了161号标本。
1.2 菌种分离每一个样本,野外进行组织分离的同时,制作孢子印(spore print),低温带回室内备用。组织分离的菌株纯化后,用1.5% MEA培养基(Melt Extract 15 g、Agar 17 g、H2O 1 L)保存,对组织分离不好的样本号,室内促进孢子萌发后再分离,纯化后保存备用。
1.3 单孢分离根据各个样本实际分布特点,把样地划分为若干个小的区域,在每个小区域中选取具有代表性的样本为代表株,在直径9 cm的培养皿中,到入2%水琼脂培养基(Agar 20 g、H2O 1 L)3 mm厚,无菌环境下用野外制作的孢子印,在培养基表面进行均匀涂抹,25 ℃培养待孢子萌发后在显微镜下(10×10)进行单孢分离,具体方法参照赵俊等(1999),选取具有白色棉絮状的菌落保存备用。
1.4 遗传体的测定采用体细胞非亲和性(somatic incompatibility, SI)的方法,在3% MEA(Melt Extract 30 g、Agar 17 g、H2O 1 L)培养基上,2个菌落相距至少5 mm对接,25 ℃对接培养4周后观察记录。
1.5 生物种测定利用2% MEA培养基分离得到的单孢菌株分别与东北地区的5个生物种进行对接,测定其种类,具体方法参照文献(秦国夫等,1999)。
1.6 坐标图的绘制根据记录的具体位置情况,按样地分别绘制了相对位置图,为室内试验的设计,提供了详细、直观的资料(图略)。
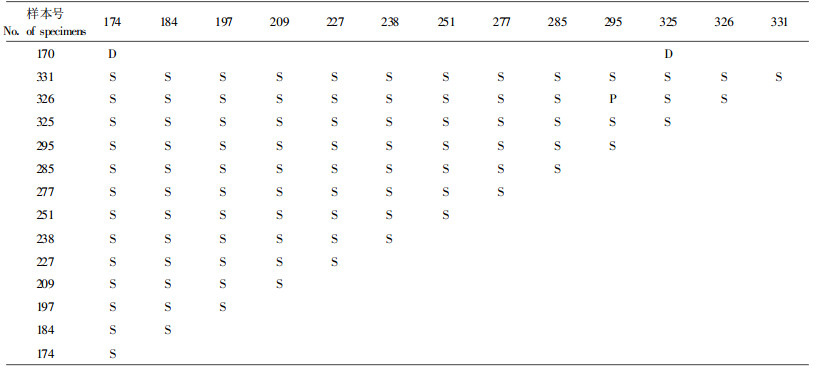
2 结果与分析 2.1 遗传体之间的亲和反应2个遗传体之间,采用距离较远的长白山及张广才岭额穆的2个菌株(同一个种类),进行对抗性培养试验。其表现出明显的拮抗反应,即2个菌落互不融合,保持一定的距离,产生明显的拮抗区域,但没有黑褐色的拮抗线。在接种点超过5 mm时,2个菌落的褐色壳状壳皮深入培养基直达底部,在背面可看到明显的3 mm左右的拮抗区域,拮抗区域两侧具有两条褐色线。正面拮抗区域不明显,但有时也可看见(图 1)。这是2个遗传体之间相互拮抗,各自产生酚类物质,抑制对方生长所致。
|
图 1 不同遗传体之间的拮抗反应 Fig. 1 The anagonism reaction in different genet |
当受到杂菌感染时,蜜环菌菌落与杂菌菌落之间也产生明显的拮抗反应,与蜜环菌2个遗传体之间的表现相同。这一现象说明无论是种内还是种间,只要是2个遗传体,彼此之间就产生拮抗反应。因此,当受到杂菌感染时,试验结果不可靠。从理论上来说,不同种的2个遗传体之间,在反应出明显拮抗作用的同时,还应该具有一条黑色拮抗线(black line),但由于拮抗线的颜色与2个菌落的颜色相同或相近,很难辨认,必须做生物种的测定。
相同遗传体之间,采用同一个遗传体的菌株,进行对抗性培养试验。其表现为不产生拮抗反应,2个菌落相互融合(图 2)。

|
图 2 同遗传体之间的拮抗反应 Fig. 2 The anagonism reaction in same genet |
在接种3周时,已经有部分呈现出培养性状,在接种4周时,大部分对接培养点能够表现出培养性状。但仍有部分未能表现,有的菌落刚变色,有的菌落甚至没变色。到接种5周时现已全部表现。
2.2 长白山样地遗传体的测定根据各个样点在空间的分布情况,选取了34、46、54、74、75、77、87、91、94、101、111、113、118、122、125、128、133、136、141、146、152、159、160、161、163、166、170号等27个号为代表性样本,按照就近原则划分出27个小区域。每个小区域内的样本菌株分别与代表性样本的菌株进行对接培养,结果表明在每个小区内,大部分样本菌株都与代表性样本菌株融合,表现为同一个遗传体(表略),只有18号与54号、42号与34号之间似乎有拮抗反应。扩大范围进行了18、42号分别与18、34、42、111、113号对接培养,结果表明18号与34、42号无拮抗反应,而与111、113号之间具有明显的拮抗反应;42号与34号无拮抗反应,而与111、113号之间似乎有明显的拮抗线。造成这种假拮抗现象,主要是由于一方菌落老化造成菌索变黑,致使培养基同时也变黑,并非菌落之间拮抗作用的结果,在判断时应特别注意。
27个小区代表性菌株之间进行大循环对接培养,结果34、46、54、74、75、77、94、118、122、125、128、133、136、141、152、159、160、161、163、166、170号为1个组,87、91、101、111、113号为另1个组。组内每个号与多个号有不产生拮抗反应试验配对,如果两两之间用线段连接,可组成错综复杂、闭合的相互网络,因此可推出相互间为同一遗传体。组间每个号至少与2个号有产生拮抗反应试验配对,从而可推出每个组分别是1个遗传体(表 1)。
|
|
161号与87、113号之间,146号与87号之间无拮抗现象,而与91、111号之间,146号与91、101、111、113号产生拮抗反应。87、91、101、111、113号、可以肯定为同一遗传体,这样似乎产生矛盾。唯一可以解释的是不产生拮抗反应的配对中,可能是只有一个接种点的缘故。为此又重复了146、161号与87、113号之间的对接培养,结果明显地表现出拮抗反应,这一现象说明在无拮抗反应的情况下应注意是否为单点所致。
从生长状态上看,长白山第2组遗传体的菌落生长缓慢,褐色壳状壳皮明显、发亮,菌落表面中间有少量的白色气生菌丝,从背面看对应菌落处色泽偏红褐色。而第1组遗传体的菌落生长快,褐色壳状壳皮不明显、菌落表面发暗,无白色气生菌丝,从背面看对应菌落处色泽偏白,如同菌丝底层有一层白布。两组的差别很大,可以从另一方面证明是2个遗传体。
2.3 张广才岭额穆样地遗传体的测定根据各个样点在空间的分布情况,选取了174、184、197、209、227、238、251、277、285、295、325、326、331号等13个为代表性样本,按照就近原则划分出13个小区域。每个小区域内的样本菌株分别与代表性样本菌株进行对接培养,结果表明在每个小区内,样本菌株都与代表性样本菌株融合,表现为同一个遗传体(表略)。
13个小区代表性样本菌株之间进行大循环对接培养,结果见表 2。从结果可看到,174、184、197、209、227、238、251、277、285、295、325、326、331号每个号均与多个号不产生拮抗反应而相互融合;如果两两之间用线段连接,可组成错综复杂、闭合的相互网络;从培养性状上看,菌落的表现形式相同或相近,因此,可推出相互间为同一遗传体。174、325号与长白山的170号明显区分为不同的遗传体。
|
|
张广才岭额穆的2个样地的161号,经测试属于同1个遗传体,且均为奥氏蜜环菌(秦国夫等,1999)。而长白山的3个样地的170号样点,经测试分属于2个遗传体,由于种间的拮抗线很难判断,因此,必须用单倍体菌株进行互交不育性试验。首先第1组中选取了38、54、58、163、170,第2组中选取了113有代表性的样点进行单孢分离,经互交不育性试验,均为奥氏蜜环菌(秦国夫等,1999)。
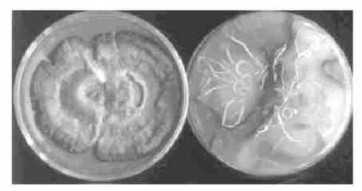
2.5 群体在林间的分布张广才岭的样地,位于吉林敦化额穆,为多年生红松(Pinus koraiensis)人工林,很多树木遭受蜜环菌侵染,也是作者开展防治试验的样地,面积大约0.5 hm2,东侧为谷底溪流,西侧为道路,南北两侧为农田地。试验结果表明:样地范围内样本属于同一个遗传体(图 3)。
|
图 3 张广才岭遗传体样点分布图 Fig. 3 The distribution of specimens genet in the Zhangguangcai Mountain range |
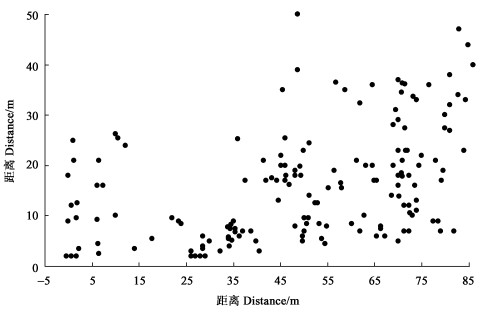
长白山的样地位于白河黄松蒲附近,为针阔混交的原始林,部分生长势弱的林木遭受蜜环菌的侵染而死亡或濒临死亡,面积大约1.23 hm2,东西向为3 m宽的小路,南北向为稍明显的小道,2条道路把整个样地分成4部分,西南区域未发现蜜环菌,其余3个区域分别对应1个样地。试验结果表明:样地包含了2个遗传体,1个遗传体在西北角,只涵盖了一小部分,另1个遗传体较大(图 4)。
|
图 4 长白山遗传体样点分布 Fig. 4 The distribution of specimens genet in the Changbai Mountain |
目前共有4种方法用于检测菌物的遗传结构:交配型等位基因(mating-type alleles)、体细胞非亲合性(somatic incompatibility, SI)、同工酶和分子标记技术(如RAPD、RFLP),它们鉴别遗传体的效果一致。交配型等位基因和同工酶方法现很少采用,因为前者工作量极大,而且抽样调查的分离株基本是来自病腐木、天麻块茎和菌索的双倍体菌株;后者易受环境条件、单双倍菌体等诱导基因表达因素的影响。SI配对是鉴定蜜环菌和其他担子菌个体基因型的常用方法,简便快速。分子标记技术是SI的补充。在SI配对接种实验时,2个接种点之间的距离不得小于5 mm,留有足够的反应空间。在判断时存在3种情况:一是相同遗传体的2个菌落相互融合变为一体;二是同种的2个不同遗传体的菌落之间产生拮抗反应,但不产生黑色拮抗线;三是不同种类的遗传体的菌落之间产生拮抗反应,并且产生黑色拮抗线,结果与Mallett等(1986)对于双倍体的蜜环菌的判断都呈现3种交配反映类型相同。由于菌落颜色的影响,通常情况下很难观察到黑色拮抗线,必须用单孢菌株进行互交不育性实验,以区分是否为相同的种类。
3.2 我国林木根朽病的病原菌奥氏蜜环菌的传播方式试验表明:我国东北地区红松林内,林木根朽病的病原菌奥氏蜜环菌,其遗传体在林间的密度较低,同一个体占据着较大的区域,以菌索形式在土壤中传播、侵染,不同于Rizzo等(1995)、Worrall(1994)针叶林的奥氏蜜环菌主要靠担孢子飞散建立遗传体,基因多样性较高的结论。在天然针阔混交林中,虽然林木根朽病的病原菌奥氏蜜环菌的遗传体在林间仍然以菌索形式在土壤中传播、侵染,但其遗传体的密度比纯林要高,从图 4中存在的空白情况可以得到验证。与Worrall(1994)混交林中蜜环菌种类多,遗传体面积小、密度高的结论雷同。长白山地属于针阔混交林,林内蜜环菌的种类较为丰富,从8月下旬到10月上旬,各个种类相继出现。在样本采集时以子实体为主,没有采集腐木、枯枝并进行分离,缺少其他蜜环菌种类的分布状况,造成图 4中的空缺现象。
3.3 林木根朽病的防治措施我国东北林区随着人工林面积的不断增加,纯林所占的比重也不断增加,人为活动日趋频繁,森林生态环境趋于恶化,林木根系范围内的菌落失去平衡,有益菌的衰退,造成病原菌的入侵。感病初期,树木表现不明显,潜伏期较长,不易引起重视,表现症状后又较难治愈。病原菌蜜环菌在林间是以菌索形式传播、蔓延、侵染的,菌索的分布与土壤的湿度与土壤中氧气分布密切相关,主要集中在土壤表层10~20 cm深度之间(Day, 1927; Redfern, 1973),所以侵染经常发生在树木的根茎处或根系的开始部位,而不是在根系的边缘(Korhonen et al., 1974)。因此在蜜环菌根朽病的防治策略上,一是改良林木的生长环境,采伐迹地应当把枝桠材清理干净,铲除根基附近地面的杂草,疏松表面土壤;二是用无致病性的木腐菌快速处理伐桩,首先占领最佳生态位,使病原菌无法迅速扩展蔓延;三是实行菌根化育苗,提高苗木的质量、等级,增强抵抗病原菌侵染的能力;四是大力营造针阔混交林,提高土壤中菌物种类的多样性,降低病原菌的密度。
何军, 马文春, 陈国义, 等. 1993. 落叶松根朽病生物防治研究. 东北林业大学学报, 21(3): 97-101. |
鞠国柱. 1979. 红松根朽病研究. 东北林学院学报, (2): 49-56. |
秦国夫, 赵俊, 戴玉成, 等. 1999. 中国东北蜜环菌根朽病病原菌的鉴定. Fungal Science, 14(1, 2): 53-62. |
赵俊, 田淑敏, 王玉玲, 等. 1999. 蜜环菌遗传测定的单孢分离和培养方法. 微生物学通报, 26(3): 207-209. |
Anderson J B, Kohn L M. 1995. Clonality in soiborne, plant-pathogenic fungi. Annu Rev of Phytopthology, 33: 369-391. DOI:10.1146/annurev.py.33.090195.002101 |
Day W R. 1927. The parasitism of Armillaria mellea in relation to conifers. Quarterly Journal Foretry, 21: 9-21. |
Korhonen K, Hintikka V. 1974. Cytological evidence for somatic diploidization in dikaryotic cells of Armillariella mellea. Arch Microbiol, 95: 187-192. DOI:10.1007/BF02451760 |
Mallett K I, Hopkin A A, Blenis P V. 1986. Vegetative incompatibility in diploid isolates of Armillaria North American biological species I and V. Canadian Journal of Botany, 67: 3083-3089. |
Redfern D B. 1973. The growth & behavior of Armillaria mellea rhizomorphs in soil. Transactions of the British Mycological Society, 61: 569-581. DOI:10.1016/S0007-1536(73)80126-3 |
Rizzo D M, Blanchette R A, May G. 1995. Distribution of Armillaria ostoyae genets in a Pinus resinosa-Pinus banksiana forest. Can J Boot, 73: 776-787. DOI:10.1139/b95-085 |
Roll-Hansen F. 1985. The Armillaria species in Europe. Eur J For Path, 15: 22-31. DOI:10.1111/j.1439-0329.1985.tb01039.x |
Shaw Ⅲ C G, Kile G A. 1991. Armillaria root disease.Forest Service United States Department of Agriculture.. Agriculture Handbook No.691: 1-233. |
Worrall J J. 1994. Population structure of Armillaria species in several forest types. Mycologia, 86(3): 401-407. DOI:10.1080/00275514.1994.12026427 |
 2007, Vol. 43
2007, Vol. 43