文章信息
- 冯莹, 韩正敏.
- Feng Ying, Han Zhengmin.
- 杨树与杨盘二孢菌激发子互作进程中活性氧的释放及膜脂过氧化
- Active Oxygen Release and Membrane Lipid Peroxidation in the Interaction of Marssonina brunnea Elicitor and Poplar Suspension Cell
- 林业科学, 2007, 43(1): 68-71.
- Scientia Silvae Sinicae, 2007, 43(1): 68-71.
-
文章历史
- 收稿日期:2005-07-05
-
作者相关文章
2. 广东省森林病虫害防治与检疫总站 广州 510173
2. General Station of Forest Pest Management and Quarantine of Guangdong Province Guangzhou 510173
杨树黑斑病是杨树最主要的病害之一,世界各地均有分布。杨树感病后叶片早落,生长量降低。杨盘二孢菌(Marssonina brunnea)是该病害的病原。研究表明杨盘二孢菌存在有激发子物质(梁伟红等,2006)。寄主受病原物及其激发子影响后,内部所发生的生理生化变化及病理生理代谢,常常是寄主发生组织病变的基础,也是病害生理生化诊断的基础,所以对寄主-病原物互作关系的研究,不仅有助于揭示寄主感抗病机制, 而且还可进一步从分子水平上揭示病害的发生规律,并在此基础上通过调控感病因子和激发抗病因子,以达到控制该病害的目的。对杨树与杨生褐盘二孢菌互作早期反应进程和细胞水平上生理生化变化及其内在联系的研究,国内还未见报道。本文对杨树悬浮细胞与杨盘二孢菌激发子粗提液互作后细胞内活性氧代谢及膜脂过氧化等方面进行了研究。
1 材料与方法 1.1 杨树细胞悬浮系的建立杨树:选择加杨(Populus canadensis)作为感病杨树的代表;选择I-72杨(P. deltoides cv. I-72)作为抗病杨树的代表。
愈伤组织的诱导:采集杨树的嫩茎或叶柄作为外植体,经70%酒精表面消毒30 s,0.1%升汞灭菌4 min,无菌水冲洗3~5遍后,在无菌滤纸上吸尽嫩茎和叶柄上所吸附水分, 再切成1cm的小段,接种在MY系列固体培养基上,于26 ℃下暗培养30 d,产生愈伤组织后转接继代,定期观察愈伤组织生长情况。
细胞悬浮系的建立:在固体培养基上挑选具有分化能力的淡黄色或乳白色、颗粒状愈伤组织1 g,置于100 mL三角瓶中, 加入30 mL液体培养基,26 ℃、130 r·min-1振荡暗培养。前3次继代时,待培养物静置2 min后,用无菌吸管吸出2/3左右上清液,补充加入新鲜培养液至30 mL。以后每次继代,均用无菌吸管吸取约1 mL的悬浮细胞至内含30~40 mL液体培养基的100 mL的三角瓶中,根据细胞生长速度,每12~15 d继代1次(Currinder,1989;王影等,1991)。
1.2 杨盘二孢菌激发子的提取杨生褐盘二孢菌的培养:杨生褐盘二孢菌多芽管专化型(M. brunnea f.sp.multigermtubi)菌株,分离自南京加杨,由南京林业大学病理实验室保存。将生长在PDA培养基斜面上2周的杨盘二孢菌转移到酵母浸膏液体培养基(酵母浸膏5 g;蔗糖20 g;自来水定容至1 L)中振荡培养,在25 ℃下130 r·min-1振荡,暗培养10~14 d,待长出均匀的菌丝团后滤纸过滤。菌丝用重蒸水反复洗涤4~6次,以除掉培养液,冻存于-20 ℃冰箱中待用。过滤下来的滤液也存于冰箱待用。
激发子的提取:参照毕咏梅等(1990)的方法并略作改进。将所存的滤液分别按照1:5、1 :10、1:15、1:20(V:V)的比例,于60 ℃下真空旋转蒸发仪中分别浓缩成5、10、15、20倍的浓缩液。在浓缩液中以1:3(V:V)的比例加入95%乙醇,4 ℃放置过夜,次日弃去上清液。用30 mL双蒸水悬浮沉淀,并用重蒸水透析1夜(每10 h换1次重蒸水),6 000 r·min-1离心15 min,取上清液作激发子粗提液使用。
1.3 互作体系的建立采用Baker等(1993)的方法。取对数生长期的悬浮细胞,棉布过滤收集,互作介质(0.5 mmol·L-1 MES,0.5 mmol·L-1 CaCl2,0.5 mmol·L-1 K2SO4及175 mmol·L-1甘露醇,用NaOH调pH至6.0)冲洗细胞,沥干后称取湿细胞,使悬浮在互作介质中的细胞浓度达到0.15 g FW·mL-1。互作体系中激发子粗提液的浓度为10倍的浓缩液。以不加粗提液的互作体系为对照。
1.4 O2·-测定将不同处理时间中的悬浮细胞取出,棉布过滤收集,称取湿细胞0.5 g,加入2.5 mL(0.05 mol·L-1,pH7.8)磷酸缓冲液[含0.1 mmol·L-1 EDTA;0.3%(W/V)Triton X-100;4%(W/V)PVP(聚乙烯吡咯烷酮)],研磨匀浆,10 000 r·min-1,4 ℃冷冻离心20 min,取上清液备用。互作时间分别为1、2、3、4、5、6、7、8 h。用0.05% NBT(氮兰四唑)处理上清液10 min后离心,上清液在85 ℃的水浴中加热5 min,冷却至室温,测OD580,由SOD抑制反应证明O2·-对NBT的还原(Keppler等,1989),并计算矫正变化值[矫正变化值(%)=(处理-对照)/对照×100%]。
1.5 脂膜过氧化测定丙二醛(MDA)的提取:将不同处理时间中的悬浮细胞取出,用蒸馏水将菌体冲洗干净,称取湿细胞0.5 g,加入10% TCA(三氯乙酸)1 mL研磨至匀浆,再加3.0 mL TCA进一步研磨,匀浆于6 000 r·min-1 4 ℃冷冻离心10 min,上清液备用。
显色反应和测定:吸取离心的上清液2 mL,处理加入2 mL 0.6% TBA溶液(硫代巴比妥酸,用10% TCA配制)(对照加2 mL蒸馏水),混匀物于沸水浴上反应15 min,迅速冷却后离心10 min。取上清液分别测OD532、OD600和OD450(余叔文等,1999)。计算寄主细胞内MDA含量的公式如下:

|
在互作体系中,用DELTA 320 pH计定时测定互作体系中pH值,用定时互作体系中实测pH值减去互作前测得的pH值即得到该互作时间Δ pH的变化(Baker et al., 1993)。
2 试验结果 2.1 O2·-的变化用激发子粗提液处理I-72杨和加杨悬浮细胞,各互作系统中悬浮细胞O2·-的释放及其变化如图 1。互作体系中,I-72杨悬浮细胞O2·-的释放表现出O2·-产生“氧化突发”现象,即O2·-释放量先增加再减少。加杨悬浮细胞在粗提液作用下,O2·-释放量一直处于较低水平,总体水平还低于对照;比较对照矫正后抗病的I-72杨和感病的加杨O2·-释放量,显示抗病的I-72杨比感病的加杨的O2·-释放量在总体上高出很多,特别在互作2 h时,差别最大。
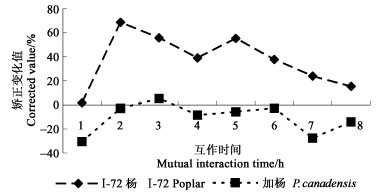
|
图 1 杨盘二孢菌滤液粗提液处理I-72杨和加杨悬浮细胞O2·-变化值的比较 Fig. 1 Comparison of the changes of O2·- production of I-72 and P. canadensis treated with crude elicitor of M. brunnea |
在I-72杨和加杨悬浮细胞与粗提液互作过程中,悬浮细胞膜脂过氧化的变化均为先上升而后下降。I-72杨和加杨相比,前者在互作1 h后细胞膜脂过氧化急剧上升,而后缓慢下降;后者在互作2 h后才大幅上升。经过各自对照进行矫正,再来比较感病杨树和抗病杨树在膜脂过氧化上的差异。总的来讲,感病杨树和抗病杨树在激发子物质处理后,膜脂过氧化的变化无明显差别(图 2)。
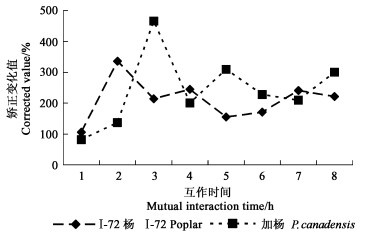
|
图 2 杨盘二孢菌滤液粗提液处理I-72杨和加杨悬浮细胞膜脂过氧化变化值的比较 Fig. 2 Comparison of the changes of membrane lipid peroxidation of I-72 and P. canadensis treated with crude elicitor of M. brunnea |
先测定杨树悬浮细胞的pH值,再测定激发子粗提液处理后的互作体系的pH值,计算各处理的ΔpH。随着处理时间的推移,不管是对照还是处理,ΔpH变化均有一定的波动。但经对照矫正后可以明显看出,抗病树种I-72杨粗提液的处理pH变化增幅明显高于感病加杨(图 3)。
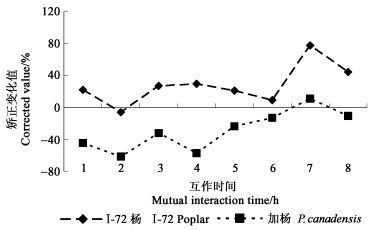
|
图 3 杨盘二孢菌滤液粗提液处理I-72杨和加杨悬浮细胞ΔpH变化值的比较 Fig. 3 Comparison of ΔpH changes of I-72 and P. canadensis treated with crude elicitor of M. brunnea |
植物被病原体感染,发生过敏反应时有大量活性氧产生和积累,这种现象称为氧化暴发(oxidative burst)。植物体内的活性氧主要是:过氧化氢(H2O2)、超氧阴离子(O2·-)、羟自由基(·OH)和单线态氧(1O2)。活性氧在植物抗病防卫反应中有着极其重要和积极的生理作用(傅爱根等,2000)。大量研究表明在寄主植物和病原菌互作的早期常有氧化暴发现象,这些释放的活性氧在寄主植物防卫反应及信号传递过程中都扮演着重要的角色。大量的寄主植物互作系统中都发现了这一现象,包括寄主植物与真菌、细菌和病毒的互作。活性氧的产生是一个典型的往往在互作的早期发生的现象,对其后的一系列防卫事件及互作关系的确定具有重要的作用(Baker et al., 1993)。另外,细胞间的pH的变化与氧化突发也紧密相关,并且通过pH值的提高,使膜上相关的蛋白被激发(Hahlbrock et al.,1995;Segal et al.,1981)。在本研究中,抗病的I-72杨悬浮细胞O2·-的释放表现出了“氧化突发”现象,而感病的加杨悬浮细胞O2·-释放量一直处于较低水平;pH的变化也有同样的规律,这一结果与Doke(1983)和Orlandi等(1991)的研究结果相类似。抗病树种表现的这一规律,将有助于对杨树抗病性遗传和抗病基因的研究。
Adam等(1989)在研究香假单孢(P.syringae pv. pisi)引发烟草(Nicotiana tobacum)悬浮细胞叶片或黄瓜(Cucumis sativus)子叶的HR中,证明O2·-直接启动膜脂过氧化的发生,说明氧突发和膜脂过氧化有一定的因果关系。但在本研究中,虽然感病杨树和激发子互作后活性氧的释放水平一直很低,但膜脂过氧化水平却在2 h后也有一个高峰,只是比抗病杨树慢1 h。抗病杨树和感病杨树的膜脂过氧化差异,主要区别是否在于发生的时间上而不是水平上,这一点还要做进一步的证明。
毕咏梅, 欧阳光察. 1990. 稻瘟诱导物对水稻苯丙烷类途径酶系和绿原酸的诱导作用. 植物生理学通讯, 26(3): 18-20. |
傅爱根, 罗广平, 王爱国. 2000. 活性氧在植物抗病反应中的作用. 热带亚热带植物学报, 8(1): 63-69. DOI:10.3969/j.issn.1005-3395.2000.01.011 |
梁伟红, 韩正敏. 2006. 杨盘二孢菌激发子粗提物生物活性的研究. 南京林业大学学报, 30(3): 71-74. DOI:10.3969/j.issn.1000-2006.2006.03.015 |
王影, 黄敏仁. 1991. 杨树细胞悬浮培养及体细胞胚胎发生的研究. 南京林业大学学报, 15(3): 31-36. |
余叔文, 汤章城. 1999. 植物生理与分子生物学. 2版. 北京: 科学出版社.
|
Adam A, Farkas T, Somiyal G, et al. 1989. Consequence of O2·- generation during a bacteria induced hypersensitive reaction in tobacco: Deterioration of membrane lipids. Physiol Mol Plant Pathol, 34: 13-19. DOI:10.1016/0885-5765(89)90013-1 |
Baker C J, Mock N M, Glazener J, et al. 1993. Recognition response in pathogen/non-host and race/cultivar interactions involving soybean and pseudomonas syringae pathovars. Physiol Mol Plant Pathol, 43(2): 81-94. DOI:10.1006/pmpp.1993.1042 |
Currinder S C. 1989. Somatic embryogenesis and plant regeneration from cell suspension and tissue culture of mature Himalayan popular(Populus ciliata). Plant Cell Report, 8: 124-127. DOI:10.1007/BF00716855 |
Doke N. 1983. Involvement of superoxide anion generation in the hypersensitive response of potato tuber tissues to infection with an incompatible race of Phytophthora inferstans and to the hyphal cell wall components. Physiol Plant Pathol, 23: 345-357. DOI:10.1016/0048-4059(83)90019-X |
Hahlbrock K, Scheel D, Logemann E, et al. 1995. Oligopeptide elicitor-mediate defense gene activation in cultured parsley cell. Proc Natl Acad Sci U.S.A., 92: 4150-4157. DOI:10.1073/pnas.92.10.4150 |
Keppler L D, Baker C J. 1989. Initiated lipid peroxidation in a bacteria-induced hypersensitive reaction in tobacco cell suspentions. Phytopathology, 79: 555-562. DOI:10.1094/Phyto-79-555 |
Orlandi E W, Hutcheson S W, Backer C J. 1992. Early physiological response associate with race-specific recognition in soybean leaf tissue and cell suspension treated with Pseudomonas syringae pv. glycinea. Physiol and Mol Plant Pathol, 40: 173-179. DOI:10.1016/0885-5765(92)90058-4 |
Segal A W, Geisow M, Garcia R, et al. 1981. The respiratory burst of phagocytic cell is associated with a rise in vacuolar pH. Nature, 290: 406-409. DOI:10.1038/290406a0 |
 2007, Vol. 43
2007, Vol. 43

