文章信息
- 孔冬梅, 沈海龙, 冯丹丹, 张莉杰.
- Kong Dongmei, Shen Hailong, Feng Dandan, Zhang Lijie.
- 水曲柳体细胞胚与合子胚发生的细胞学研究
- Cytological Investigation of Somatic and Zygotic Embryogenesis of Fraxinus mandshurica
- 林业科学, 2006, 42(12): 130-133.
- Scientia Silvae Sinicae, 2006, 42(12): 130-133.
-
文章历史
- 收稿日期:2005-11-07
-
作者相关文章
2. 东北林业大学林学院 哈尔滨 150040
2. College of Forestry, Northeast Forestry University Harbin 150040
水曲柳(Fraxinus mandshurica)属木犀科(Oleaceae)白蜡树属, 是我国东北重要珍贵硬阔树种之一,主要分布于小兴安岭、长白山、辽宁东部山地等地区, 以材质优良而著称。由于长期不合理的采伐利用,目前可利用的资源急剧减少,已被列为国家三级保护植物(傅立国,1992)。进行水曲柳体细胞胚胎发生的研究,在资源保护、树种快繁和基因工程育种上有其重要的现实意义。
由于体细胞胚胎发生重演了合子胚形态发生的进程,因而了解合子胚的形态发生对确定体细胞胚诱导和培养条件,了解体细胞胚发生和细胞分化机制具有重要指导作用。反过来,体细胞胚胎发生体系的建立和调控又可为合子胚发育机制提供重要信息,进而为生殖生物学的研究提供一些基础资料。2种胚胎发生体系在形态解剖、生理生化及分子水平上的比较已在多种植物上有过研究,如心叶椴(Tilia cordata)(Anna, 2000)、海岸松(Pinus pinaster)(Jordy et al., 2003)、Ensete superbum(Mathew et al., 2003),但水曲柳有关方面的研究还是空白。为此,本研究将水曲柳的体细胞胚与合子胚发生的细胞学过程作了比较,这将为水曲柳有关方面的研究提供一些基础资料。
1 材料与方法 1.1 试验材料用于细胞学观察和体细胞胚诱导的合子胚均采自东北林业大学哈尔滨实验林场50年生发育良好的水曲柳母树。
1.2 合子胚发生的细胞学观察于2002年、2003年,从水曲柳雄花序即将散粉开始,每天定时采集数枚雌花或幼嫩种子,直至种胚形态分化完全为止。材料用FAA固定液固定,艾氏苏木精整染,常规石蜡切片法切成9 ~10 μm厚的切片,Olympus光学显微镜下镜检,观察合子胚的发生过程。
1.3 体细胞胚的诱导于2003年7月末到8月中旬,采集水曲柳子叶胚时期的近成熟种子,表面消毒后剥取种胚,分别切取子叶和下胚轴2种外植体接种于1/2MS(MS基本培养基的所有成分均减半)培养基上。培养基中附加NAA 1 mg·L-1,IBA 5 mg·L-1,BA 10 mg·L-1,蔗糖5 0%,琼脂0.6%。高压灭菌前将pH值调至5.8,于23~25 ℃的培养室内进行暗培养。初代培养8周后将培养物转至不含生长调节剂的相同培养基上进行继代培养。
1.4 体细胞胚发生的细胞学观察分别从初代培养第1天和继代培养第1天起,每隔5 d取少量培养物,同前法进行固定、染色、切片、镜检,观察愈伤组织的形成及体细胞胚的发生。
2 结果与分析 2.1 合子胚发生的细胞学观察水曲柳传粉受精后,胚乳的发育早于胚的发育,其发育属核型。受精后的初生胚乳核分裂先形成具多核仁的游离核(图版Ⅰ-1),分裂达到一定程度时,胚的发育才开始。合子分裂形成一大一小2个细胞,即靠合点端的顶细胞和珠孔端的基细胞。顶细胞体积小,胞质浓厚,基细胞具大液泡,此时为2细胞原胚期。2细胞原胚进一步分裂,形成4细胞原胚。顶细胞分裂较快,新形成的靠近珠孔端的细胞与基细胞一起参与胚柄的建成。顶细胞分裂形成的靠近合点端的细胞经过多次不规则的分裂,形成原胚,而后合点端原胚细胞数目增多,棒状胚逐渐延长,并开始出现器官分化。原胚形成后的发育很快,依次经历球形胚、心形胚、鱼雷形胚和子叶形胚,最后发育成成熟胚(图版Ⅰ-2~6)。随着原胚的发育,胚柄也不断发育,到球形胚末期时最为发达(图版Ⅰ-3)。心形胚时期,胚柄开始退化,到子叶胚早期,仅见部分残留(图版Ⅰ-6)。水曲柳胚胎发育为紫菀型。早期的胚包裹在胚乳内靠近珠孔端,随着胚的形态分化和体积的增大,最后充满整个胚乳腔。
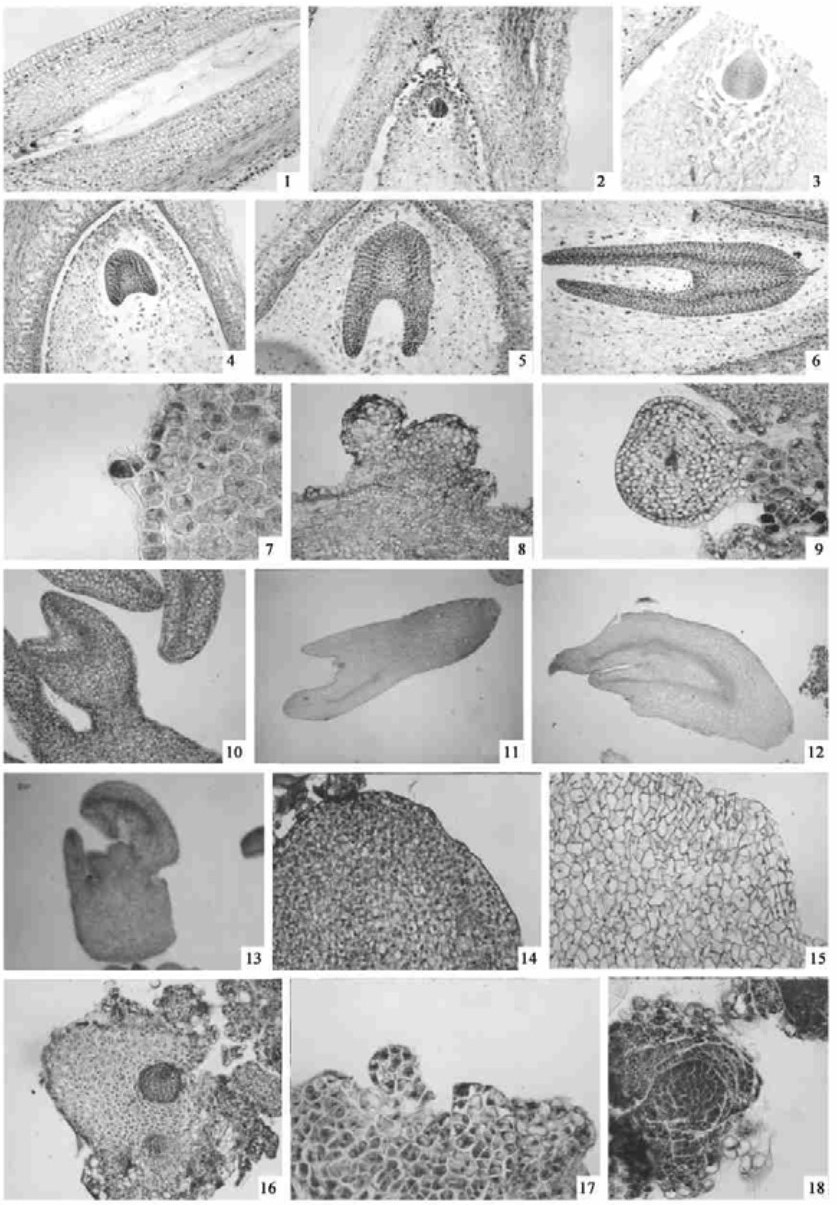
|
图版Ⅰ Plate Ⅰ 图版说明 图版Ⅰ 1. 胚乳游离核(×132);2. 合子胚的早期原胚(×33);3. 球形合子胚具发达的胚柄(×33);4. 心形合子胚(×33);5. 鱼雷形合子胚(×33);6. 子叶形合子胚(×33);7. 子叶表皮细胞形成的4细胞原胚(×132);8. 体细胞胚发生于子叶表皮细胞(×33);9. 子叶表面形成的心形胚(×66);10. 鱼雷形体细胞胚(×33);11. 子叶形体细胞胚, 具双极性(×132);12. 缺乏茎维管束分化的体细胞胚(×33);13. 多子叶体细胞胚(×33);14. 胚性愈伤组织(×66);15. 非胚性愈伤组织(×66);16. 愈伤组织内的胚性细胞团(×33);17. 体细胞胚发生于愈伤组织表面(×33);18. 体细胞胚发生于愈伤组织内部(×66). Explanation of Plate Plate Ⅰ 1. Free endosperm nucleus(×132); 2. Early zygotic proembryo(×33); 3. Globular zygotic embryo with developed suspensor(×33); 4. Heart zygotic embryo(×33); 5. Totpedo zygotic embryo(×33); 6. Cotyledonary zygotic embryo(×33); 7. A 4-cell proembryo occurred from epidermal cells of the cotyledon(×132); 8. Somatic embryos occurred from epidermal cells of the cotyledon(×33); 9. Heart somatic embryo originated from epidermis cells of cotyledon(×66); 10. Torpedo somatic embryo(×33); 11. Cotyledonary somatic embryo with bipolarity(×132); 12. Somatic embryo without stem vascular(×33); 13. Somatic embryo with many cotyledons(×33); 14. Embryogenic callus(×66); 15. Non-embryogenic callus(×66); 16. Embryogenic cell mass in the callus(×33); 17. Somatic embryo occurred from surface of callus(×33); 18. Somatic embryo occurred from internal callus(×66). |
原胚发育到4细胞时,胚乳开始细胞化,并按从珠孔端到合点端的顺序进行。到球形胚时,胚乳已很丰富。球形胚末期时,胚乳细胞开始解体(图版Ⅰ-3)。胚胎发育到心形胚时期,胚体周围形成了空腔(图版Ⅰ-4),这可能是胚乳为提供胚胎发育所需营养而水解成小分子物质所致。
2.2 体细胞胚发生的细胞学观察1) 直接体细胞胚胎发生 初代培养几天后,所有外植体全部褐化。第7周时,褐化子叶近尖端的边缘处形成白色具有光泽的体细胞胚,以后体细胞胚逐渐覆盖整个外植体。这些体细胞胚与原组织的连接松散,很容易从外植体分离下来。
解剖观察发现体细胞胚由外植体的单个表皮细胞发育而来。胚性细胞第1次分裂为不均等分裂,形成2细胞原胚,2细胞原胚的顶、基2个细胞再次分裂,形成4细胞原胚(图版Ⅰ-7),随着分裂的进行,细胞数目不断增多。原胚结构形成后,表面细胞和内部细胞多次分裂,形成球形胚(图版Ⅰ-8)。之后,球形胚进行纵向伸长,两侧细胞分裂较快,向外突出,形成心形胚(图版Ⅰ-9)。接着,2片子叶长大,胚状体下方伸长,内部有原形成层出现,此时进入鱼雷胚期(图版Ⅰ-10)。此后子叶继续伸长,出现苗端分生组织而成为子叶胚。体细胞胚从心形胚阶段开始出现了维管束的分化,子叶胚时期可见维管束呈明显的“Y”字形,与母体组织相对独立,有根分生组织与茎分生组织,表现明显的双极性(图版Ⅰ-11)。
体细胞胚以胚柄状结构与外植体相连(图版Ⅰ-10),但在其整个发育过程中,没有明显的胚柄。观察中还发现,相当一部分体细胞胚形态异常,主要表现为没有茎维管束的分化(图版Ⅰ -12)和多子叶(图版Ⅰ-13)。
初生胚继代培养2周后,有大量次生胚形成。次生胚直接发生于初生胚下胚轴或子叶的表皮细胞,与直接形成的初生胚发生类似。
2) 间接体细胞胚胎发生 初代培养5周后,子叶和下胚轴2种外植体都可产生愈伤组织。愈伤组织从颜色和状态上可以分为3种类型,即嫩黄疏松状:表面粗糙但有光泽,发生于胚轴形态学下端和子叶基部,量多;白色疏松状:发生于嫩黄愈伤组织上,或胚轴形态学下端,量少;黄褐色紧实:表面大颗粒状,发生于胚轴形态学下端和子叶基部,量多。前2种愈伤组织若不及时继代,就会老化为第3种。
嫩黄疏松、白色疏松、黄褐紧实3种类型愈伤组织中,前2种愈伤组织可以产生体细胞胚,为胚性愈伤组织,第3种为非胚性愈伤组织。
切片观察表明,胚性愈伤组织细胞小,壁厚,胞质浓厚,核大,核仁明显(图版Ⅰ-14)。非胚性愈伤组织细胞大,不规则形状,核小,偏向细胞一侧(图版Ⅰ-15)。体细胞胚发生于胚性愈伤组织的表面或内部。发生于组织内部的,愈伤组织内部一般先形成染色较深的密集细胞群,即胚性细胞团,其细胞排列规则,细胞明显小于周围细胞,核则更大,核仁明显,细胞团以一圈具明显厚壁的细胞形成界限,与周围细胞隔开(图版Ⅰ-16)。以后由整个胚性细胞团形成体细胞胚(图版Ⅰ-18),这样的体细胞胚是多细胞起源的,通常以下端较大区域与愈伤组织相连。发生于愈伤组织表面的体细胞胚为单细胞起源,一般只在基部与愈伤组织相连, 制片过程中很容易脱落(图版Ⅰ-17)。间接发生的体细胞胚也未见到明显的胚柄结构,其发育过程与直接发生的体细胞胚基本一致。
3 结论与讨论水曲柳体细胞胚发生经历了与合子胚发生类似的历程,即都经历了原胚、心形胚、鱼雷形胚和子叶胚这4个典型发育时期,最后发育为成熟胚。但也存在一些明显的差别,主要表现为以下几点:水曲柳体细胞胚体积一般小于相同发育阶段的合子胚;体细胞胚一般没有明显的胚柄,只是以胚柄状结构与原组织相连,而在合子胚发生中,原胚一形成便具有明显的胚柄结构,胚柄在球形胚阶段最为发达,到心形胚时期,胚柄开始退化,到子叶胚早期仍可见其残留;体细胞胚在形态发生上不像合子胚那么精确而规范,畸形胚状体的发生比较多见。
合子胚的发育中,胚柄的出现与胚的营养吸收是分不开的。水曲柳合子在第1次分裂后就形成胚柄细胞,到球形胚时期胚柄达到最发达,而此时胚乳也相当发达。心形胚时期,胚体开始动用胚乳的营养,胚乳逐渐水解成小分子物质供胚体吸收,并在胚体周围形成空腔,与之相伴随的是胚柄开始退化,到子叶胚早期时仅见部分残留。而在体细胞胚发生中,营养物质是人为提供且均匀一致的,体细胞胚通过与培养基的直接接触吸收营养,无需经胚柄供应,胚柄因功能的丧失而消失。杜克久等(1997)在云南大叶茶(Camellia sinensis var. assamica)体细胞胚发生中也观察到类似现象,即体细胞胚的胚柄较早消失。看来,胚柄不形成或较早消失是体细胞胚胎发生中的一个普遍现象。
水曲柳的合子胚中未发现任何形态异常现象,但体细胞胚有一定的畸形胚发生。合子胚外面的种皮限制种胚及其附属组织发育的空间,使种胚在大小和形态上形成一定的种属特征(黄学林等,1995)。体细胞胚没有种皮和胚乳的机械约束,这是导致部分体细胞胚发育畸形的原因之一。畸形胚的出现是一些植物体细胞胚发育存在的难题之一(张存旭等,2004),已有研究表明,体细胞胚的形态与能否正常萌发有很大关系,畸形胚的萌发率要远远低于正常胚(Lazzeri et al., 1987; Wetzstein et al., 1993)。
周俊彦(1981)曾报道,大多数植物体细胞胚胎发生为外起源,即从外植体表面发生。在水曲柳体细胞胚发生中,子叶外植体可以外起源的方式直接产生体细胞胚,而经愈伤组织形成的体细胞胚则外起源和内起源2种方式都有。本研究还观察到,内起源的胚状体,从原胚时起就与周围组织间有一明显界限,这与Zee等(1980)在芹菜(Apium graveolens var. dulce)、詹园凤等(2006)在大蒜(Allium ampeloprasum)体细胞胚培养中观察到的现象类似。崔凯荣等(2000)也在宁夏枸杞(Lycium barbarum)、小麦(Triticum aestivum)、红豆草(Onobrychis viciaefolia)等多种植物中观察到,早期的胚性细胞与周围细胞间存在胞间连丝,但随着胚性细胞的发育,细胞壁加厚,胞间连丝消失或被堵塞,从2细胞原胚到多细胞原胚始终被厚壁包围,与周围细胞形成明显的界限。这表明体细胞胚形成后具有相对独立性,支持了Steward等(1958)的观点,即细胞与周围组织间的生理隔离是胚状体发生的先决条件。
弄清体细胞胚的起源和发育细节有助于更好地利用体细胞胚发生技术来开展遗传工程(Fernando et al., 2001; Loiseau et al., 1998)。单细胞起源的体细胞胚再生出的植物,由于在基因组成上完全一致,是基因转化的良好受体。水曲柳体细胞胚发生有单细胞和多细胞起源2种。从整体看,直接起源于子叶表皮单细胞的体细胞胚占较高比例,这预示以合子胚的子叶为外植体建立体胚发生系统, 将对水曲柳育种工程的开展发挥巨大潜力。
水曲柳体细胞胚与合子胚发生在细胞学程序基本一致的前提下,存在一些不可忽视的差异,这些差异或多或少影响了体细胞胚的萌发和成苗。了解这些差异产生的原因,需要从生理生化及分子生物学方面去作更深入的研究,同时,对体细胞胚发生分子机制的了解,将有助于体细胞胚发生系统的完善和有效利用。
崔凯荣, 戴若兰. 2000. 植物体细胞胚发生的分子生物学. 北京: 科学出版社, 22-25.
|
杜克久, 曹慧娟, 张辉, 等. 1997. 云南大叶茶体细胞胚发生及体细胞胚苗形成体系的建立. 植物学报, 39(2): 1126-1130. |
黄学林, 李莜菊. 1995. 高等植物组织离体培养的形态建成及其调控. 北京: 科学出版社, 150-205.
|
傅立国. 1992. 中国植物红皮书——稀有濒危植物:第1册. 北京: 科学出版社, 736.
|
詹园凤, 王广东. 2006. 大蒜体细胞胚胎发生的组织学研究. 农业生物技术科学, 22(1): 46-48. |
张存旭, 姚增玉. 2004. 栎属植物体细胞胚胎发生研究现状. 西北植物学报, 24(2): 356-362. DOI:10.3321/j.issn:1000-4025.2004.02.030 |
周俊彦. 1981. 植物体细胞在组织培养中产生的胚状体Ⅰ:胚状体的发生和发育. 植物生理学报, 7(4): 389-398. |
Anna K. 2000. Anatomical study of zygotic and somatic embryos of Tilia cordata. Plant Cell, Tissue and Organ Culture, 61: 205-214. DOI:10.1023/A:1006455603528 |
Fernando J A, Melo M, Soares M K M, et al. 2001. Anatomy of somatic embryogenesis in Carica papaya L. Crazilian Archives of Biology and Technology, 44(3): 247-255. DOI:10.1590/S1516-89132001000300005 |
Jordy M N, Favre J M. 2003. Spatio-temporal variations in starch accumulation during germination and post-germinative growth of zygotic and somatic embryos of Pinus pinaster. Biologia Plantarum, 46(4): 507-512. DOI:10.1023/A:1024847007935 |
Lazzeri P A, Hildebrand D F, Collins G B. 1987. Soybean somatic embryogenesis: effects of nutritional, physical and chemical factors. Plant Cell, Tissue and Organ Culture, 10: 209-220. DOI:10.1007/BF00037305 |
Loiseau J, Michaux-Ferrière N, Deunff Y Le. 1998. Histology of somatic embryogenesis in pea. Plant Physiology and Biochemistry, 36(9): 683-687. DOI:10.1016/S0981-9428(98)80017-X |
Mathew M M, Philip V J. 2003. Somatic embryogenesis versus zygotic embryogenesis in Ensete superbum. Plant Cell, Tissue and Organ Culture, 72: 267-275. DOI:10.1023/A:1022311126043 |
Steward F C, Mapes M O, Mears K. 1958. Growth and organized development of cultured cells Ⅲ: Interpretations of the growth from free cell to carrot plant. American Journal of Botany, 45: 705-708. DOI:10.1002/j.1537-2197.1958.tb10599.x |
Wetzstein H Y, Baker C M. 1993. The relationship between somatic embryo morphology and conversion in peanut (Arachis hypogaea L.). Plant Science, 92: 81-89. DOI:10.1016/0168-9452(93)90068-B |
Zee S Y, Wu S G. 1980. Somatic embryogenesis in the leaf explants of Chinese celery. Austrilian Journal of Botany, 28: 429-436. DOI:10.1071/BT9800429 |
 2006, Vol. 42
2006, Vol. 42
